
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Относительные противопоказания к ТЛТ
1.Устойчивая, плохо контролируемая АГ в анамнезе.
2.Наличие плохо контролируемой АГ (в момент госпитализации систолическое АД > 180, а диастолическое > 110 мм рт. ст.).
3.Ишемический инсульт давностью более 3 месяцев.
4.Деменция или внутричерепная патология, не указанная в «абсолютных противопоказаниях».
5.Травматическая или длительная (более 10 мин) сердечно-легочная реанимация или обширное оперативное вмешательство, перенесенное в течение последних 3 недель.
6.Недавнее (в течение предыдущих 2-4 недель) внутреннее кровотечение.
7.Пункция сосуда, не поддающегося прижатию.
8.Для стрептокиназы - введение стрептокиназы, в том числе модифицированной, более 5 суток назад или известная аллергия на нее.
9.Беременность.
10.Обострение язвенной болезни.
11.Прием антикоагулянтов непрямого действия (чем выше международное нормализованное отношение [MHO], тем выше риск кровотечения).
ТЛТ дает благоприятный эффект независимо от пола больного, сопутствующего систолического АД (если оно < 180 мм рт. ст.), ЧСС и перенесенных ранее ИМ. Степень снижения летальности при ТЛТ более значительна у больных с передним ИМ, у пожилых, у пациентов с вновь возникшей блокадой левой ножки пучка Гиса, больных с признаками обширной ишемии по данным ЭКГ.
В качестве тромболитических препаратов используют стрептокиназу, рекомбинантный тканевый активатор плаз-миногена (алтеплаза) и его модификацию - тенектеплазу, модифицированную (рекомбинантную) проурокиназу (пуролаза).
Стрептокиназа вводится в дозе 1 500 ООО ME за 30-60 мин в небольшом количестве 0,9 % раствора натрия хлорида. Коронарный кровоток удается восстановить в среднем в 55 % случаев.
При использовании стрептокиназы, особенно недостаточно очищенных препаратов, могут наблюдаться снижение АД, брадикардия, анафилактическая реакция вплоть до шока. Стрептокиназа - чужеродный для организма белок, ее введение вызывает выработку антител. Это делает повторное ее использование позже 5 дней и в последующем неэффективным и даже опасным. Стрептокиназа относится к так называемым нефибринспецифичным тромболитикам. Она приводит к более выраженному снижению уровня фибриногена в общем кровотоке, чем фибринспецифичные (обладающие сродством к фибрину тромба) препараты.
Преимущество рекомбинантного тканевого активатора плазминогена и его производных, а также пуролазы заключается в отсутствии антигенности, что позволяет повторно вводить препараты в любое время, как только в этом появляется необходимость, и в тропности к фибрину тромба, что до 70 % повышает частоту восстановления коронарного кровотока при их использовании.
Рекомбинантный тканевый активатор плазминогена (алтеплаза) вводится внутривенно (предварительно препарат растворяют в 100-200 мл дистиллированной воды или 0,9 % раствора натрия хлорида) по схеме «болюс + инфузия». Доза препарата - 1 мг/кг (но не более 100 мг). Болюс составляет 15 мг; последующая инфузия - 0,75 мг/кг за 30 мин (но не более 50 мг), затем 0,5 мг/кг (но не более 35 мг) за 60 мин (общая продолжительность инфузии 1,5 ч).
Отличие тенектеплазы от алтеплазы состоит в том, что более длительный период полувыведения из организма позволяет использовать первый препарат в виде однократного болюса, что особенно удобно при лечении на догоспитальном этапе. Дозировка определяется массой тела больного: 30 мг - при массе тела менее 60 кг, 35 мг при 60-70 кг; 40 мг - при 70-80 кг; 45 мг - при 80-90 кг и 50 мг - при массе тела более 90 кг.
Пуролаза вводится внутривенно (предварительно препарат растворяют в 100-200 мл дистиллированной воды или 0,9 % раствора натрия хлорида) по схеме «болюс + инфузия». Болюс составляет 2 000 000 ME; последующая инфузия - 4 000 000 ME в течение 30-60 мин. В табл. 4 приведены наиболее часто используемые режимы ТЛТ.
| Препарат | Первичное лечение | Вспомогательная антитромбоци- тарная терапия | Специфические противопоказания |
| Стреп- токи- наза | 1 500 000 ME в 100 мл 5 % глюкозы или 0,9 % физиологического раствора в течение 30-60 мин | Без гепарина или внутривенно гепарин в течение 24-48 ч | Уже введенные срептокиназа или анизолиро- ванный актива- торный комплекс стрептокиназы с плазминогеном |
| Алте- плаза | 15 мг внутривенно болюс, затем 0,75 мг/кг в течение 30 мин, далее 0,5 мг/кг в течение 60 мин внутривенно. Общая доза не должна превышать 100 мг | Внутривенно гепарин в течение 24-48 ч | |
| Тенек- теплаза | Внутривенный болюс однократно 30 мг при массе тела < 60 кг 35 мг - 60-70 кг 40 мг - 70-80 кг 45 мг - 80-90 кг 50 мг - > 90 кг | Внутривенно гепарин в течение 24-48ч |
Наиболее частое осложнение ТЛТ - кровотечения (большие и малые), а самое тяжелое из них - геморрагический инсульт, который наблюдается на ее фоне у 1,2 % больных. К факторам риска геморрагического инсульта относят пожилой возраст, массу тела < 70 кг, САД > > 170 мм рт. ст. На фоне использования тканевого активатора плазминогена геморрагический инсульт развивается чаще, чем при терапии стрептокиназой. Риск кровотечений возрастает в зависимости от перечисленных выше факторов. Вероятность геморрагического инсульта повышается при сочетанном применении стрептокиназы и гепарина. Риск больших кровотечений (требующих переливания крови) составляет 4-13 %. Он более значителен у людей старше 75 лет, женщин, при массе тела менее 70 кг, а также при передозировке антикоагулянтов. Наиболее частый источник кровотечений - места пункций сосудов, однако нередко развиваются и внутренние кровотечения - из желудочно-кишечного тракта, почек. Иногда кровь изливается забрюшинно: в паранефральную клетчатку и по ходу подвздошно-поясничной мышцы. Все эти факторы должны учитываться при решении вопроса о проведении ТЛТ с относительными противопоказаниями. Применение НМГ и особенно фондапаринукса снижает, но не исключает риск развития кровотечений.
Следует помнить, что проявления неврологической симптоматики в первые 24 ч после проведения ТЛТ, как правило, бывает следствием внутричерепного кровоизлияния, поэтому прием антикоагулянтов, тромболитических и антитромбоцитарных средств должен быть немедленно прекращен. Тактика обследования и лечения больного согласуется с неврологом. Необходимо стабилизировать состояние больного, в частности с помощью введения свежезамороженной плазмы, протаминсульфата, тромбоцитарной массы, криопреципитата. Таков же поход к лечению и других кровотечений.
При повторной окклюзии или повторном ИМ, сопровождающихся повторным смещением сегмента ST и блокадой левой ножки пучка Гиса, ТЛТ применяют в том случае, если механическая реперфузия не доступна. Вместе с тем подчеркивается, что стрептокиназа и анизолированный активаторный комплекс стрептокиназы с плазминогеном не должны назначаться в период от 5 дней до 2 лет после их первоначального введения, поскольку антитела на стрептокиназу сохраняются, по крайней мере, в течение 10 лет. Но тканевый активатор плазминогена и его производные не вызывают формирование антител. Повторное введение фибринолитических агентов может привести к таким осложнениям, как кровотечение.
Острый инфаркт миокарда — острое заболевание, обусловленное развитием очагов некроза в сердечном мышце в результате нарушения ее кровоснабжения, которое возникает вследствие тромбоза коронарной артерии или резкого ее сужения атеросклеротической и бляшкой. В исключительно редких случаях нарушение коронарного кровотока происходит в результате спазма напряженной коронарной артерии (этот механизм развития инфаркта чаще наблюдается у молодых лиц). При инфаркте миокарда имеется стойкое нарушение коронарного кровообращения в отличие от стенокардии, при которой это нарушение преходяще (непродолжительное). Инфаркт миокарда поражает почти исключительно желудочки (преимущественно левый), значительно реже очаги некроза отмечаются в предсердиях.
При инфаркте миокарда развивается некроз (омертвение) части сердечной мышцы. Очаг некроза может быть большой по величине (крупноочаговый инфаркт миокарда) или эти очаги небольшие (мелкоочаговый инфаркт миокарда). Если очаг некроза поражает всю толщу стенки желудочка (от эндокарда до эпикарда), то такой инфаркт называют трансмуральным (всегда крупноочаговый). Исходом инфаркта является рубцевание очага некроза — так называемый постинфарктный кардиосклероз.Инфаркт миокарда развивается у людей зрелого и преклонного возраста, чаще у мужчин. В последние 5—20 лет нередко инфаркт миокарда регистрируется у людей моложе 40 лет и даже у 25—30-летних. После 60 лет инфаркт миокарда встречается с практически одинаковой частотой, как у мужчин, так и у женщин.
Симптоматика. Основной симптом инфаркта миокарда — длительный болевой приступ в области сердца и за грудиной. Боль возникает внезапно и довольно быстро достигает большой выраженности, может иррадиировать в левую руку, лопатку, нижнюю челюсть, межлопаточное пространство. В отличие от боли при стенокардии при инфаркте миокарда боль значительно интенсивнее и не купируется приемом нитроглицерина. Такой вариант начала инфаркта является типичным (так называемый ангинозный статус).
Вместе с тем встречаются атипичные варианты. Так, боль может локализоваться в подложечной области, сопровождаться тошнотой и рвотой. В таких случаях обычно ставят неправильный диагноз (острое заболевание органов брюшной полости, пищевая токсикоинфекция). Этот вариант начала болезни называется «гастралгическим статусом». Наконец, болезнь может начаться приступом удушья (приступ сердечной астмы) — так называемый астматический статус. При таком варианте начала инфаркта миокарда боли в области сердца могут отсутствовать. Более редкими атипичными вариантами начала инфаркта миокарда являются аритмический (болезнь начинается остро развившимся нарушением ритма сердца) и апоплектиформный (похожий на нарушение мозгового кровообращения). Наконец, у пожилых людей может быть безболевое начало инфаркта миокарда, о заболевании сердца начинают догадываться, когда у больного развивается сердечная недостаточность.
Во время приступа болей или удушья больной испытывает страх смерти, он бледен, на лбу выступает холодный пот. Отмечается снижение артериального давления или оно перестает определяться. Пульс малый, частый, иногда аритмичный вследствие возникающей экстрасистолии или мерцательной аритмии. Могут также возникать приступы пароксизмальной тахикардии или полной поперечной блокады сердца. При аускультации отмечается глухость тонов.
На вторые сутки повышается температура тела до субфебрильной (и даже фебрильной) и держится повышенной не более 3—5 дней. При ослаблении организма у лиц старческого возраста температура тела может не повышаться. По данным лабораторного исследования крови выявляется нейтрофильный лейкоцитоз со сдвигом влево, а начиная с 3-го дня увеличивается СОЭ (в это время количество лейкоцитов приходит к норме). В крови повышается уровень грубодисперсных фракций белка (глобулины, фибриноген). На ЭКГ появляются характерные изменения комплекса QRS и зубца Т. При мелкоочаговом инфаркте миокарда на ЭКГ отмечаются лишь изменения зубца Т.
После острой стадии болезни, когда с помощью медикаментов пройдет болевой синдром и снизится давление, больной может чувствовать себя вполне удовлетворительно, приступы стенокардии могут не беспокоить. У части больных стенокардия возобновляется. В некоторых случаях, если первый же приступ болей привел развитию инфаркта миокарда, стенокардия также исчезает. В остром периоде миокарда (первые 10 дней) могут возникнуть серьезные осложнения: кардиогенный шок, левожелудочковая недостаточность, нарушения ритма и проводимости. Все эти осложнения обусловливают наибольшую летальность именно в первые часы от начала заболевания.
Радиогенный шок заключается в резком падении артериального давления вследствие резкого снижения сократительной функции сердца при одновременном снижении периферического сосудистого сопротивления. Систолическое давление у нормотоников оказывается ниже 80—85 мм рт. ст., у гипертоников ниже 90—95 мм рт. ст. Имеются так называемые периферические признаки: холодная бледная кожа с умеренным цианозом, покрытая холодным липким потом, заторможенность, спутанное сознание или даже временная потеря сознания. Постоянным признаком кардиогенного шока является олиго- или анурия. Пульс учащен, малого наполнения, иногда не определяется. Нередко выявляются стойкие расстройства ритма сердца.
Левожелудочковая недостаточность при инфаркте миокарда проявляется приступом сердечной астмы и отека легкого (подробнее о симптоматике лечении см. «Острая сердечная недостаточность»).
Лечение. Для лечения больного с острым инфарктом применяют ряд мероприятий:
1) купирование болевого приступа;
2) антикоагулянтную и фибринолитическую терапию;
3) профилактику и купирование нарушений ритма сердца;
4) лечение осложнений.
Болевой приступ купируется введением наркотических анальгетиков (морфин, омнопон, промедол), но более эффективной является нейролептаналгезия (дроперидол — нейролептическое средство и фентанил — обезболивающий препарат). Антикоагулянтная и фибринолитическая терапия проводится для прекращения начавшегося тромбоза коронарной артерии, профилактики нового тромбоза предупреждения тромбоэмболических осложнений. Внутривенно капельно вводят фибринолизин в сочетании с гепарином в течение 3—7 дней, а затем больного переводят на прием непрямых антикоагулянтов (фенилин, пелентан). Гепарин вводят под контролем свертываемости крови, непрямые антикоагулянты дозируют с учетом протромбинового времени.
При возникновении осложнений характер терапии зависит от вида осложнения.
Для борьбы с кардиогенным шоком используют периферические вазодилататоры (нитропруссид натрия или нитроглицерин внутривенно капельно) в сочетании с допамином, улучшающим сократительную функцию непораженного миокарда. Возможно применение в некоторых случаях норадреналина, способствующего повышению артериального давления. У части больных кардиогенный шок сопровождается депонированием крови в сосудах брюшной полости и уменьшением объема циркулирующей крови. В таком случае показано внутривенное капельное введение кровезамещающего препарата полиглюкина. Если инфаркт миокарда развился в общественном месте, немедленно вызывают машину скорой медицинской помощи и больного госпитализируют в ближайший стационар. Инфаркт миокарда может возникнуть дома, тогда больного также госпитализируют.
В домашних условиях трудно обеспечить постоянное наблюдение врача, особенно в тех случаях, когда течение болезни осложняется. В настоящее время существует система специализированной кардиологической скорой помощи: машины скорой медицинской помощи оснащены необходимыми приборами, инструментарием, персонал специально обучен. Больного обычно госпитализируют в блоки интенсивной терапии (БИТ), оснащенные современной медицинской аппаратурой, где больному обеспечено круглосуточное наблюдение. Организация специализированных бригад скорой медицинской помощи и БИТов позволила снизить летальность от острого инфаркта миокарда, так как максимум смертей приходится именно на первые часы и дни болезни. В связи с этим немедленная госпитализация больного имеет большое значение в благоприятном исходе болезни.
В БИТе больной соблюдает строгий постельный режим, но при неосложненном инфаркте миокарда постепенная активизация проводится уже с первых дней после купирования болевого приступа. К концу 1-й недели больной под контролем методиста по лечебной физкультуре (ЛФК) садится на кровати, на 10 — 11-й день ему разрешается сидеть и ходить до туалета. К концу 2-й недели больной совершает прогулки по коридору на 100—200 м в 2—3 приема, а к концу 3-й недели — длительные прогулки, осваивает пролет лестницы. После выписки из стационара рекомендуется лечение в течение месяца в местном кардиологическом стационаре.
Если инфаркт миокарда протекает с осложнениями (длительно держащиеся нарушения ритма, сердечная недостаточность), то темпы активизации больного, сколько замедляются, а сама активизация проводится под строгим контролем за пульсом артериальным давлением. Медикаментозное лечение острого инфаркта миокарда (не имеются в виду осложнения) сводится к назначению средств, предупреждающих приступы стенокардии, а также непрямых антикоагулянтов.
Большое значение лечении больного с острым инфарктом миокарда имеет правильный уход. Так как больной достаточно длительное время соблюдает постельный режим, который сам по себе способствует замедлению кровотока в периферических отделах сосудистой системы; кроме того, снижение сократительной функции сердца также ведет к нарушению активной циркуляции крови. Для предупреждения развития пролежней и гнойничковых поражений кожи (пиодермия) следует регулярно протирать кожу больного камфорным спиртом, разбавленным одеколоном, а затем вытирать сухим полотенцем. В первые дни болезни для осуществления акта дефекации больному подкладывают судно, после чего подмывают теплой водой. Для мочеиспускания дают утку.
Больного аккуратно кормят в постели. Для смены белья больного осторожно поворачивают в постели, кроме того, для профилактики развития венозных тромбозов 3 раза в день поворачивают с бока на бок. Во время этой процедуры больной не должен делать резких движений, не должен напрягаться. Вставать с постели больной должен постепенно. Вначале он садится, для чего к спинке кровати привязывают полотенце, за конец которого больной держится, когда садится. В первые дни больной должен садиться и вставать в присутствии медицинской сестры. При этом следует следить за пульсом и артериальным давлением.
При возникновении инфаркта миокарда бригада специализированной скорой медицинской помощи оказывает первую помощь на догоспитальном этапе на месте. При выведении больного из кардиогенного шока, купирования приступа сердечной астмы, нарушений ритма сердца больного госпитализируют. Когда острый период пройдет, больного переводят в палату. После выписки из стационара больной проходит курс лечения в специализированном санатории. Уже на этапе госпитального лечения больному проводится курс физического лечения: массаж, ЛФК. Далее физические тренировки по особой программе с учетом особенности течения болезни, наличия или отсутствия осложнений проводятся в палате, а затем санатории, где большое место уделяется дозированной ходьбе.
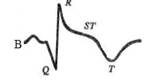 
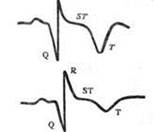
| Рис. 30.Изменения ЭКГ при остром инфаркте миокарда (схема). А — ишемическая стадия: резкий подъем сегмента S Т, сливающегося с зубцом Т. Б — острая стадия: сформировался глубокий, широкий зубец Q. В — под-острая стадия: сегмент S Т на изолинии, сформировался глубокий отрицательный зубец Т («коронарный»). Г — рубцовая стадия: сохраняется патологический зубец Q, амплитуда «коронарного» зубца Т уменьшилась. |
Кардиогенный шок – крайняя степень острой левожелудочковой недостаточности, характеризующаяся резким снижение сократительной функции миокарда (падение ударного и минутного выброса), которое не компенсируется повышением сосудистого сопротивления и приводит к неадекватному кровоснабжению всех органов и тканей. Является причиной смерти 60 % больных инфарктом миокарда. Выделяют следующие формы кардиогенного шока: - рефлекторный, - истинный кардиогенный, - ареактивный, - аритмический, - из-за разрыва миокарда. Патогенез кардиогенного шока Патогенез рефлекторной формы кардиогенного шока Рефлекторная форма занимает особое место среди других форм кардиогенного шока. В ее происхождении основную роль играет не столько тяжелое поражение миокарда, сколько отсутствие компенсаторного повышения периферического сосудистого сопротивления. Напротив, при рефлекторной форме кардиогенного шока наблюдается расширение периферических сосудов и падение артериального давления, тяжелого поражения миокарда нет. Рефлекторная форма кардиогенного шока обусловлена развитием рефлекса Бецольда-Яриша с рецепторов левого желудочка при ишемии миокарда. Задняя стенка левого желудочка обладает большей чувствительностью к раздражению этих рецепторов. Поэтому рефлекторная форма шока чаще наблюдается в периоде интенсивных болей при инфаркте миокарда задней стенки левого желудочка. Учитывая патогенетические особенности рефлекторной формы кардиогенного шока, более правильной следует считать точку зрения, согласно которой надо эту форму считать не шоком, а болевым коллапсом или резко выраженной артериальной гипотензией у больного с ИМ. Патогенез истинного кардиогенного шока Именно эта форма кардиогенного шока полностью соответствует определению шока при инфаркте миокарда, которое было приведено выше. Истинный кардиогенный шок, как правило, развивается при обширном трансмуральном инфаркте миокарда. Более чем у 1/3 больных на секции обнаруживается стенозирование 75% или более просвета трех основных коронарных артерий, включая переднюю нисходящую коронарную артерию. При этом почти у всех больных с кардиогенным шоком имеется тромботическая коронарная окклюзия (Antman, Braunwald, 2001). Возможность развития кардиогенного шока значительно возрастает у больных с повторным ИМ. Основными патогенетическими факторами истинного кардиогенного шока являются следующие. 1.Снижение насосной (сократительной) функции миокарда Этот патогенетический фактор является основным. Снижение сократительной функции миокарда обусловлено прежде всего выключением некротизированного миокарда из процесса сокращения. Кардиогенный шок развивается при величине зоны некроза равной или превышающей 40% массы миокарда левого желудочка. Большая роль принадлежит также состоянию периинфарктной зоны, в которой при наиболее тяжелом течении шока образуются некрозы (таким образом инфаркт расширяется), о чем свидетельствует стойкий подъем в крови уровня КФК-МВ и KФK-MBmass. Большую роль в снижении сократительной функции миокарда играет также процесс его ремоделирования, начинающийся уже в первые дни (даже часы) после развития острой коронарной окклюзии. 2. Развитие патофизиологического порочного круга При кардиогенном шоке у больных инфарктом миокарда развивается патофизиологический порочный круг, который усугубляет течение этого грозного осложнения инфаркта миокарда. Начинается этот механизм с того, что в результате развития некроза, особенно обширного и трансмурального, происходит резкое снижение систолической и диастолической функции миокарда левого желудочка. Выраженное падение ударного объема приводит, в конечном счете, к снижению давления в аорте и уменьшению коронарного перфузионного давления и, следовательно, к уменьшению коронарного кровотока. В свою очередь, снижение коронарного кровотока усугубляет ишемию миокарда и тем самым еще больше нарушает систолическую и диастолическую функции миокарда. Неспособность левого желудочка к опорожнению также приводит к увеличению преднагрузки. Под преднагрузкой понимают степень растяжения сердца во время диастолы, она зависит от величины венозного притока крови к сердцу и растяжимости миокарда. Увеличение преднагрузки сопровождается расширением неповрежденного хорошо перфузируемого миокарда, что в свою очередь в соответствии с механизмом Франка-Старлинга, ведет к увеличению силы сердечных сокращений. Этот компенсаторный механизм восстанавливает ударный объем, но фракция выброса — показатель глобальной сократимости миокарда — снижается в связи с ростом конечного диастолического объема. Наряду с этим дилатация левого желудочка приводит к повышению постнагрузки — т.е. степени напряжения миокарда во время систолы в соответствии с законом Лапласа. Этот закон гласит, что напряжение волокон миокарда равно произведению давления в полости желудочка на радиус желудочка, деленному на толщину стенки желудочка. Таким образом, при одном и том же аортальном давлении постнагрузка, которую испытывает дилатированный желудочек, выше, чем при нормальных размерах желудочка (Braunwald, 2001). Однако величина постнагрузки определяется не только размерами левого желудочка (в данном случае степенью его дилатации), но и системным сосудистым сопротивлением. Снижение сердечного выброса при кардиогенном шоке приводит к компенсаторному периферическому вазоспазму, в развитии которого принимают участие симпатоадреналовая система, эндотелиальные вазоконстрикторные факторы, система ренин-ангиотензин-II. Повышение системного периферического сопротивления направлено на повышение артериального давления и улучшение кровоснабжения жизненно важных органов, но оно значительно увеличивает постнагрузку, что в свою очередь ведет к повышению потребности миокарда в кислороде, усугублению ишемии и дальнейшему снижению сократительной способности миокарда и увеличению конечного диастолического объема левого желудочка. Последнее обстоятельство способствует увеличению легочного застоя и, следовательно, гипоксии, которая усугубляет ишемию миокарда и снижение его сократительной способности. Далее все снова происходит так, как было описано выше. 3. Нарушения в системе микроциркуляции и уменьшение объема циркулирующей крови Как указывалось ранее, при истинном кардиогенном шоке возникают распространенная вазоконстрикция и увеличение общего периферического сосудистого сопротивления. Эта реакция носит компенсаторный характер и направлена на поддержание артериального давления и обеспечение кровотока в жизненно важных органах (головном мозге, почках, печени, миокарде). Однако продолжающаяся вазоконстрикция приобретает патологическое значение, так как приводит к гипоперфузии тканей и нарушениям в системе микроциркуляции. Микроциркуляторная система является наибольшей сосудистой емкостью в организме человека, составляя свыше 90% сосудистого русла. Микроциркуляторные нарушения способствуют развитию тканевой гипоксии. Метаболические продукты тканевой гипоксии вызывают дилатацию артериол и прекапиллярных сфинктеров, а более резистентные к гипоксии венулы остаются спазмированными, в результате чего кровь депонируется в капиллярной сети, что приводит к уменьшению массы циркулирующей крови. Наблюдается также выход жидкой части крови в тканевые интерстициалъные пространства. Уменьшение венозного возврата крови и количества циркулирующей крови способствует дальнейшему снижению сердечного выброса и гипоперфузии тканей, еще больше усугубляет периферические микроциркуля-торные нарушения вплоть до полного прекращения кровотока с развитием полиорганной недостаточности. Кроме того, в микроциркуляторном русле снижается стабильность форменных элементов крови, развивается внутрисосудистая агрегация тромбоцитов и эритроцитов, повышается вязкость крови, возникают микротромбозы. Эти явления усугубляют тканевую гипоксию. Таким образом, можно считать, что и на уровне системы микроциркуляции развивается своеобразный патофизиологический порочный круг. Патогенез ареактивной формы кардиогенного шока Аналогичен патогенезу истинного кардиогенного шока, но патогенетические факторы значительно более выражены, действуют продолжительнее, и шок ареактивен по отношению к лечебным мероприятиям. Патогенез аритмической формы кардиогенного шока Аритмическая форма кардиогенного шока обусловлена чаще всего пароксизмальгой желудочковой тахикардией, пароксизмом трепетания предсердия или дистальным типом полной атриовентрикулярной блокады. Соответственно можно различать тахисистолический и брадисистолический варианты аритмической формы кардиогенного шока. Развитие аритмического кардиогенного шока обусловлено уменьшением ударного объема и сердечного выброса (минутного объема крови) при названных аритмиях и атриовентрикулярной блокаде с последующим включением вышеуказанных патофизиологических порочных кругов. Патогенез шока из-за разрывов миокарда При инфаркте миокарда могут быть внутренние и наружные разрывы миокарда. Основными патогенетическими факторами шока, обусловленного разрывом миокарда, являются:
Примечания:
2. Нарушение сознания (заторможенность, спутанность сознания, возможно бессознательное состояние, реже — возбуждение)
Поставить клинический диагноз кардиогенного шока у больных инфарктом миокарда можно на основании обнаружения первых 6 доступных критериев. Определение гемодинамических критериев (пункт 7) для постановки диагноза кардиогенного шока обычно не является обязательным, но весьма целесообразно для организации правильного лечения. Клиническая картина рефлекторной формы кардиогенного шока Клиническая картина аритмической формы кардиогенного шока ЛЕЧЕНИЕ КАРДИОГЕННОГО ШОКА Лечебная программа
- обезболивание (особое имеет значение при рефлекторной форме шока – позволяет стабилизировать гемодинамику), |
Сердечная астма. Отек легких Развитие этих осложнений связано со слабостью сократительной функции миокарда левого желудочка при массивном некротическом поражении миокарда и резком повышении диастолического давления в левом желудочке. Левожелудочковая недостаточность возникает во время болевого приступа или сразу после его окончания. ПАТОГЕНЕЗ В патогенезе левожелудочковой недостаточности имеют значение не только снижение насосной функции сердца, но и рефлекторный спазм легочных сосудов (рефлекс Катаева), повышение проницаемости капиллярной стенки в результате гипоксии и активизации симпатоадреналовой системы. В результате резко повышается давление в легочных венах и капиллярах, происходит выход жидкой части крови из их просвета вначале в ткань легких (интерстициальный отек), а затем в альвеолы (альвеолярный отек). КЛИНИКА Сердечная астма клинически проявляется в виде приступа удушья, который сопровождается бледностью кожных покровов, акроцианозом и появлением холодного пота. Больной возбужден, чувствует страх смерти, принимает вынужденное положение-ортопноэ. Аускультативно в легких (вначале только в нижних отделах, а затем над всей поверхностью) определяются влажные хрипы, нередко сочетающиеся с сухими свистящими хрипами, вызванными сопутствующим бронхоспазмом. При прогрессировании отека влажные хрипы усиливаются, дыхание становится клокочущим, появляется пенистая мокрота, часто с примесью крови. Рентгенологически определяется картина «застойного легкого» с облаковидным прикорневым сгущением легочного рисунка, постепенно просветляющимся к периферии.
Нарушения ритма и проводимости. Нарушения ритма и проводимости возникают у подавляющего большинства больных инфарктом миокарда. В связи с образованием очага некроза снижается порог возбудимости миокарда, возникают очаги патологической импульсации, создаются условия для механизма «re-entry», замедляется внутрисердечная проводимость. Нарушения ритма и проводимости при инфаркте миокарда часто носят транзиторный характер. Возникновение аритмии значительно изменяет гемодинамику. Нарушения ритма, сопровождающиеся тахикардией со значительным снижением ударного и минутного выброса (тахисистолическая форма мерцательной аритмии, пароксизмальная желудочковая тахикардия), являются прогностически неблагоприятными. Они могут вызвать в дальнейшем развитие аритмогенного шока или острой сердечной недостаточности. Некоторые аритмии могут предшествовать или провоцировать другие более тяжелые и прогностически неблагоприятные нарушения ритма. Полная атриовентрикулярная блокада может сопровождаться приступами Морганьи-Адамса-Стокса в виде кратковременной потери сознания с судорогами и вызывать развитие сердечной недостаточности.
Определение Тромбоэмболия легочной артерии (ТЭЛА) - это окклюзия артериального русла легких тромбом, первично образовавшимся в венах большого круга кровообращения либо в полостях правого отдела сердца и мигрировавшим в сосуды легких с током крови.
ТЭЛА - одно из наиболее распространенных и грозных осложнений многих заболеваний, послеоперационного и послеродового периодов, неблагоприятно влияющее на их течение и исход. В условиях многопрофильного клинического стационара ТЭЛА ежегодно наблюдается у 15-20 из 1000 лечившихся больных, в том числе у 3 - 5 пациентов со смертельным исходом [1].
Своевременная диагностика ТЭЛА до настоящего времени представляет значительные трудности в связи с полиморфизмом развивающихся клинических синдромов, невозможностью использовать в ряде лечебных стационаров высокоинформативных методов исследования (перфузионная сцинтиграфия легких, ангиопульмонография), внезапностью развития и катастрофической быстротой течения заболевания. По данным патологоанатомических исследований, даже среди больных с массивной и субмассивной ТЭЛА правильный диагноз устанавливается лишь у 30%, поэтому смертность от легочной эмболии среди госпитализированных пациентов обусловлена в большей степени диагностическими ошибками, чем неадекватностью терапии [2]. Значительное число больных умирают в первые часы от начала заболевания, не получая адекватного лечения. При этом летальность среди нелеченых пациентов достигает 30%, при рано начатой терапии антикоагулянтами она не превышает 10% [3].
Date: 2015-07-02; view: 560; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |