
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Закономерности коагуляции гидрофобных золей электролитами
1. Все сильные электролиты вызывают коагуляцию золей при увеличении концентрации их в растворе до величины порога коагуляции.
2. Коагулирующий ион несет заряд, противоположный знаку заряда коллоидной частицы. Коагуляция наступает в тот момент, когда заряд частицы становится равным нулю (правило Гарди).
3. По правилу Шульце-Гарди коагулирующая способность иона тем больше, чем выше его валентность. Причем величина коагулирующей способности одно-, двух- и трехзарядных противоионов образует ряд чисел 1:60:700 (что хорошо согласуется с законом «шестой степени» Дерягина - Ландау),
4. Коагулирующая способность ионов одной и той же валентности возрастает с увеличением радиуса иона.
Лиотропный ряд катионов: Cs+>Rb+>K+>Na+>Li+.
Литропный ряд анионов: CNS->J->NO3->Br->Cl-.
5. При коагуляции золя смесью двух электролитов наблюдаются случаи аддитивного коагулирующего действия двух и более противоионов, а также антагонизма и синергизма.
Аддитивное действие электролитов (линия 1 рис. 3). Электроли-ты действуют независимо один от другого, их суммарное действие складывается из воздействий каждого из электролитов. Если с1´ - концентрация первого электролита, то для коагуляции золя концентрация второго электролита должна быть равной с2´. Аддитивность наблюдается обычно при сходстве коагулирующей способности обоих электролитов.
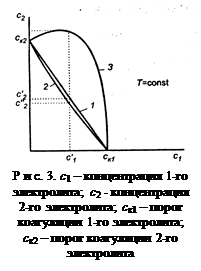 Синергизм действия (линия 2 рис. 3). Электролиты способствуют друг другу – для коагуляции их требуется меньше, чем нужно по правилу аддитивности (с2″ < c2′). Условия, при которых наблюдается синергизм, сформулировать трудно.
Синергизм действия (линия 2 рис. 3). Электролиты способствуют друг другу – для коагуляции их требуется меньше, чем нужно по правилу аддитивности (с2″ < c2′). Условия, при которых наблюдается синергизм, сформулировать трудно.
Антагонизм действия (линия 3 рис. 3). Электролиты противодей-ствуют друг другу и для коагуляции их следует добавить больше, чем требуется по правилу аддитивности. Антагонизм наблюдается при большом различии в коагулирующем действии электролитов.
6. Взаимная коагуляция разнородных дисперсных систем называется гетерокоагуляцией. Взаимную коагуляцию разноименно заряженных частиц широко используют в процессах водоподготовки и очистки природных и промышленных вод.
Date: 2015-07-02; view: 578; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |