
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Схема 29.Схема биосинтеза инсулина и секреторного механизма бета-клеток
Находящиеся в секреторной грануле 3 белка (инсулин, С-пептид и проинсулин) различаются биологической активностью и длительностью существования. Так, период полураспада инсулина составляет 3-10 мин, С-пептида – около 30 мин, проинсулина – около 20-23 мин. Если принять биологическую активность за 100%, то проинсулин обладает 10% активности, интермедиат-I – около 25%, а С -пептид таковой не обладает. Имеющиеся в нашем распоряжении методы оценки биологической активности перечисленных биологических веществ действительно показывают, что С-пептид является биологически неактивной частью молекулы проинсулина. Однако в последние годы показано, что применение С-пептида вместе с инсулином для лечения больных, страдающих инсулинозависимым диабетом, приводит к стабилизации сосудистых осложнений диабета и отдаляет появление новых проявлений ангиопатии. В случае нарушения конверсии проинсулина в инсулин (недостаточность соответствующих протеаз) в циркуляцию будет поступать большое количество проинсулина, что может сопровождаться нарушением углеводного обмена различной степени выраженности, вплоть до явного диабета.
Механизм действия инсулина. Практически во всех тканях организма инсулин влияет на обмен углеводов, жиров, белков и электролитов, увеличивая транспорт глюкозы, белка и других веществ через мембрану клетки. Своё биологическое действие на уровне клетки инсулин осуществляет через соответствующий рецептор.
Рецептор к инсулину представляет собой тетрамерную белковую структуру, являющуюся составной частью мембраны клетки. В многочисленных исследованиях установлено, что рецептор включает две субъединицы, каждая из которых также состоит из двух частей. Полипептидная цепь a-субъединицы состоит из 719 аминокислотных остатков, а ее молекулярная масса (мол.м.) – 135000 D. b-Субъединица включает 620 аминокислотных остатков и имеет мол.м. 95000D.
Рецептор выполняет три основные функции: 1) с высокой специфичностью распознает в молекуле места связывания инсулина и осуществляет комплексирование с последним; 2) опосредует передачу соответствующего сигнала, направленного на активизацию внутриклеточных обменных процессов; 3) осуществляет эндоцитоз (погружение внутрь клетки) гормонорецепторного комплекса, что приводит к лизосомальному протеолизу инсулина с одновременным возвращением субъединицы к мембране клетки.
Гормонорецепторное взаимодействие осуществляет a-субъединица рецептора, содержащая связывающие места; b-субъединица обладает тирозинкиназной активностью, которая повышается под влиянием инсулина после его связывания с a-субъединицей.
Ген, ответственный за синтез рецептора к инсулину, локализуется на коротком плече 19-й хромосомы. Период полураспада (существования) мРНК-рецептора к инсулину составляет 2 ч.
Электронномикроскопические исследования показали, что после связывания инсулина с рецептором клетки весь комплекс погружается в цитоплазму, достигает лизосом, где и разрушается. Период полураспада собственно рецептора составляет 7-12 ч, но в присутствии инсулина уменьшается до 2-3 ч. В лизосомах под влиянием протеолитических ферментов происходит диссоциация инсулинорецепторного комплекса, и рецептор возвращается к мембране клетки (функция шатла). Прежде чем рецептор подвергнется деградации, он успевает несколько раз переместиться от мембраны к лизосомам и обратно (рециклизация рецептора).
Трансмембранная передача сигнала и механизм действия инсулина изучены еще не до конца. Если для многих полипептидных гормонов вторичным мессенджером является цАМФ, то механизм передачи действия инсулина оказался значительно сложнее, и в этом процессе важную роль играет инсулинорецепторная протеинкиназа, которая катализирует перенос фосфатных групп с АТФ на гидроксильные остатки аминокислот в протеинкиназах.
Взаимодействие инсулина с рецептором приводит к повышению активности протеинкиназы С, фосфорилированию остатков тирозина рецептора и стимуляции последующего самофосфорилирования рецептора. Кроме того, взаимодействие инсулина с рецептором приводит к стимуляции специфической фосфолипазы С, к гидролизу гликозилфосфатидилинозитола и образованию двух вторичных мессенджеров: инозитолтрифосфата и диацилглицерина. Инозитолтрифосфат высвобождает кальций из эндоплазматического ретикулума. Диацилглицерин действует на кальмодулин и протеинкиназу С, которая фосфорилирует различные субстраты, приводя к изменению активности клеточных систем.
Основное действие инсулина заключается в усилении транспорта глюкозы через мембрану клетки. Стимуляция инсулином приводит к увеличению скорости поступления глюкозы внутрь клетки в 20-40 раз. Транспорт глюкозы через мембрану клетки осуществляется белками-транспортерами. При стимуляции инсулином наблюдается увеличение в 5-10 раз содержания транспортных белков глюкозы в плазматических мембранах при одновременном уменьшении на 50-60% их содержания во внутриклеточном пуле. Требующееся при этом количество энергии в виде АТФ необходимо в основном для активации инсулинового рецептора, а не для фосфорилирования белка-транпортера. Стимуляция транспорта глюкозы увеличивает потребление энергии в 20-30 раз, тогда как для перемещения транспортеров глюкозы требуется лишь незначительное ее количество.
Транслокация транспортеров глюкозы к мембране клетки наблюдается уже через несколько минут после взаимодействия инсулина с рецептором, и для ускорения или поддержания процесса рециклирования белков-транспортеров необходимо дальнейшее стимулирующее влияние инсулина.
Идентифицировано два класса транспортеров глюкозы: Na+-глюкозный котранспортер и пять изоформ собственных транспортеров глюкозы (G. Bell и соавт., 1990). Cогласно данным этих авторов, Na+-глюкозный котранспортер, или симпортер, экспрессируется специальными эпителиальными реснитчатыми клетками тонкой кишки и проксимального отдела канальцев почек. Этот белок осуществляет активный транспорт глюкозы из просвета кишки или нефрона против градиента её концентрации путем связывания глюкозы с теми ионами натрия, которые транспортируются ниже градиента концентрации. Градиент концентрации Na+ поддерживается активным белком-транспортером натрия через поверхность пограничных реснитчатых клеток посредством мембраносвязанных Na+, K+-зависимой АТФазы. Молекула этого белка – транспортера состоит из 664 аминокислотных остатков, его синтез кодируется геном, расположенным на 22-й хромосоме.
Второй класс переносчиков глюкозы представлен собственными транспортерами глюкозы. Это мембранные белки, находящиеся на поверхности всех клеток и осуществляющие транспорт глюкозы ниже градиента ее концентрации посредством соответствующей диффузии, т.е. путем пассивного транспорта, при котором транслокация глюкозы через билипидную мембрану клетки ускоряется мембранносвязанным транспортным белком. Транспортеры глюкозы первично осуществляют транспорт глюкозы не только в клетку, но и из клетки. Транспортеры II класса участвуют и во внутриклеточном перемещении глюкозы. Глюкоза абсорбируется на поверхности эпителиальых клеток, обращенных в просвет кишки или нефрона, с помощью Nа+-глюкозного котранспортера.
Факторами, регулирующими экспрессию транспортеров глюкозы, являются инсулин, факторы роста, перорально вводимые препараты, снижающие уровень сахара, ванадий, глюкокортикоиды, цАМФ, голодание, дифференцировка клеток и протеинкиназа С.
ГЛЮТ-1 (эритроцитарный тип) – первый клонированный белок-транспортер. Ген, кодирующий этот белок, расположен на I-й хромосоме. ГЛЮТ-1 экспрессируется во многих тканях и клетках: эритроцитах, плаценте, почках, толстой кишке. По данным K. Kaestner и соавт. (1991), синтез ГЛЮТ-1 и ГЛЮТ-4 в адипоцитах транскрипционно регулируется цАМФ реципрокным способом. Наряду с этим экспрессия ГЛЮТ-1 в мышцах стимулируется угнетением N-связанного гликозилирования (F. Maher, L. Harrison, 1991).
ГЛЮТ-2 (печеночный тип) синтезируется только в печени, почках, тонкой кишке (базолатеральная мембрана) и панкреатических b-клетках. Молекула ГЛЮТ-2 включает 524 аминокислотных остатка. Ген, кодирующий этот белок, локализуется на 3-й хромосоме. Изменение количества или структурной формы ГЛЮТ-2 вызывает снижение чувствительности b-клеток к глюкозе. Это происходит при сахарном диабете II типа, когда наблюдается индукция экспрессии ГЛЮТ-2 в проксимальных канальцах почек, причем количество ГЛЮТ-2 мРНК увеличивается в 6,5 раза, а количество ГЛЮТ-1 мРНК уменьшается до 72% от нормы (J.H. Dominguez и соавт., 1991).
ГЛЮТ-3 (мозговой тип) экспрессируется во многих тканях: мозге, плаценте, почках, скелетных мышцах плода (уровень этого белка в скелетных мышцах взрослого человека низкий). Молекула ГЛЮТ-3 состоит из 496 аминокислотных остатков. Ген, кодирующий этот белок, расположен на 12-й хромосоме.
ГЛЮТ-4 (мышечно-жировой тип) содержится в тканях, где транспорт глюкозы быстро и значительно увеличивается после воздействия инсулина: скелетной белой и красной мышцах, белой и коричневой жировой клетчатке, мышце сердца. Молекула белка состоит из 509 аминокислотных остатков. Ген, кодирующий ГЛЮТ-4, локализуется на 17-й хромосоме. Основной причиной клеточной резистентности к инсулину при ожирении и инсулиннезависимом диабете (ИНЗД), по данным W.Garvey и соавт. (1991), является претрансляционное угнетение синтеза ГЛЮТ-4, однако его содержание в мышечных волокнах I и II типа у больных ИНЗД при ожирении и нарушении толерантности к глюкозе одинаково. Резистентность мышц этих больных к инсулину, вероятно, связана не с уменьшением количества ГЛЮТ-4, а с изменением их функциональной активности или нарушением транслокации.
ГЛЮТ-5 (кишечный тип) находится в тонкой кишке, почках, скелетных мышцах и жировой ткани. Молекула этого белка состоит из 501 аминокислотного остатка. Ген, кодирующий синтез белка, расположен на 1-й хромосоме.
После взаимодействия инсулина с рецептором происходит внедрение в клетку гормонорецепторного комплекса. Этот процесс включает инвагинацию участка мембраны, где происходит кластеризация инсулинорецепторного комплекса, и образование пиноцитотического пузырька, который отщепляется от мембраны и поступает внутрь клетки. Процесс энергозависим, и количество поглощенного гормонорецепторного комплекса пропорционально количеству инсулина, связанного с плазматической мембраной. Это свидетельствует о том, что комплексирование является определяющим и контролирующим моментом данного процесса. Обычно эндоцитотический пузырек соединяется с лизосомами, располагающимися в комплексе Гольджи, где осуществляется деградация гормонорецепторного комплекса и происходит отщепление рецептора, который возвращается на мембрану клетки. Процесс рециркуляции инсулиновых рецепторов, транслокация и циркуляция белков-переносчиков глюкозы имеют много общих черт. В частности, для перемещения этих субстратов в обоих направлениях требуется определенное количество энергии, полный цикл рециркуляции занимает 5-10 мин, а интенсивность этих процессов уменьшается при снижении температуры инкубационной среды.
Деградация связанного с рецептором гормона и индуцированное инсулином снижение концентрации рецепторов (так называемый феномен регулируемого понижения, или down regulation) являются взаимосвязанными процессами. Существует состояние динамического равновесия между скоростью внедрения инсулинорецепторных комплексов, их деградацией и рециркуляцией, повторным включением в структуру мембраны, а также скоростью их синтеза. Это подтверждается тем фактом, что концентрация инсулина, необходимая для начала снижения концентрации рецепторов, обратно пропорциональна величине и скорости внедрения гормона в клетку; при условиях, вызывающих уменьшение количества рецепторов, повышается скорость пиноцитоза в клетке.
Действие инсулина начинается с процесса его соединения с a-субъединицей рецептора. Образование инсулинорецепторного комплекса – основной момент в дальнейшем проявлении многочисленных биологических эффектов инсулина. Связывание инсулина с рецептором приводит к его самофосфорилированию с участием рецепторной протеинкиназы, что происходит до или в период поглощения инсулинрецепторного комплекса. Активированный таким образом рецептор с участием фосфолипазы С способствует гидролизу мембранных фосфолипидов (гликозилфосфатидилинозитол), сопровождающемуся образованием инозитолтрифосфата и диацилглицерина. Активированный рецептор запускает цепочку последовательного фосфорилирования других белков, включая серинкиназную активность. Он, возможно, также взаимодействует с ГТФ-связывающими белками или цАМФ, приводя к активированию фосфорилирования/дефосфорилирования, стимулирует фосфодиэстеразу, снижает активность протеинкиназы, результатом чего и является изменение функции мембраны клетки.
Одновременно с этим процесс внедрения в клетку инсулинорецепторного комплекса влияет на эндоплазматический ретикулум, активируя рециркуляцию белков-транспортеров глюкозы внутрь клетки. Этот же комплекс взаимодействует с микросомами, лизосомами и ядерными структурами. После диссоциации рецептор возвращается на мембрану клетки, а инсулин активирует процессы дефосфорилирования ядерных белков, изменяет обмен мРНК, приводя к увеличению синтеза белков и другим “поздним” эффектам биологического действия инсулина.
Большая часть инсулина метаболизируется в печени, причем за один пассаж в ней задерживается 40-60% гормона, поступающего из системы портальной вены.
Около 40% инсулина (по данным некоторых авторов, 15-20%) инактивируется почками. Следует отметить, что при почечной недостаточности поглощение и деградация инсулина почками уменьшаются до 9-10%, поэтому у больных сахарным диабетом при почечной недостаточности потребность в инсулине уменьшается. Роль почек в инактивации экзогенного инсулина велика, так как, всасываясь из места инъекции, инсулин попадает в большой круг кровоснабжения и почки, а эндогенный инсулин сначала поступает в печень и лишь затем меньшая его часть – в большой круг кровообращения и почки. В почках инсулин фильтруется в клубочках, а в проксимальных канальцах почти полностью реабсорбируется и разрушается протеолитическими ферментами, причем эндосомально-лизосомальный путь инактивации инсулина в почечных канальцах практически отсутствует.
Состояние углеводного обмена определяется количеством рецепторов и их способностью связываться с инсулином. Так, в адипоцитах на одну клетку приходится до 50 000 рецепторов, в гепатоцитах – до 250 000, в моноцитах и эритроцитах – на порядок меньше.
Функция b-клеток заключается в поддержании энергетического гомеостаза в организме, и энергетические рецепторы этих клеток воспринимают минимальные отклонения в изменении содержания в крови калоригенных молекул, к которым относятся глюкоза, аминокислоты, кетоновые тела и жирные кислоты. Физиологические концентрации D-глюкозы, L-аминокислот, кетоновых тел и жирных кислот стимулируют секрецию инсулина, в то время как метаболиты (лактат, пируват, глицерин) на нее не влияют. Необходимо подчеркнуть, что стимулирующее действие кетоновых тел, жирных кислот и аминокислот проявляется при определенном (субстимулирующем) уровне глюкозы, и в этой связи правильнее было бы называть эти вещества глюкозависимыми стимуляторами секреции инсулина.
Содержание глюкозы в сыворотке крови является отражением состояния двух постоянно меняющихся процессов, находящихся под постоянным контролем инсулина: утилизации глюкозы тканями и поступления глюкозы в кровоток.
Глюкоза, поступающая в кровь из желудочно-кишечного тракта, способствует более значительному высвобождению инсулина из b-клеток поджелудочной железы и, естественно, более высокому уровню инсулина в сыворотке крови по сравнению с тем же количеством глюкозы, но введенной внутривенно. Такая разница в высвобождении инсулина в ответ на одинаковое количество глюкозы объясняется тем, что поступившая в желудочно-кишечный тракт глюкоза стимулирует секрецию инсулина не только через повышение ее уровня в крови, но и посредством активизации механизма, включающего секрецию ряда гормонов желудочно-кишечного тракта: гастрина, секретина, панкреозимина, глюкагона, желудочного ингибиторного полипептида, глюкозозависимого инсулинотропного пептида.
Белки и аминокислоты также стимулируют высвобождение инсулина. Из аминокислот наиболее выраженное влияние на секрецию инсулина оказывают аргинин и лизин.
В контроле секреции инсулина важное место отводится и другим факторам – влиянию симпатической и парасимпатической нервной системы, СТГ, гормонов коры надпочечников, плацентарного лактогена, эстрогенов и др.
Секреция инсулина в ответ на стимуляцию глюкозой представляет собой двухфазную реакцию, состоящую из стадии быстрого, раннего высвобождения инсулина, называемую первой фазой секреции (продолжительность ее 1-3 мин), и второй фазы (продолжительность ее до 25-30 мин).
Механизм высвобождения инсулина является многокомпонентной системой, в которой основная роль принадлежит цАМФ и ионам кальция. Активирование процессов высвобождения инсулина сопровождается повышением концентрации внутриклеточного кальция. Под влиянием глюкозы увеличивается перемещение кальция из внеклеточной жидкости внутрь клетки. Изменяются скорость его связывания с кальмодулином и диссоциация комплекса кальций – кальмодулин.
Глюкагон. Вскоре после получения коммерческих препаратов инсулина было установлено, что в экстрактах поджелудочной железы содержится фактор, вызывающий гипогликемию, – глюкагон. Глюкагон является полипептидом с такой последовательностью 29 аминокислотных остатков: NH2-Гис-Сер-Гли-Гли-Тре-Фен-Тре-Сер-Асп-Тир-Сер-Лиз-Тир-Лей-Асп-Сер-Арг-Арг-Ала-Гли-Асп-Фен-Вал-Глн-Три-Лей-Мет-Асн-Тре-СО2Н.
Следует подчеркнуть, что глюкагон человека, свиньи и крупного рогатого скота имеет одинаковую последовательность аминокислотных остатков. Мол.м глюкагона 3485 D. В кристаллической форме глюкагон является тримером с большим содержанием вторичной структуры.
В процессе биосинтеза глюкагона вначале образуется проглюкагон с мол.м. 18000 D и периодом полураспада около 1 ч. Метаболизм и деградация глюкагона происходят в печени и почках.
Глюкагон, секретируюмый a-клетками островков Лангерганса, вначале попадает в межклеточное пространство и интерстициальную жидкость, а затем с током крови через портальную вену в печень, где он увеличивает гликогенолиз, снижает утилизацию глюкозы и синтез гликогена, повышает глюконеогенез и образование кетоновых тел. Суммарным эффектом этих воздействий является увеличение образования и выхода глюкозы из печени. В периферических тканях глюкагон оказывает липолитическое действие, повышая липолиз, снижая липогенез и белковый синтез. Липолиз активируется гормончувствительной липазой.
Не исключена возможность, что в организме транспорт глюкагона осуществляется в связанном с глобулинами состоянии. Этим, в частности, объясняются данные, показывающие, что полупериод исчезновения глюкагона плазмы крови составляет от 3 до 16 мин. Свободные формы глюкагона метаболизируют и удаляются из крови быстро, тогда как глюкагон, связанный с белками плазмы, метаболизируется более медленно. Концентрация глюкагона в портальной вене составляет от 300 до 4500 пг/мл, тогда как в периферической крови – до 90 пг/мл и в ответ на введение аргинина или панкреозимина увеличивается до 1200 пг/мл.
Рецепторы к глюкагону, изолированные из плазматических мембран печени крысы, относятся к гликолипопротеидам (мол.м. около 190 000 D) и состоят из нескольких субъединиц (мол.м. около 25 000 D). Способность рецепторов к глюкагону взаимодействовать с соответствующим гормоном непостоянна и зависит от нескольких факторов. Связывание глюкагона с рецепторами уменьшается при гиперглюкагонемии, вызванной длительным голоданием, инсулиновой недостаточностью или экзогенным введением глюкагона. Однако, несмотря на такую обратную регуляцию, процесс активирования аденилатциклазы под влиянием глюкагона не изменяется. Это состояние достигается тем, что оставшиеся рецепторы приобретают повышенную способность к комплексированию с гормоном.
Основное гликогенолитическое действие глюкагона осуществляется в печени, где он связывается с рецепторами гепатоцитов и активирует аденилатциклазу, которая переводит АТФ в цАМФ. Далее активизируется цАМФ-зависимая протеинкиназа, которая стимулирует фосфорилазу киназы. Последняя конвертирует неактивную фосфорилазу в активную ее форму (фосфорилазу А), под влиянием которой ускоряется гликогенолиз. Наряду с этим протеинкиназа инактивирует гликогенсинтазу, вследствие чего замедляется синтез гликогена.
Разрушение глюкагона происходит в печени и почках. Ферментная система, разрушающая глюкагон, по одним данным, отличается от глутатион-инсулин-трансгидрогеназы; по другим, инсулин-специфическая протеза принимает участие в разрушении как инсулина, так и глюкагона. Около 0,5 мг/сут глюкагона, секретируемого a-клетками, выделяется с желчью.
Длительное время считалось, что, помимо островков поджелудочной железы, глюкагон образуется эндокринными клетками желудочно-кишечного тракта и он был идентифицирован как глюкагоноподобная иммунореактивность, имеющая различную молекулярную массу и свойства. Глюкагоноподобная иммунореактивность обладает некоторыми липолитическими и гликогенолитическими свойствами, стимулирует высвобождение инсулина, связывается рецепторами инсулина. Идентифицированный из этого экстракта пептид был назван проглюкагоном или глицентином. Лишь в последние годы было четко показано, что проглюкагон в a-клетках поджелудочной железы и проглюкагон в эндокринных L-клетках кишечника происходят от одного гена и в обеих тканях осуществляется трансляция идентичной мРНК. Однако посттрансляционный процессинг в указанных тканях различен, в результате чего в a-клетках образуется глюкагон, а в эндокринных клетках кишечника глюкагоноподобный пептид-1 (GLP-1), который обладает совершенно противоположными свойствами. Он является анаболическим гормоном и стимулирует секрецию инсулина, способствуя поглощению глюкозы после приема пищи. Глюкагон, как указано выше, является катаболическим гормоном и важен в период голодания, осуществляя распад гликогена в печени, выход глюкозы в кровяное русло и поддержание ее уровня в пределах нормы. Глюкагоноподобный пептид-1 является, таким образом, инкретином и в содружестве с желудочным ингибиторным пептидом (ЖИП) стимулирует секрецию инсулина после приема пищи. Глюкагоноподобный пептид-1 при введении во время еды больным сахарным диабетом II типа восстанавливает у них первый и последующий пики секреции инсулина, что приводит к нормализации углеводного обмена.
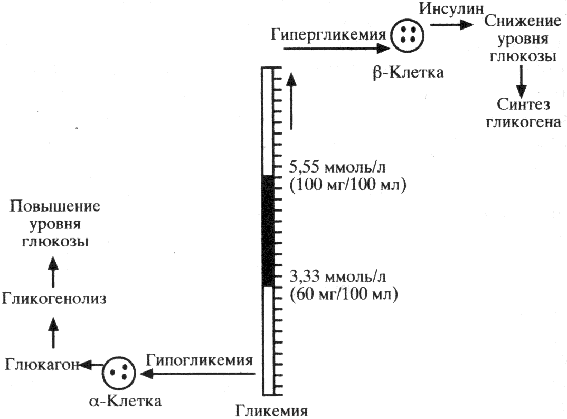
Как указывалось, глюкагон обладает гликогенолитическим и глюконеогеническим свойствами. В этой связи основная его роль в организме заключается в регулировании образования и выхода глюкозы из печени в целях поддержания гомеостаза глюкозы и крови для адекватного снабжения тканей ЦНС, которые используют ее в качестве энергетического материала со скоростью 4 г/ч. a-Клетки, так же как и b-клетки, чувствительны к минимальным изменениям уровня глюкозы в крови и во внеклеточном пространстве, в зависимости от чего соответственно изменяется скорость секреции инсулина или глюкагона. Эти взаимоотношения представлены на схеме 30.
Date: 2015-07-01; view: 716; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |