
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Схема 1. Конверсия АТФ в цАМФ
Собственно аденилатциклаза является гликопротеином с молекулярной массой около 150 000 кДа. Аденилатциклаза участвует с ионами Mg2+ в образовании цАМФ, концентрация которого в клетке составляет около 0,01-1 мкг•моль/л, тогда как содержание АТФ в клетке достигает уровня до 1 мкг•моль/л.
Образование цАМФ происходит с помощью аденилатциклазной системы, которая является одним из компонентов рецептора. Взаимодействие гормона с рецептором первой группы (рецепторы, имеющие 7 трансмембранных фрагментов) включает, по крайней мере, 3 следующих друг за другом этапа: 1) активирование рецептора, 2) передача гормонального сигнала и 3) клеточное действие.
Первый этап, или уровень, представляет собой взаимодействие гормона (лиганда) с рецептором, что осуществляется посредством ионных и водородных связей и гидрофобных соединений с вовлечением не менее 3 мембранных молекул Г-белка или регуляторного белка, состоящего из a-, b- и g-субъединиц. Это в свою очередь активирует мембраносвязанные ферменты (фосфолипазу С, аденилатциклазу) с последующим образованием 3 вторичных мессендежров: инозитол трифосфата, диацилглицерина и цАМФ.
Аденилатциклазная система рецептора состоит из 3 компонентов: собственно рецептора (стимуляторная и ингибиторная его части), регуляторного белка с его a-, b- и g-субъединицами и каталитической субъединицы (собственно аденилатциклазы), которые в обычном (т.е. нестимулированном) состоянии разобщены между собой (схема 2). Рецептор (обе его части – стимулирующая и ингибирующая) располагается на внешней, а регуляторная единица – на внутренней поверхности плазматической мембраны. Регуляторная единица, или Г-белок, в отсутствие гормона связана гуанозиндифосфатом (ГДФ). Комплексирование гормона с рецептором вызывает диссоциацию комплекса Г-белок – ГДФ и взаимодействие Г-белка, а именно его a-субъединицы с гуанозинтрифосфатом (ГТФ) и одновременное образование комплекса b/g-субъединицы, который способен вызывать определенные биологические эффекты. Комплекс ГТФ-a-субъединица, как уже отмечалось, активирует аденилатциклазу и последующее образование цАМФ. Последний активирует уже протеинкиназу А с соответствующим фосфорилированием различных белков, что проявляется также определенным биологическим действием. Кроме того, активированный комплекс ГТФ-a-субъединица в некоторых случаях регулирует стимуляцию фосфолипазы С, цГМФ, фосфодиэстеразы, Са2+- и К+-каналов и оказывает угнетающее влияние на Са2+-каналы и аденилатциклазу.
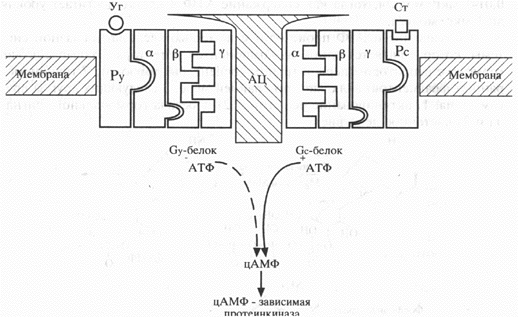
Схема 2. Механизм действия белковых гормонов путем активации цАМФ (объяснения в тексте).
Рс – рецептор, связывающий стимулирующий гормон,
Ст – стимулирующий гормон,
Ру – рецептор, связывающий угнетающий гормон,
Уг – угнетающий гормон,
Ац – аденилатциклаза,
Gy – гормонугнетающий белок,
Gc – гормонстимулирующий белок.
Роль гормона, таким образом, заключается в осуществлении замены комплекса Г-белок – ГДФ на комплекс Г-белок – ГТФ. Последний активирует каталитическую субъединицу, конвертируя ее в состояние, обладающее высокой аффинностью к комплексу АТФ-Mg2+, который быстро превращается в цАМФ. Одновременно с активацией аденилатциклазы и образованием цАМФ комплекс Г-белок – ГТФ вызывает диссоциацию гормонорецепторного комплекса путем снижения сродства рецептора к гормону.
Образовавшийся цАМФ активизирует в свою очередь цАМФ-зависимые протеинкиназы. Они представляют собой ферменты, осуществляющие фосфорилирование соответствующих белков, т.е. перенос фосфатной группы от АТФ к гидроксильной группе серина, треонина или тирозина, входящих в молекулу белка. Фосфорилированные таким образом белки непосредственно осуществляют биологический эффект гормона.
В настоящее время установлено, что регуляторные белки представлены более чем 50 различными белками, способными комплексироваться с ГТФ, которые подразделяются на Г-белки с небольшой молекулярной массой (20-25 кДа) и высокомолекулярные Г-белки, состоящие из 3 субъединиц (a – с мол. массой 39-46 кДа; b – 37 кДа и g-субъединица – 8 кДа). a-Субъединица является по сути ГТФазой, которая гидролизует ГТФ в ГДФ и свободный неорганический фосфат. b- и g-Субъединицы участвуют в образовании активного комплекса после взаимодействия лиганды с соответствующим рецептором. Высвобождая ГДФ в местах его связывания, a-субъединица вызывает диссоциацию и деактивацию активного комплекса, так как повторная ассоциация a-субъединицы – ГДФ с b- и g-субъединицами возвращает аденилатциклазную систему в исходное состояние. Установлено, что a-субъединица Г-белка в различных тканях представлена 8, b – 4 и g – 6 формами. Диссоциация субъединиц Г-белка в мембране клеток может приводить к одновременному образованию и взаимодействию различных сигналов, которые имеют на конце системы неодинаковые по силе и качеству биологические эффекты.
Собственно аденилатциклаза представляет собой гликопротеин с молекулярной массой 115 – 150 кДа. В различных тканях идентифицировано 6 ее изоформ, которые взаимодействуют с a-, b- и g-субъединицами, а также с Са2+ кальмодулином. В некоторых видах рецепторов помимо регуляторного стимулирующего (Гс) и регуляторного ингибирующего (Ги) белка идентифицирован дополнительный белок – трансдуцин.
Роль регуляторных белков в передаче гормонального сигнала велика, структуру этих белков сравнивают с “кассетой”, и многообразие ответа связано с высокой мобильностью регуляторного белка. Так, некоторые гормоны могут одновременно активировать в различной степени как Гс, так и Ги. Более того, взаимодействие некоторых гормонов с рецепторными регуляторными белками вызывает экспрессию соответствующих белков, регулирующих уровень и степень гормонального ответа. Активация, как показано выше, регуляторных белков является следствием их диссоциации от гормонально-рецепторного комплекса. В некоторых рецепторных системах в это взаимодействие вовлечено до 20 и более регуляторных белков, которые помимо стимуляции образования цАМФ активируют одновременно и кальциевые каналы.
Определенное количество рецепторов, которые относятся к первой группе, имеющих 7 трансмембранных фрагментов, опосредуют свое действие вторичными мессенджерами, относящимися к производным фосфатидилинозитола: инозитолтрифосфат и диацилглицерин. Инозитолтрифосфат контролирует клеточные процессы за счет генерации внутриклеточного кальция. Эта мессенджерная система может активироваться двумя путями, а именно через регуляторный белок или фосфотирозиновые белки. И в том, и в другом случае далее происходит активирование фосфолипазы С, которая гидролизует полифосфоинозидную систему. Эта система, как указано выше, включает два внутриклеточных вторичных мессенджера, которые образуются из мембранного полифосфоинозида, называемого фосфатидилинозитол-4, 5-бифосфатом (ФИФ2). Комплексирование гормона с рецептором вызывает гидролиз ФИФ2 фосфорилазой, в результате чего и образуются указанные мессенджеры – инозитол трифосфат (ИФ3) и диацилглицерин. ИФ3 способствует повышению уровня внутриклеточного кальция в первую очередь за счет мобилизации последнего из эндоплазматической сети, где он локализутся в так называемых кальциосомах, а затем за счет поступления в клетку внеклеточного кальция. Диацилглицерин в свою очередь активизирует специфические протеинкиназы и, в частности, протеинкиназу С. Последние фосфорилируют определенные ферменты, ответственные за конечный биологический эффект. Не исключено, что разрушение ФИФ2 наряду с выходом двух мессенджеров и увеличением содержания внутриклеточного кальция индуцирует и образование простагландинов, являющихся потенциальными стимуляторами цАМФ.
Посредством этой системы опосредуется действие таких гормонов, как гистамин, серотонин, простагландины, вазопрессин, холецистокинин, соматолиберин, тиролиберин, окситоцин, паратгормон, нейропептид Y, вещество Р, ангиотензин II, катехоламины, осуществляющие действие через a1-адренорецепторы, и др.
В группу фермента фосфолипазы С входят до 16 изоформ, которые в свою очередь подразделяются на b-, g- и d-фосфолипазу С. Показано, что b-фосфолипаза С взаимодействует с регуляторными белками, а g-фосфолипаза С – с тирозинкиназами.
Инозитолтрифосфат осуществляет действие через собственные специфические тетрамерные рецепторы, имеющие молекулярную массу 4х313 кДа. После комплексирования с таким рецептором выявлены так называемые “большие” инозитолтрифосфатные рецепторы или рианодиновые рецепторы, которые также относятся к тетрамерам и имеют молекулярную массу 4х565 кДа. Не исключено, что внутриклеточные кальциевые каналы рианодиновых рецепторов регулируются новым вторичным мессенджером – цАДФ-рибозой (L. Meszaros и соавт., 1993). Образование этого мессенджера опосредуется цГМФ и оксидом азота (NO), который активирует цитоплазматическую гуанилатциклазу. Таким образом, оксид азота может представлять собой один из элементов передачи гормонального действия с участием ионов кальция.
Как известно, кальций находится внутри клетки в связанном с белками состоянии и в свободной форме во внеклеточной жидкости. Идентифицированы такие внутриклеточные белки, связывающие кальций, как кальретикулин и кальсеквестрин. Внутриклеточный свободный кальций, который выполняет роль вторичного мессенджера, поступает из внеклеточной жидкости через кальциевые каналы плазматической мембраны клетки или высвобождается внутриклеточно из связи с белками. Внутриклеточный свободный кальций влияет на соответствующие киназы фосфорилаз лишь будучи связанным с внутриклеточным белком-кальмодулином (схема 3).
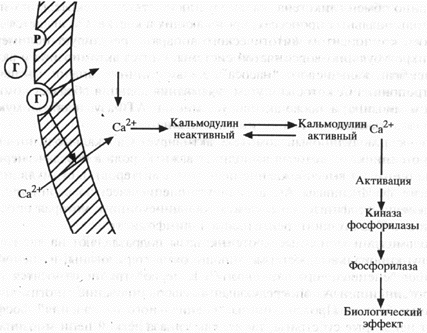
Схема 3. Механизм действия белковых гормонов через СА2+ (объяснения в тексте) Р – рецептор; Г – гормон; Са+белок – внутриклеточный кальций в связанной с белками форме.
Кальмодулин – рецепторный белок с высокой аффинностью к кальцию – состоит из 148 аминокислотных остатков и присутствует во всех содержащих ядро клетках. Его молекулярная масса (мол.м.) – 17000 кДа, каждая молекула имеет 4 рецептора для связывания кальция.
В состоянии функционального покоя концентрация свободного кальция во внеклеточной жидкости выше, чем внутри клетки, благодаря функционированию кальциевого насоса (АТФазы) и транспортировке кальция из клетки в межклеточную жидкость. В этот период кальмодулин находится в неактивной форме. Комплексирование гормона с рецептором приводит к повышению внутриклеточного уровня свободного кальция, который вступает в связь с кальмодулином, превращает его в активную форму и оказывает влияние на кальцийчувствительные белки или ферменты, ответственные за соответствующий биологический эффект гормона.
Повышенный уровень внутриклеточного кальция стимулирует затем кальциевый насос, который “перекачивает” свободный кальций в межклеточную жидкость, снижает его уровень в клетке, вследствие чего кальмодулин переходит в неактивную форму и в клетке восстанавливается состояние функционального покоя. Кальмодулин также воздействует на аденилатциклазу, гуанилатциклазу, фосфодиэстеразу, фосфорилазкиназу, миозинкиназу, фосфолипазу А2, Са2+- и Mg2+-АТФазу, стимулирует высвобождение нейротрансмиттеров, фосфорилирование белков мембран. Изменяя транспорт кальция, уровень и активность циклических нуклеотидов и опосредованно обмен гликогена, кальмодулин участвует в секреторных и других функциональных процессах, протекающих в клетке. Он является динамическим компонентом митотического аппарата, регулирует полимеризацию микротубулярно-ворсинчатой системы, синтез актомиозина и активацию мембран кальциевого “насоса”. Кальмодулин – аналог мышечного белка тропонина С, который путем связывания кальция образует комплекс актина и миозина, а также активирует миозин-АТФазу, необходимую для повторного взаимодействия актина и миозина.
Са2+-кальмодулиновый комплекс активирует Са2+-кальмодулинзависимую протеинкиназу, которая выполняет важную роль в передаче нервного сигнала (синтез и высвобождение нейротрансмиттеров), в стимуляции или угнетении фосфолипазы А2, активирует специфическую серин-треонинпротеиновую фосфатазу, называемую кальцинеурином, которая опосредует действие Т-клеточного рецептора в Т-лимфоцитах.
Кальмодулинзависимые протеинкиназы подразделяют на две группы: многофункциональные, которые хорошо охарактеризованы, и специфические, или “специального назначения”. К первой группе относятся такие, как протеинкиназа А, опосредующая фосфорилирование многих внутриклеточных белков. Протеинкиназы “специального назначения” фосфорилируют некоторые субстраты, такие, как киназа легкой цепи миозина, фосфорилазкиназа и др.
Протеинкиназа С представлена несколькими изоформами (мол.м. от 67 до 83 кДа), которые кодируются 10 различными генами. Классическая протеинкиназа С включает 4 различных изоформы (a-, b1-, b2- и g-изоформы); 4 других белковых изоформы (дельта,- эпсилон,- пи и oмега) и 2 атипичных белковых формы.
Классические протеинкиназы активируются кальцием и диацилглицерином, новые белковые протеинкиназы – диацилглицерином и форболовыми эфирами, а одна из атипичных протеинкиназ не отвечает ни на один из перечисленных активаторов, но для ее активности требуется наличие фосфатидилсерина.
Выше отмечалось, что гормоны, рецепторы которых имеют 7 трансмембранных фрагментов, после образования гормоно-рецепторного комплекса связываются с G-белками, имеющими небольшой молекулярный вес (20-25 кДа) и выполняющими различную функцию. Белки, взаимодействующие с рецепторной тирозинкиназой, называются ras-белками, а белки, участвующие в транспорте пузырька – rab-белками. Активированная форма представляет собой G-белок, комплексированный с ГТФ; неактивная форма ras-белка является следствием его комплексирования с ГДФ. В активировании ras-белка участвует гуаниннуклеотидный высвобождающий белок, а процесс инактивации осуществляется гидролизом ГТФ под влиянием ГТФазы. Активирование ras-белка в свою очередь посредством фосфолипазы С стимулирует образование вторичных мессенджеров: инозитолтрифосфата и диацилглицерина. Ras-белки впервые были описаны как онкогены (A.G. Gilman, 1987), так как повышенная экспрессия, или мутация, этих белков выявлена при злокачественных новообразованиях. В норме ras-белки вовлечены в различные регуляторные процессы, включая рост.
Некоторые белковые гормоны (инсулин, ИФР I и др.) свое первоначальное действие по активированию рецептора осуществляют через гормонально-чувствительную тирозинкиназу. Связывание гормона с рецептором ведет к конформационным изменениям или димеризации, которые вызывают активирование тирозинкиназы и последующее аутофосфорилирование рецептора. После гормональнорецепторного взаимодействия аутофосфорилирование усиливает как активность тирозинкиназы в другом димере, так и фосфорилирование внутриклеточных субстратов. Рецепторная тирозинкиназа является аллостерическим ферментом, в котором внеклеточный домен является регуляторной субъединицей, а внутриклеточный (цитоплазматический) домен – каталитической субъединицей. Активирование или фосфорилирование тирозинкиназы осуществляется через связывание с адапторным или SH2 белком, состоящим из двух SH2 доменов и одного SH3 домена. SH2 домены связывают специфические фосфотирозины рецепторной тирозиновой киназы, а SH3 связывают ферменты или сигнальные молекулы. Фосфорилированные белки (фосфотирозины) укорачиваются на 4 аминокислоты, что и обусловливает их специфическое высокоаффинное связывание с SH2 доменами.
Комплексы (фосфотирозиновые пептиды – SH2 домены) определяют селективность передачи гормонального сигнала. Конечный эффект передачи гормонального сигнала зависит от двух реакций – фосфорилирования и дефосфорилирования. Первая реакция находится под контролем различных тирозинкиназ, вторая – фосфотирозиновых фосфатаз. К настоящему времени идентифицировано более 10 трансмембранных фосфотирозиновых фосфатаз, которые подразделяются на 2 группы: а) большие трансмембранные белки/тендемные домены и б) небольшие внутриклеточные ферменты с одним каталитическим доменом.
Внутриклеточные фрагменты фосфотирозиновых фосфатаз отличаются большим разнообразием. Считается, что функция SH2 доменовых фосфотирозиновых фосфатаз (I и II типа) заключается в уменьшении сигнала посредством дефосфорилирования фосфорилирующих участков на рецепторной тирозинкиназе или усилении сигнала через связывание тирозинфосфорилирующих сигнальных белков на одном или обоих доменах SH2, а также передаче сигнала посредством взаимодействия одного белка SH2 с другим его белком или инактивирование процессом дефосфорилирования тирозинфосфорилированных вторичных мессенджерных молекул, таких, как фосфолипаза С-g или src-тирозинкиназа.
У некоторых гормонов передача гормонального сигнала осуществляется путем фосфорилирования остатков аминокислоты тирозина, а также серина или треонина. Характерным в этом плане является рецептор к инсулину, в котором может происходить фосфорилирование как тирозина, так и серина, причем фосфорилирование серина сопровождается снижением биологического эффекта инсулина. Функциональная значимость одновременного фосфорилирования нескольких аминокислотных остатков рецепторной тирозинкиназы не совсем понятна. Однако этим достигается модулирование гормонального сигнала, который схематически относят ко второму уровню рецепторных сигнальных механизмов. Этот уровень характеризуется активированием нескольких белковых киназ и фосфатаз (таких, как протеинкиназа С, цАМФ-зависимая протеинкиназа, цГМФ-зависимая протеинкиназа, кальмодулинзависимая протеинкиназа и др.), осуществляющих фосфорилирование или дефосфорилирование сериновых, тирозиновых или треониновых остатков, что вызывает соответствующие конформационные изменения, необходимые для проявления биологической активности.
Следует отметить, что такие ферменты, как фосфорилаза, киназа, казеиновая киназа II, ацетил-СоА карбоксилазная киназа, триглицеридная липаза, гликогенфосфорилаза, белковая фосфатаза I, АТФ цитратлиаза активируются путем процесса фосфорилирования, а гликогенсинтаза, пируватдегидрогеназа и пируваткиназа активируются процессом дефосфорилирования.
Третий уровень регуляторных сигнальных механизмов в действии гормонов характеризуется соответствующим ответом на клеточном уровне и проявляется изменением метаболизма, биосинтеза, секреции, роста или дифференцировки. Это включает процессы транспорта различных веществ через клеточную мембрану, синтез белков, стимуляцию рибосомальной трансляции, активирование микроворсинчатой тубулярной системы и транслокацию секреторных гранул к мембране клетки. Так, активирование транспорта аминокислот, глюкозы через клеточную мембрану осуществляется соответствующими белками-транспортерами через 5-15 минут после начала действия таких гормонов, как СТГ и инсулин. Различают 5 белков-транспортеров для аминокислот и 7 – для глюкозы, из которых 2 относятся к натрийглюкозным симпортерам или котранспортерам.
Вторичные мессенджеры гормонов влияют на экспрессию генов, модифицируя процессы транскрипции. Так, цАМФ регулирует скорость транскрипции ряда генов, ответственных за синтез гормонов. Это действие опосредуется цАМФ-ответным элементом активирующего белка (CREB). Последний белок (CREB) комплексируется со специфическими участками ДНК, являясь общим транскрипционным фактором.
Многие гормоны, взаимодействующие с рецепторами, расположенными на плазматической мембране, после образования гормоно-рецепторного комплекса подвергаются процессу интернализации, или эндоцитозу, т.е. транслокации, или переносу гормоно-рецепторного комплекса внутрь клетки. Этот процесс происходит в структурах, называемых “покрытые ямки”, расположенных на внутренней поверхности клеточной мембраны, выстланной белком клатрином. Агрегированные таким образом гормоно-рецепторные комплексы, которые локализуются в “покрытых ямках”, затем интернализируются путем инвагинации мембраны клетки (механизм очень напоминает процесс фагоцитоза), превращаясь в пузырьки (эндосомы или рецептосомы), а последние транслоцируются внутрь клетки.
Во время транслокации эндосома подвергается процессу ацидофикации (подобно тому, что происходит в лизосомах), результатом чего может быть деградация лиганды (гормона) или диссоциация гормоно-рецепторного комплекса. В последнем случае высвободившийся рецептор возвращается на клеточную мембрану, где он повторно взаимодействует с гормоном. Процесс погружения рецептора вместе с гормоном внутрь клетки и возврат рецептора на мембрану клетки называется процессом рециклирования рецептора. В период функционирования рецептора (период полураспада рецептора составляет от нескольких до 24 часов и более) он успевает осуществить от 50 до 150 таких “челночных” циклов. Процесс эндоцитоза является составной или дополнительной частью рецепторного сигнального механизма в действии гормонов.
Помимо этого, с помощью процесса интернализации осуществляется деградация белковых гормонов (в лизосомах) и клеточная десенситизация (снижение клеточной чувствительности к гормону) путем уменьшения количества рецепторов на клеточной мембране. Установлено, что судьба гормоно-рецепторного комплекса после процесса эндоцитоза различна. У большинства гормонов (ФСГ, ЛГ, хорионический гонадотропин, инсулин, ИФР 1 и 2, глюкагон, соматостатин, эритропоэтин, ВИП, липопротеиды низкой плотности) эндосомы внутри клетки подвергаются диссоциации. Освободившийся рецептор возвращается на мембрану клетки, а гормон подвергается процессу деградации в лизосомальном аппарате клетки.
У других гормонов (СТГ, интерлейкин-2, эпидермальный, нервный и тромбоцитарный факторы роста) после диссоциации эндосом рецептор и соответствующий гормон подвергаются процессу деградации в лизосомах.
Некоторые гормоны (трансферин, маннозо-6-фосфат, содержащие белки, и незначительная часть инсулина, СТГ в некоторых тканях-мишенях) после диссоциации эндосом возвращаются, как и их рецепторы, на клеточную мембрану. Несмотря на то, что у перечисленных гормонов имеет место процесс интернализации, нет единого мнения о непосредственном внутриклеточном действии белкового гормона или его гормоно-рецепторного комплекса.
Рецепторы к гормонам коры надпочечников, половым гормонам, кальцитриолу, ретиноивой кислоте, тироидным гормонам локализованы внутриклеточно. Перечисленные гормоны липофильны, транспортируются белками крови, имеют длительный период полураспада и их действие опосредуется гормоно-рецепторным комплексом, который, связываясь со специфическими областями ДНК, активирует или инактивирует специфические гены.
Связывание гормона с рецептором приводит к изменениям физико-химических свойств последнего, и этот процесс называется активацией или трансформацией рецептора. Изучение трансформации рецепторов in vitro показало, что температурный режим, наличие гепарина, АТФ и других компонентов в инкубационной среде изменяют скорость этого процесса.
Нетрансформированные рецепторы являются белком с молекулярной массой 90 кДа, который идентичен стрессовому или белку температурного шока с той же молекулярной массой (M. Catell и соавт., 1985). Последний белок встречается в a- и b-изоформах, которые кодируются различными генами. Аналогичная ситуация наблюдается и в отношении стероидных гормонов.
Помимо стрессового белка с мол. м. 90 кДа, в нетрансформированном рецепторе выявлен белок с мол. м. 59 кДа (M. Lebean и соавт., 1992), названный иммунофилином, который непосредственно не связан с рецептором стероидных гормонов, но образует комплексы с белком мол. м. 90 кДа. Функция белка иммунофилина недостаточно ясна, хотя его роль в регуляции функции рецептора стероидных гормонов доказана, так как он связывает иммуносупрессивные вещества (например, рапамицин и FK 506).
Стероидные гормоны транспортируются в крови в связанном с белками состоянии и лишь незначительная их часть находится в свободной форме. Гормон, находящийся в свободной форме, способен взаимодействовать с мембраной клетки и проходить через нее в цитоплазму, где связывается с цитоплазматическим рецептором, который отличается высокой специфичностью. Например, из гепатоцитов выделены рецепторные белки, связывающие только глюкокортикоидные гормоны или эстрогены. В настоящее время идентифицированы рецепторы к эстрадиолу, андрогенам, прогестерону, глюкокортикоидам, минералокортикоидам, витамину Д, тироидным гормонам, а также к ретиноивой кислоте и некоторым другим соединениям (эдиксоновый рецептор, диоксиновый рецептор, пероксисомный пролиферативный активаторный рецептор и дополнительный рецептор Х к ретиноивой кислоте). Концентрация рецепторов в соответствующих тканях-мишенях составляет 103 до 5•104 на клетку.
Рецепторы стероидных гормонов имеют 4 домена: аминотерминальный домен, имеющий значительные различия у рецепторов к перечисленным гормонам и состоящий из 100-600 аминокислотных остатков; ДНК-связывающий домен, состоящий примерно из 70 аминокислотных остатков; гормоносвязывающий домен, включающий около 250 аминокислот, и карбоксилтерминальный домен. Как отмечено, аминотерминальный домен имеет наибольшие различия как по форме, так и по аминокислотной последовательности. Он состоит из 100-600 аминокислот и наименьшие его размеры выявлены в рецепторе тироидных гормонов, а наибольшие – в рецепторе глюкокортикоидных гормонов. Этот домен определяет особенности рецепторного ответа и у большинства видов он характеризуется высокой степенью фосфорилирования, хотя нет прямой корреляции между степенью фосфорилирования и биологическим ответом.
ДНК-связывающий домен характеризуется 3 интронами, два из которых имеют так называемые “цинковые пальцы”, или структуры с содержанием ионов цинка с 4 цистеиновыми мостиками.”Цинковые пальцы” участвуют в специфическом связывании гормона с ДНК. На ДНК-связывающем домене имеется небольшая область для специфического связывания ядерных рецепторов и называемая “гормоноотвечающие элементы”, которая модулирует начало транскрипции. Эта область локализуется внутри другого фрагмента, состоящего из 250 нуклеотидов, ответственного за инициацию транскрипции. ДНК-связывающий домен обладает наибольшим постоянством структуры среди всех внутриклеточных рецепторов.
Гормоносвязывающий домен участвует в связывании гормона, а также в процессах димеризации и регуляции функции других доменов. Он непосредственно примыкает к ДНК-связывающему домену.
Карбоксилтерминальный домен также участвует в процессах гетеродимеризации, взаимодействует с различными транскриптационными факторами, включая проксимальные промоторы белков.
Наряду с этим имеются данные, что стероиды вначале связываются специфическими белками мембраны клетки, которые транспортируют их к цитоплазматическому рецептору или, минуя его, непосредственно к рецепторам ядра. Цитоплазматический рецептор состоит из двух субъединиц. В ядре клетки субъединица А, взаимодействуя с ДНК, триггирует (запускает) процесс транскрипции, а субъединица B связывается с негистоновыми белками. Эффект действия стероидных гормонов проявляется не сразу, а спустя определенное время, которое необходимо для образования РНК и последующего синтеза специфического белка.
Тироидные гормоны (тироксин-Т4 и трийодтиронин-Т3), как и стероидные, легко диффундируют через липидную клеточную мембрану и связываются внутриклеточными белками. По другим данным, тироидные гормоны взаимодействуют сначала с рецептором на плазматической мембране, где комплексируются с белками, образуя так называемый внутриклеточный пул тироидных гормонов. Биологическое действие в основном осуществляется Т3, в то время как Т4 дейодируется, превращаясь в Т3, который связывается с цитоплазматическим рецептором. Если стероидцитоплазматический комплекс транслоцируется в ядро клетки, то тироидцитоплазматический комплекс сначала диссоциирует и Т3 непосредственно связывается рецепторами ядра, обладающими к нему высокой аффинностью. Кроме того, высокоаффинные рецепторы к Т3 обнаруживаются и в митохондриях. Считается, что калоригенное действие тироидных гормонов осуществляется в митохондриях посредством генерации новой АТФ, для образования которой используется аденозиндифосфат (АДФ).
Тироидные гормоны регулируют синтез белка на уровне транскрипции и это их действие, обнаруживаемое через 12-24 часа, может быть блокировано введением ингибиторов синтеза РНК. Помимо внутриклеточного действия, тироидные гормоны стимулируют транспорт глюкозы и аминокислот через клеточную мембрану, непосредственно влияя на активность некоторых локализованных в ней ферментов.
Таким образом, специфическое действие гормона проявляется лишь после его комплексирования с соответствующим рецептором. В результате процессов по распознаванию, комплексированию и активированию рецептора последний генерирует ряд вторичных мессенджеров, которые вызывают последовательную цепь пострецепторных взаимодействий, заканчивающихся проявлением специфического биологического эффекта гормона.
Отсюда следует, что биологическое действие гормона зависит не только от его содержания в крови, но и от количества и функционального состояния рецепторов, а также от уровня функционирования пострецепторного механизма.
Количество клеточных рецепторов, как и других компонентов клетки, постоянно изменяется, отражая процессы их синтеза и деградации. Основная роль в регуляции количества рецепторов принадлежит гормонам. Имеется обратная зависимость между уровнем гормонов в межклеточной жидкости и количеством рецепторов. Так, например, концентрация гормона в крови и межклеточной жидкости очень низкая и составляет 1014-109 М, что значительно ниже, чем концентрация аминокислот и других различных пептидов (105-103 М). Количество рецепторов выше и составляет 1010-108 М, причем на плазматической мембране их около 1014-1010 М, а внутриклеточный уровень вторичных мессенджеров несколько выше – 108-106 М. Абсолютное количество рецепторных мест на мембране клетки составляет от нескольких сотен до 100 000.
Многочисленные исследования показали, что рецепторы обладают характерным свойством усиливать действие гормона не только описанными механизмами, но и посредством так называемого “нелинейного связывания”. Характерна еще одна особенность, которая заключается в том, что наибольший гормональный эффект не означает наибольшего связывания гормона рецепторами. Так, например, максимальная стимуляция инсулином транспорта глюкозы в адипоциты наблюдается при связывании гормоном лишь 2% инсулиновых рецепторов (J. Gliemann и соавт., 1975). Такие же взаимоотношения установлены для АКТГ, гонадотропинов и других гормонов (M.L. Dufau и соавт., 1988). Это объясняется двумя феноменами: ”нелинейным связыванием” и наличием так называемых “резервных рецепторов”. Так или иначе, но амплификация, или усиление действия гормона, являющееся следствием этих двух феноменов, выполняет важную физиологическую роль в процессах биологического действия гормона в норме и при различных патологических состояниях. Так, например, при гиперинсулинизме и ожирении на 50-60% снижается количество инсулиновых рецепторов, локализованных на гепатоцитах, адипоцитах, тимоцитах, моноцитах, и, наоборот, инсулиндефицитные состояния у животных сопровождаются увеличением количества рецепторов к инсулину. Наряду с количеством рецепторов к инсулину изменяется и их аффинность, т.е. способность комплексироваться с инсулином, а также изменяется трансдукция (передача) гормонального сигнала внутри рецептора. Таким образом, изменение чувствительности органов и тканей к гормонам осуществляется посредством механизмов обратной связи (down regulation). Для состояний, сопровождающихся высокой концентрацией гормона в крови, характерно уменьшение количества рецепторов, что клинически проявляется в виде резистентности к данному гормону.
Некоторые гормоны могут влиять на количество не только “собственных” рецепторов, но и рецепторов к другому гормону. Так, прогестерон уменьшает, а эстрогены увеличивают количество рецепторов одновременно и к эстрогенам, и к прогестерону.
Снижение чувствительности к гормону может быть обусловлено следующими механизмами: 1) уменьшением аффинности рецептора вследствие влияния других гормонов и гормонорецепторных комплексов; 2) снижением количества функционирующих рецепторов в результате их интернализации или высвобождения из мембраны во внеклеточное пространство; 3) инактивацией рецептора вследствие конформационных изменений; 4) разрушением рецепторов путем повышения активности протеаз или деградацией гормоно-рецепторного комплекса под влиянием ферментов лизосом; 5) угнетением синтеза новых рецепторов.
Для каждого вида гормонов имеются агонисты и антагонисты. Последние представляют собой вещества, которые способны конкурентно связывать рецептор к гормону, снижая или полностью блокируя его биологический эффект. Агонисты, наоборот, комплексируясь с соответствующим рецептором, усиливают действие гормона или полностью имитируют его присутствие, причем иногда период полураспада агониста в сотни и более раз превышает время деградации естественного гормона, а, следовательно, в течение этого времени проявляется биологический эффект, что естественно используется в клинических целях. Так, например, агонистами глюкокортикоидов являются дексаметазон, кортикостерон, альдостерон, а частичными агонистами – 11b-гидроксипрогестерон, 17a-гидроксипрогестерон, прогестерон, 21-деоксикортизол, а их антагонистами – тестостерон, 19-нортестостерон, 17-эстрадиол. К неактивным стероидам в отношении рецепторов к глюкокортикоидам относятся 11a-гидроксипрогестерон, тетрагидрокортизол, андростендион, 11a-, 17a-метилтестостерон. Эти взаимоотношения учитывают не только в эксперименте при уточнении действия гормонов, но и в клинической практике.
Date: 2015-07-01; view: 911; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |