
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Гіппократ 4 page
Розрахунок. Наприклад, на титрування 50 мл фільтрату використано 6 мл розчину амонію роданіду. Тоді на титрування фільтрату, який містить всю кількість взятої на аналіз сечі, потрібно було б 12 мл. Оскільки 1 мл амонію роданіду відповідає 1 мл титрованого розчину срібла нітрату, то із 20 мл доданого до сечі розчину срібла тільки 12 мл вступили в реакцію з амонієм роданідом, а інші 8 мл розчину срібла витрачено на зв’язування натрію хлориду. Таким чином, уміст натрію хлориду буде становити:
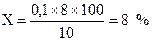 .
.
на відміну від сечі коней, сечу собак обробляють дещо по-іншому. Підкислені 20 мл сечі розводять 60 мл дистильованої води і додають 5–8 г вільного від хлору цинкового пилу, 1,5 мл розведеної сірчаної кислоти (1:5), після чого нагрівають протягом 60 хв на водяній бані. Гарячу рідину фільтрують з повторним промиванням киплячою водою і, підкисливши фільтрат соляною кислотою, визначають у сечі вміст натрію хлориду.
2.8.2. Визначення хлоридів у сечі
наборами реактивів
принцип методу. В основі методу лежать наступні реакції: хлоридний іон витісняє роданідний аніон ртуті. Роданідні іони, які вивільнюються, утворюють з іонами заліза кольоровий комплекс, що максимально поглинає світло при довжині хвилі 480–510 нм, інтенсивність забарвлення якого прямо пропорційна концентрації хлоридних іонів у пробі.
обладнання. Фотоелектроколориметр (кфк-2, КФК-3) або спектрофотометр; пробірки; піпетки на 0,1 і 5 мл.
Реактиви: 1) реагент № 1 – 1 флакон; 2) реагент № 2 – 50 мл; 3) 0,1 М (100 ммоль/л) розчин NaCl – 1 мл.
Використовують набір фірми “Simko-Ltd” *.
Приготування робочого розчину хлориду-реагенту. Вміст флакону з реагентом № 1 розчиняють при інтенсивному перемішуванні у 80 мл гарячої дистильованої води (70–90 °С). Одержаний розчин охолоджують до кімнатної температури і до нього додають реагент № 2 (50 мл), перемішують. За необхідності – профільтрувати. Після цього довести дис-тильованою водою до кінцевого об’єму 150 мл. Реактив зберігають при кімнатній температурі (18–25 °С) у посуді з темного скла. Реактив повинен бути блідо-жовтого забарвлення, прозорий. За наявності незначного осаду реактив фільтрують. Реактив не придатний для використання, якщо він мутніє або змінюється його забарвлення на червоно-коричневе.
Хід визначення. Визначення хлоридів у сечі проводять за схемою (табл. 3).
Таблиця 3 – Схема визначення хлоридів у сечі
| Додати, мл | Проба | Стандарт | Контроль |
| Хлорид-реагент | 3,0 | 3,0 | 3,0 |
| Сеча | 0,02 | – | – |
| 0,1 М розчин NaCl | – | 0,02 | – |
| Дистильована вода | – | – | 0,02 |
| Перемішати і через 5 хв визначити оптичну щільність проб і стандарту проти контролю при довжині хвилі 480–510 нм у кюветі на 1 см. |
примітки: 1. Використовують тільки „негемолізовану” сечу.
2. Реакція в діапазоні 80–120 ммоль/л.
3. проби сечі з концентрацією вище 120 ммоль/л розводять дистильованою водою у 2 рази і знову проводять визначення. Результат множать на 2.
4*. приготування реактивів приведено в: Young D.S., Pestaner L.C., Gibberman V. Clinical Chematologi. – 1975. – V. 21. – P. 277.
Кількість хлоридів у сечі розраховують за формулою:
Хлориди (ммоль/л) 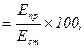
де Епр – екстинція проби; Ест – екстинція стандарту; 100 – концентрація NaCl у стандартному розчині (ммоль/л).
Діагностичне значення визначення
хлоридів
У нормі, за Френером, за добу виділяється із сечею натрію хлориду: в коней – 25–35 г, собак – 0,25–5 г, в інших домашніх тварин – 0,6–0,9 %. Із організму велика кількість хлоридів виділяється з сечею у вигляді натрію хлориду. Виділена кількість цієї речовини залежить від різних причин:вмісту її в кормах, воді, видільної здатності нирок, різних захворювань, які супроводжуються лихоманкою, розвитком запальних набряків і накопиченням у порожнинах ексудатів. Кількісне визначення хлоридів у сечі має велике значення при отруєннях тварин кухонною сіллю.
2.8.3. Визначення кальцію в сечі
принцип методу. Іони кальцію в лужному середовищі реагують з
о-крезолфталеїн комплексоном з утворенням кольорового комплексу. Інтенсивність фіолетового кольору комплексу пропорційна концентрації кальцію в дослідній пробі.
обладнання: фотоелектроколориметр (кфк-2, КФК-3) або спектрофотометр; пробірки; піпетки на 0,1 і 5 мл.
Реактиви: 1) хромоген (о-крезолфталеїн комплексон – 0,12±0,01 ммоль/л; 8-оксіхінолін – 16,0±0,16 ммоль/л; соляна кислота – 60,0±6,00 ммоль/л) – 1 флакон (120,0±4,0) мл; 2) буфер (моноетаноламін – 0,8±0,08 моль/л) – 1 флакон (120,0±4,0) мл; 3) калібрувальний розчин кальцію (2,5 ± 0,05 ммоль/л) – 1 флакон (5,0 ± 0,5) мл.
Використовують набір реактивів ТОВ НВП “Філісіт-Діагностика”.
Хід визначення. Визначення кальцію в сечі проводиться за схемою (табл. 4).
Таблиця 4 – Схема визначення кальцію в сечі
| Реактиви | Дослідна проба | Контроль | Стандартна проба |
| Хромоген | 2,5 | 2,5 | 2,5 |
| Сеча | 0,05 | – | – |
| Стандартний розчин | – | – | 0,05 |
| Буфер | 2,5 | 2,5 | 2,5 |
| Перемішують, витримують 10 хв при кімнатній температурі. Визначають оптичну щільність (не пізніше 30 хв) дослідної і стандартної проб проти контролю при довжині хвилі 550–590 нм у кюветі товщиною робочого шару 0,5 або 1 см. |
Примітки: 1. Об’єми досліджуваних зразків та реагентів можна пропорційно змен-шувати або збільшувати.
2. якщо концентрація кальцію у сечі перевищує 4 ммоль/л, її розводять дистильо- ваною водою у співвідношенні 1:1, а отриманий результат множать на 2.
3. Кювети і посуд, що використовується при аналізі, повинен бути чистим, спеціаль-но підготовленим (поміщають на кілька годин у соляну кислоту, після чого ретельно промивають і сушать).
Уміст кальцію в сечі визначають за формулою:
Кальцій (ммоль/л) 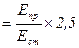 ,
,
де Епр – екстинція дослідної проби; Ест – екстинція стандартної проби; 2,5 – коефіцієнт перерахунку в ммоль/л.
для розрахунку концентрації кальцію у добовій сечі отримане вище значення (ммоль/л) множать на об’єм добової сечі, виражений у літрах, і отримують кількість кальцію (ммоль/добу).
Діагностичне значення визначення
кальцію в сечі
збільшується кількість кальцію в сечі при нирковій гіперкальциурії, уролітіазі, спадкових аномаліях нирок, надлишку кальцію та оксалатів у раціоні, гіперкальціємічних остеопатіях, гіперпаратиреоідизмі.
2.9. Визначення ферментів у сечі
Ферментурія – підвищена екскреція з сечею ферментів. У кінцевій сечі міститься до 40 різних ферментів. У фізіологічних умовах із плазми в сечу через клубочковий фільтр екскретуються лише ті ферменти, молекулярна маса яких не перевищує 70 кілодальтон (лізоцим, урокіназа, амілаза, ліпаза), а ферменти з вищою молекулярною масою, наприклад аланінамінопептидаза (ААП), ЛДГ, виявляються в сечі тільки за підвищеної проникності базальної мембрани капілярів клубочків. При незміненій канальцевій реабсорбції такі низькомолекулярні ферменти, як лізоцим і урокіназа повністю реабсорбуються, тому їхня екскреція з сечею є одним із критеріїв тубулярних уражень.
Основне джерело ферментів у сечі – клітини канальцевого епітелію, які під час злущення потрапляють у просвіт канальців, де руйнуються і виділяють ферменти, що містяться в них. Частина ферментів реабсорбуєть-ся, частина руйнується, інші екскретуються з сечею. Тому ступінь фермен-турії може бути зумовлена як ураженням клубочкового фільтру (надход-ження ферментів з крові), так і пошкодженням канальцевого епітелію (дистрофія, некробіоз). На активність ферментів впливають також довготривалість зберігання, величина рН сечі, температура та ін. При бактеріурії слід враховувати можливість потрапляння в сечу мікробних ферментів. Фер-ментативна активність клітин епітелію сечових шляхів є незначною.
Констатація певного виду ферментурії є надзвичайно важливим діагностичним тестом для уточнення характеру і місця ураження нирок, визначення прогнозу захворювання. Слід відмітити, що на відміну від ферментів сечі активність ферментів у крові при захворюваннях нирок практично не змінюється і не є інформативним тестом їх ураження.
Ферментурія слабо корелює з протеїнурією, тому порушення процесу гломерулярної фільтрації не є основною причиною гіперфементурії.
Залежно від глибини ураження в сечу виділяються ферменти, що мають різну внутрішньоклітинну локалізацію. При незначному ураженні клітини зростає активність ензимів, пов’язаних із щітковою каймою (нейтральна α-глюкозидаза, гамма-глутамілтранспептидаза, лужна фосфатаза). При значному пошкодженні зростає активність цитоплазматичних (ЛДГ, малатдегідрогеназа) та лізосомальних (N-ацетил-β-D-глюкозамінідаза, арилсульфатаза, β-глюкуронідаза, холінестераза) ферментів. Значне зростання активності мітохондріальних ензимів відповідає некрозу клітин при морфологічному дослідженні ниркової тканини.
Гамма-глутамілтранспептидаза (ГГТП), або гамма-глутамілтранс-фераза (ГГТ) міститься майже у всіх органах, найбільша активність відмічається в тканині нирок, де фермент розташований переважно в клітинах проксимальних звивистих канальців та в нисхідній частині петлі Генле. Незважаючи на високу активність ензиму в нирках, визначення активності ГГТП у сироватці крові проводять переважно для діагностики захворювань печінки та жовчного міхура. Активність ГГТ в сечі корелює з активністю патологічного процесу в нирках, оскільки цей фермент локалізується в щіткоподібній каймі лише в 67 % випадків, а в інших – пов’язаний з мембраною ендоплазматичного ретикулума.
Лужна фосфатаза (ЛФ) широко розповсюджена у тканинах людини і тварини. Фермент розташований на клітинній мембрані, де бере участь у транспорті фосфату в клітину. Розрізняють 5 тканинно-специфічних ізоферментів лужної фосфатази: плацентарний, кістковий, печінковий, кишковий і нирковий. У нирці ЛФ розміщена в кірковому шарі і досить міцно зафіксована на матриксі мембран щіткоподібної кайми нефротелію. Визначення ЛФ у сечі використовують як тест на пошкодження цитомембран, в першу чергу, кіркових структур нирки.
Найчутливішим тестом є визначення в сечі ізоензимів (4-та і 5-та фракції) лактатдегідрогенази (ЛДГ), яка міститься в цитоплазмі клітин. У нирковій тканині активність ЛДГ практично рівномірно розподіляється між кірковим та мозковим шаром нирок. Як правило, активність ЛДГ у сироватці крові при гострих та хронічних захворюваннях нирок не виходить за межі норми, а зростання активності ферменту в сечі констатовано практично при всіх відомих ураженнях нирок: гострий та хроніч-ний гломерулонефрит, гострий та хронічний пієлонефрит, сечокам’яна хвороба, медикаментозне ураження нирок, діабетична нефропатія, рак сечового міхура, карцинома нирки. Встановлено, що визначення ізоензимів ЛДГ і підрахунок клітинних елементів в сечі є важливими маркерами ураження нирок у доповненні до визначення білка в сечі, який є, в основному, показником клубочкових пошкоджень.
2.9.1. Визначення активності
гамма-глутамілтранспептидази в сечі
Принцип методу. Гамма-глутамілтранспептидаза (ГГТП) каталізує реакцію переносу L-γ-глутамінового залишку із хромогенного субстрату на гліцилгліцин. При цьому звільняється п-нітроанілін, оптичну густину якого вимірюють фотометрично. Активність ферменту визначають кінетичним або методом постійного часу.
Обладнання: фотоелектроколориметр (кфк-2, КФК-3) або спектрофотометр; водяна баня; пробірки; піпетки на 0,1 і 10 мл.
Реактиви: 1) субстрат L-γ-глутаміл-п-нітроаніліду – 200 мг; 2) буферна суміш (гліцилгліцин – 1,26 г, ТРІС – 1,21 г) – 2,47 г; 3) стандартний розчин
п-нітроаніліну (5 ммоль/л) – 3,0 мл; 4) 10 %-ний розчин оцтової кислоти.
Використовують набір реактивів НВП “Реагент” (м. Дніпропетровськ).
Приготування робочих розчинів.
1. Буферний розчин, рН 8,1. Вміст флакону 2 розчиняють у 70–80 мл дистильованої води у мірній колбі на 100 мл і доливають водою до мітки. Розчин стабільний при зберіганні в холодильнику.
2. Субстратно-буферний розчин. Із флакону 1 відбирають 40 мг субстрату і розчиняють у 18 мл дистильованої води на киплячій водяній бані, додають 17 мл буферного розчину. Розчин стабільний при 15–25 °С протягом 10 годин.
Похибка методу становить ± 7 %.
Хід визначення. У пробірку вносять 0,5 мл субстратно-буферного розчину, нагрітого до температури +37 °С, і додають 0,05 мл сечі. Вміст перемішують і інкубують у водяній бані точно 15 хв. У пробірку додають 3 мл 10 %-ного розчину оцтової кислоти і перемішують. Контрольну пробу готують аналогічно, але сечу додають після інкубації. Вимірюють екстинцію дослідної проби проти контрольної при 400–420 нм у кюветі товщиною робочого шару 1 см.
Активність гамма-глутамілтранспептидази визначають за калібруваль-ним графіком, для побудови якого зі стандартного розчину п-нітро-аніліну (вміст ампули) готують розведення (табл. 5).
Таблиця 5 – Розведення п-нітроаніліну
| № пробірки | Стандартний розчин п-нітроаніліну | Дистильована вода, мл | Активність ферменту | |
| нмоль/с´л | мкмоль/г´мл | |||
| 1. | 0,1 | 0,9 | 1,98 | |
| 2. | 0,2 | 0,8 | 3,96 | |
| 3. | 0,4 | 0,6 | 7,92 | |
| 4. | 0,8 | 0,2 | 15,84 | |
| 5. | 1,0 | – | 19,80 |
Примітка. 1. За активності проби вище 5000 нмоль/с´л її розводять ізотонічним розчином NaCl. Результат множать на коефіцієнт розведення.
2. Активність гамма-глутамілтранспептидази не змінюється протягом 7-ми днів при зберіганні консервованої сечі при +4°С і протягом 3-х місяців при –20 °С.
3. У випадку використання кювети з робочим об’ємом більше 1 см кількість робочого розчину необхідно пропорційно збільшити.
У пробірки відмірюють по 0,05 мл одержаних розчинів, додають по 3,5 мл 10 %-ного розчину оцтової кислоти, перемішують і колориметрують проти дистильованої води в умовах, аналогічних дослідній пробі. Будують графік залежності щільності розчину від активності ферменту. Лінійність калібрувального графіка зберігається до активності 5000 нмоль/с´л.
Діагностичне значення визначення
активності гамма-глутамілтранспептидази
Гамма-глутамілтранспептидаза (ГГТ) каталізує перенесення глутамілового залишку та гамма-глутамілпептиду на акцепторний пептид чи на альфа-амінокислоту. Фермент має найвищу активність у нирках, печінці, особливо в клітинах, які формують ниркові канальці та жовчні протоки, а також у підшлунковій залозі. Зростання активності ГГТ у сироватці крові свідчить про патологічні процеси в гепатобіліарній системі, а підвищення його активності в сечі – про ураження нирок. Активність ГГТ в сечі корів періоду ранньої лактації коливається в межах від 0,12 до 0,9 мккат/л і в середньому становить 0,32±0,14 мккат/л, що майже не відрізняється від показника у сухостійних глибокотільних корів. У хворих на нефротичний синдром корів активність ензиму в сечі збіль-шується у 2,6 рази, а в дійних корів – удвічі порівняно з клінічно здо-ровими, що свідчить про порушення структури проксимальних ниркових канальців. У сечі одноденних телят активність ГГТ становить 0,12±0,02 (0,08–0,20) мккат/л, у подальшому активність її зростає майже вдвічі, що вказує на підвищення інтенсивності всіх обмінних процесів, які перебігають у нирковій тканині саме у цей період. У 30-денних телят активність ензиму в 2 рази менша порівняно з одноденними (0,06±0,01). У телят, хворих на колібактеріоз, активність ГГТ в сечі на перший день хвороби зростає в 2 рази порівняно з клінічно здоровими, що свідчить про розвиток дистрофічних змін не лише в клубочках, а й у канальцях.
2.9.2. Визначення α-амілази
(за методом Каравея)
Принцип методу. Метод ґрунтується на визначенні залишку нерозщепленого α-амілазою крохмалю. Концентрацію крохмалю визначають за кольоровою реакцією з йодом. Активність α-амілази пропорційна до зменшення інтенсивності забарвлення при 640 нм.
Обладнання: фотоелектроколориметр (кфк-2, КФК-3) або спектрофотометр; водяна баня; піпетки.
Реактиви: 1) концентрований субстратно-буферний розчин – 10 мл (0,5 %-ний розчин крохмалю, розчинений в 0,25 М тріс-НCl буфері, рН 7,1); 2) концентрований розчин йоду – 1 мл (0,1 М); 3) концентрований стоп-розчин – 10 мл (4 Н НСl, ч).
Використовують набір реактивів НВФ “Simko-Ltd”, м. Львів*.
Приготування субстратно-буферного розчину. Один об’єм концент-рованого розчину змішують з чотирма об’ємами дистильованої води (наприклад, до 10 мл концентрованого субстратно-буферного розчину додають 40 мл дистильованої води і перемішують).
Приготування робочого розчину йоду. Концентрований розчин стійкий у темному місці. Робочий розчин одержують у день використання розведенням концентрованого розчину у 50 разів (наприклад, 0,1 мл концентрованого розчину + 4,9 мл дистильованої води і перемішують).
Приготування робочого стоп-розчину. Одержують розведенням концентрованого розчину в 40 разів (10 мл концентрованого розчину + 390 мл дистильованої води і перемішують). Розчин стійкий.
Відбір проб. Використовують профільтровану сечу, яку за активності понад 140 мг/(с´л) необхідно розвести ізотонічним розчином натрію хлориду в 2–100 разів. При розрахунку активності амілази враховують коефіцієнт розведення.
Хід визначення. Визначення α-амілази проводять згідно зі схемою (табл. 6).
Вимірюють поглинання дослідної і контрольної проб при 640 нм проти дистильованої води (можна використовувати довжину хвиль 630–690 нм або червоний світлофільтр; кювета з товщиною робочого шару 1 см).
Таблиця 6 – Схема визначення α-амілази
| Розчини, мл | Дослідна проба | Контрольна проба |
| Субстратно-буферний розчин | 0,5 | 0,5 |
| Витримують на водяній бані при +37 °С протягом 5 хв | ||
| Сеча | 0,01 | – |
| Витримують точно 7,5 хв на водяній бані при 37 °С | ||
| Стоп-розчин | 4,0 | 4,0 |
| Розчин йоду | 0,5 | 0,5 |
| Сеча | – | 0,01 |
Активність α-амілази розраховують за формулою:
α-амілаза [мг(с/л)] 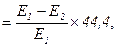
де Е1 – поглинання контрольної проби; Е2 – поглинання дослідної проби; 44,4 – коефіцієнт перерахунку на 1 с інкубації і 1 л сечі.
Перерахунок. 1 мг/(с´л) = 3,6 мг/(год´мл); 1 мг/(год´мл) = 0,278 мг/(с´л).
Примітка. *приготування реактивів приведено у джерелах: Клиническая лабораторная диагностика в ветеринарии: Справочное издание / И.П. Кондрахин, Н.В.Курилов,
А.Г. Малахов и др. – М.: Агропромиздат, 1985. – С. 139–140.
Діагностичне значення визначення
альфа-амілази
Альфа-амілаза (α-амілаза) каталізує ендогідроліз 1,4-глюкозидних зв’язків крохмалю, глікогену та інших споріднених з ними полісахаридів до мальтози, декстринів чи інших полімерів. Альфа-амілаза секретується підшлунковою та слинними залозами; невисока її активність спостерігається в печінці та скелетних м’язах. Низька молекулярна маса амілази (≈48000) сприяє фільтрації ферменту через ниркові клубочки і виділенню із сечею. Ензим складається з двох фракцій – панкреатичної та слинної. У сироватці крові вищою є активність слинного ізоферменту, а в сечі – панкреатичного. Підвищення активності амілази в сироват-ці крові та сечі спостерігається при пошкодженні слинних та підшлункової залоз. Значна та швидка гіперамілаземія і гіперамілазурія розвиваються при гострому паротиті та гострому панкреатиті. Меншою мірою зростання активності альфа-амілази реєструється при виразках шлунка, хімостазі, дистрофії печінки, гепатиті, жовчнокам’яній хворобі. При патології нирок активність ферменту може зростати у крові, а в сечі – знижується. Гіперамілаземію зумовлюють ряд лікарських препаратів (кортикостероїди, саліцилати, тетрациклін, фуросемід, гістамін).
2.9.3. Визначення активності
лужної фосфатази в сечі
Принцип визначення. Метод базується на визначенні кількості фенолу, що вивільняється при гідролізі динатрійфосфату. В лужному середовищі в присутності окисника фенол утворює з 4-аміноантипірином комп-лекс червоного кольору, який інтенсивно поглинає світло з довжиною хвилі 510 нм. Визначення проводиться без попереднього видалення білка з проби.
Обладнання: фотоелектроколориметр (кфк-2, КФК-3) або спектрофотометр; водяна баня; пробірки; піпетки на 0,1; 1,0 і 2,0 мл.
Реактиви: 1) буферний розчин – 100 мл; 2) реагент № 1 – 1 флакон; 3) субстрат – 2 флакони; 4) фенол-стандарт (30 ммоль/л) – 1 флакон.
Використовують набір реактивів НВФ “Simko Ltd”, м. Львів.
Приготування буферного розчину. Вміст флакона з концентрованим буферним розчином розводять дистильованою водою при перемішуванні до кінцевого об’єму 260 мл. розчин зберігають у пластиковому посуді в темному місці при + 4 °С.
Приготування субстратно-буферного розчину. Вміст флакону з субст-ратом розчиняють у 120 мл робочого буферного розчину. Зберігати при + 4 °С.
Приготування розчину окисника. Вміст флакону з реагентом № 1 розчинити при нагріванні до 40–50 °С у 640 мл дистильованої води. Зберігати в темному посуді при кімнатній температурі.
Приготування фенол-стандарту (5 ммоль/л). одержують розведенням концентрованого розчину фенолу (30 ммоль/л) у 6 разів: 3 мл вихід-ного розчину + 15 мл дистильованої води. Зберігати при + 4 °С.
Хід визначення. Дослідження проводять на фотоколориметрі або спектрофотометрі (довжина хвилі 510 нм) у кюветі з товщиною оптичного шару 10 мм згідно зі схемою, поданою в табл. 7.
Таблиця 7 – Схема проведення визначення лужної фосфатази
| Додати, мл | Проба | Контроль | Стандарт |
| Субстратно-буферний розчин | 0,8 | 0,8 | 0,8 |
| Преінкубують 5 хв на водяній бані при 37 °С | |||
| Сеча | 0,05 | – | – |
| Перемішують і інкубують рівно 10 хв на водяній бані при 37 °С | |||
| Розчин окисника | 2,0 | 2,0 | 2,0 |
| Сеча | – | 0,05 | – |
| Фенол-стандарт | – | – | 0,05 |
| Перемішують і через 5 хв визначають оптичну щільність проби проти контролю |
Активність лужної фосфатази визначають за формулою:
Лужна фосфатаза (нмоль/(с×л) = 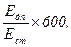
де Едп – екстинція дослідної проби; Ест – екстинція стандарту; 600 – коефіцієнт переводу часу інкубації в секунди (10 × 60).
Примітка. Якщо активність лужної фосфатази в досліджуваній сечі перевищує 5000 нмоль/(с×л), її розводять ізотонічним розчином у 2–5 разів і повторно проводять визначення. Одержаний результат множать на коефіцієнт розведення.
Діагностичне значення визначення
лужної фосфатази
Лужна фосфатаза (ЛФ) активує розщеплення фосфорно-органічних сполук. Фермент розміщується в клітинах у зв’язаному з плазматичними мембранами стані. ЛФ складається із різних ізоферментів, які локалізуються переважно в епітелії жовчовивідних шляхів, плазматичних мембранах гепатоцитів і нейронів, кістках, кишечнику, плаценті, нирках.
3. Особливості одержання
і дослідження сечі в коней
У тварин сечу одержують, масажуючи шкіру промежини. Для коней цей метод неприйнятий, оскільки масаж у переважної більшості випадків викликає закриття сфінктера сечового міхура. Тому для відбору сечі в них застосовують кілька методів, найчастіше – природне її виділення. На жаль, цей метод непридатний для масового відбору сечі при диспансеризації, тому що потребує дуже багато часу (інколи 5–8 годин для відбору 3–4-х проб сечі) і може бути ефективним при взятті сечі лише у хворих коней. Численні спостереження показують, що акт сечовиділення в коней можна викликати штучно. Для цього тварин після прогулянки заводять у конюшню, особливо в холодну пору року або після інтенсивної роботи та тренінгу; можна перетрушувати в деннику солому в присутності коня або завезти свіжу підстилку.
Слід зазначити, що в частини коней, особливо у жеребців і меринів, присутність людини затримує акт сечовиділення. Тому підходити із посудом для відбору сечі необхідно обережно і тільки після початку акту сечовиділення. Спокійним тваринам можна надіти спеціальні сечозбиральні мішки.
Взяття сечі в кобил краще проводити катетером, ефективність катетеризації становить 70–85 %. Найбільш складно брати сечу в коней до дворічного віку. У підсисних лошат (до 6-місячного віку) сечовидільний отвір дуже малий, і сфінктер сечового міхура за найменшого подразнення інтенсивно скорочується, що ускладнює проходження катетера в сечовий міхур і виділення сечі. У більш старшому віці (після 6 місяців) ця процедура небезпечна для фахівців, тому катетеризацію можна провести лише у флегматичних тварин. У жеребців катетеризацію проводити досить складно і здебільшого небезпечно для здоров’я як людини, так і тварини.
Після одержання сечі визначають її фізичні властивості: колір, прозорість, консистенцію, відносну густину та реакцію. За неможливості відразу провести дослідження, сечу зберігають у холодильнику. Заморожування сечі або зберігання її при кімнатній температурі негативно впливає на результати.
Свіжа сеча в коней буває різного забарвлення. У лошат першого місяця життя вона – від лимонно-жовтого до жовтого кольору. У лошат місяч-ного віку колір змінюється від жовтого до жовто-коричневого. Цей процес триває три–чотири місяці. Надалі колір сечі, незалежно від віку, коливається від молочно-жовтого до жовто-коричневого, інколи – до ко-ричневого кольору. Слід зазначити, що через кілька хвилин після взяття сеча починає розділятися на дві фракції (надосадова рідина і осад), кожна з яких має свій колір. Зокрема, верхня частина (супернатант) є завжди темнішою (вона жовто-коричневого або коричневого кольору), а нижня (осад) – від біло-лимонного до світло-коричневого забарвлення. При тривалому зберіганні (на кінець першої доби) сеча змінює забарвлення внаслідок окиснення фенолів і в нижній частині супернатанту набуває темно-коричневого кольору. Верхня частина надосадової рідини завжди світліша. При кімнатній температурі цей процес відбувається протягом кількох годин, але ці зміни не впливають на показники сечі. У неплідних кобил сеча має колір від блідо- до буро-жовтого, а в жеребних колір її залежить від терміну вагітності. У більшості кобил із малим терміном жеребності (1–3 місяці) колір сечі біло-жовтий і лише у третини – від гірчичного до коричневого (зрідка). В останні місяці жеребності сеча значно темніша – від жовто-коричневого до коричневого кольору (Жила І.А., 2004).
На відміну від інших тварин, у здорових дорослих коней сеча непрозора, оскільки в ній міститься багато солей кальцію. У деяких тварин перші порції сечі можуть бути прозорими, але в кінці сечовиділення вона стає зовсім мутною. Через наявність великої кількості слизу, помутніння може бути у вигляді циліндра, але при перемішуванні або стоянні сеча стає рівномірно мутною. При нефротичному синдромі сеча в коней стає більш прозорою або зовсім прозорою завдяки кислій реакції сечі, що сприяє розчиненню солей. У лошат до місячного віку сеча прозора, надалі вона теж мутніє і в шестимісячному віці не відрізняється від сечі дорослих тварин.
Консистенція сечі в дорослих коней – слизова (від домішування муцину, який утворюється в ниркових мисках та сечовому міхурі). Інколи вона драглеподібна і розтягується у вигляді ниток. У лошат першого місяця життя консистенція її водяниста, надалі вона стає густішою, а після однорічного віку – тягучою. Водянистою сеча в коней буває при поліурії та нефротичному синдромі.
Date: 2015-07-01; view: 391; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |