
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Редактор Л.М.Тонкошкур
МЕТОДИЧНІ ВКАЗІВКИ І КОНТРОЛЬНІ ЗАВДАННЯ
З КУРСУ
„ЕНЕРГОТЕХНОЛОГІЯ ХІМІКО-ТЕХНОЛОГІЧНИХ ПРОЦЕСІВ”
ДЛЯ СТУДЕНТІВ ІІІ КУРСУ ТЕХНОЛОГІЧНИХ СПЕЦІАЛЬНОСТЕЙ ДЕННОЇ І ЗАОЧНОЇ ФОРМ НАВЧАННЯ
Дніпропетровськ ДВНЗ „ УДХТУ ”
Міністерство освіти і науки України
Державний вищий навчальний заклад
„УКРАЇНСЬКИЙ ДЕРЖАВНИЙ ХІМІКО-ТЕХНОЛОГІЧНИЙ УНІВЕРСИТЕТ”
МЕТОДИЧНІ ВКАЗІВКИ ДО ВИКОНАННЯ КОНТРОЛЬНИХ ЗАВДАНЬ
з дисципліни „Енерготехнологія хіміко-технологічних процесів” для студентів 3-го курсу технологічних спеціальностей денної і заочної форм навчання
Затверджено
на засіданні кафедри енергетики
Протокол № 11 від 02.06.2011 р.
Дніпропетровськ ДВНЗ „ УДХТУ ”
Методичні вказівки і контрольні завдання з курсу „Енерготехнологія хіміко-технологічних процесів” для студентів ІІІ курсу технологічних спеціальностей денної і заочної форми навчання /Укл. Г.Т.Циганков, М.П.Сухий, І.В.Трусков, О.І.Стоян, І.Л.Решетняк, В.Є.Нікольський. – Дніпропетровськ: ДВНЗ „УДХТУ”, 2007. – 34 с.
Укладачі: Г.Т.Циганков, докт. техн. наук
М.П.Сухий, канд. техн. наук
I.В.Трусков, канд. техн. наук
О.I.Стоян,
І.Л.Решетняк
В.Є.Нікольський, канд. техн. наук.
Відповідальний за випуск М.П.Сухий, канд. техн. наук
Навчальне видання
Методичні вказівки і контрольні завдання
з курсу „Енерготехнологія хіміко-технологічних процесів”
для студентів ІІІ курсу технологічних спеціальностей
денної і заочної форми навчання
Укладачі: Циганков Григорій Тимофійович
М.П.Сухий, канд. техн. наук
Трусков Ігор Васильович
Стоян Олена Іванівна
Решетняк Ірина Леонідівна
Нікольський Валерій Євгенович
Редактор Л.М.Тонкошкур
Коректор Л.Я.Гоцуцова
Підписано до друку Формат 60х84 1/16. Папір ксерокс. Друк різограф. Умовн.-друк. арк.. Облік.-вид. арк.. Тираж прим. Зам. №. Свідоцтво ДК 303 від 27.12.2000.
| УДХТУ, 49005, Дніпропетровськ,5, просп. Гагаріна, 8. |
Видавничо-поліграфічний комплекс Інком центру
ВСТУП
У своїй практичній діяльності інженер-технолог хімічної промисловості забезпечує здійснення хіміко-технологічних процесів, що відбуваються в теплових агрегатах реального призначення (промислові печі, реактори, випарники, теплообмінники, холодильні машини та ін.) і пов’язані з хімічними перетвореннями матеріалів, спалюванням палива, рухом газів і матеріалів, теплопередачею та іншими процесами.
Студенти технологічних спеціальностей, керуючись методичними вказівками, повинні самостійно вивчити рекомендовану літературу і виконати письмові роботи. Зі всіма незрозумілими питаннями слід звертатися на кафедру енергетики. При вивченні теоретичного матеріалу, як і при вирішенні задач, необхідно звертати особливу увагу на одиниці вимірювань фізичних величин, з якими студенту доведеться проводити математичні операції.
Мета вивчення курсу ‑ засвоїти основні закони термодинаміки, теплообміну, процесів спалювання палива, роботи промислових енергетичних установок, утилізації вторинних енергоресурсів і відходів виробництва, енерготехнологічного комбінування відносно хіміко-технологічних систем.
Після вивчення курсу студенти повинні: знати основні закони термодинаміки, теплообміну, аналітичні залежності, що пов'язують термодинамічні параметри різних процесів, способи порівняння ефективності роботи теплових машин і теплоенергетичного устаткування, фізичну сутність процесів, що протікають в теплових агрегатах; вміти пояснювати сутність основних законів термодинаміки, теплообміну, спалювання палива і записувати аналітичні вирази, застосовуючи їх до аналізу термодинамічних процесів і циклів, порівнювати ефективність роботи різних теплових машин, прогнозувати наслідки при зміні параметрів робочих тіл, вибрати теплові режими теплоенергетичного устаткування, використовувати в розрахунках термодинамічні функції, таблиці і діаграми.
1. МЕТОДИЧНІ ВКАЗІВКИ
1.1. Загальні відомості
Енерготехнологія хіміко-технологічних процесів є загальнотехнічною дисципліною, що вивчає способи отримання, перетворення, передачі і використання теплоти, а також принципи дії і конструктивні особливості теплових і холодильних машин, апаратів і пристроїв, що забезпечують спалювання палива, здійснення технологічних процесів, утилізацію вторинних енергоресурсів і енерготехнологічне комбінування в хімічній технології. У зв'язку з цим даний курс складається з трьох розділів:
1) технічна термодинаміка;
2) промислові теплоенергетичні установки;
3) енерготехнологічне комбінування і використання вторинних енергоресурсів.
1.2. Технічна термодинаміка
Технічна термодинаміка ‑ наука, що вивчає перетворення теплоти на роботу, умови, за яких вони здійснюються, і процеси, що відбуваються в газах і парах, а також їх властивості за різних фізичних умов. Технічна термодинаміка також встановлює взаємозв'язок між тепловими і механічними процесами в теплових і холодильних машинах.
Перший і другий закони термодинаміки, що являють собою узагальнення досвіду пізнання людиною природи, ‑ теоретична основа технічної термодинаміки. Основна особливість методу термодинаміки ‑ логічне послідовне застосування аналітичних виразів першого і другого законів термодинаміки спільно з рівнянням стану робочого тіла без використання будь-яких гіпотез і знань про внутрішню молекулярну його будову.
Перший закон термодинаміки
Студент повинен зрозуміти особливості застосування в термодинаміці загального закону збереження і перетворення енергії. Аналітичний вираз першого закону термодинаміки має дві форми ‑ коли робоче тіло нерухоме, і коли воно рухається зі швидкістю w:
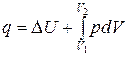 і
і 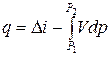
або
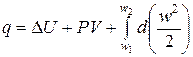
Другий закон термодинаміки
Безперервне отримання роботи за рахунок підведення теплоти можливе тільки в циклі з підведенням і відведенням теплоти до робочого тіла і неможливе отримання роботи при використанні одного джерела теплоти. Тому слід ретельно вивчити всі питання, що відносяться до циклів, особливо до циклу Карно, який має велике значення в термодинаміці, оскільки з його допомогою виводять всі аналітичні залежності, що відносяться до другого закону термодинаміки, а формула для ККД цього циклу ‑ технічний вираз суті другого закону термодинаміки в застосуванні до теплових машин.
Термодинамічні процеси
В термодинаміці перехід робочого тіла з одного рівноважного стану в інший здійснюється в зворотному термодинамічному процесі. Основна задача дослідження термодинамічного процесу ‑ визначення теплоти q1-2, що бере участь в процесі, і роботи зміни об'єму робочого тіла 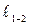 .Такі величини, як зміна внутрішньої енергії DU1-2, ентальпії Di1-2 і ентропії DS1-2, є допоміжними, вони необхідні для вирішення основного завдання.
.Такі величини, як зміна внутрішньої енергії DU1-2, ентальпії Di1-2 і ентропії DS1-2, є допоміжними, вони необхідні для вирішення основного завдання.
Загальний метод дослідження термодинамічних процесів універсальний. Він не залежить від природи робочого тіла і базується на застосуванні справедливого для будь-яких робочих тіл рівняння першого закону термодинаміки, записаного в двох рівнозначних формах:
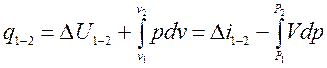 .
.
Термодинамічний аналіз процесів стиснення газів в компресорах
Через широке розповсюдження в промисловості компресорів термодинамічний аналіз їх роботи має велике значення при навчанні студентів-технологів. Необхідно вміти порівняти ізотермічне, адіабатне і політропне стиснення робочого тіла і витрачену при цьому роботу.
Цикли газотрубних установок (ГТУ)
При розгляді газотрубних установок потрібно звернути увагу на їх переваги перед поршневими двигунами внутрішнього згоряння. Розібрати принцип роботи газотурбінних установок, знати схему установок та вміти аналізувати їх роботу, використовуючи P‑V і T‑S діаграми.
Цикли паросилових установок
Особливу увагу слід приділити основному циклу паросилової установки. Дослідження основного циклу здійснюються за допомогою P‑V, T‑S і I‑S діаграм. Розібрати виведення рівняння для визначення термічного ККД циклу Ренкіна. Підвищення ККД досягається шляхом змін в самому циклі, які приводять до створення циклів (найцікавіші цикли з вторинним перегрівом пари, регенеративний, парогазовий, бінарні). Не дивлячись на зниження термічного ККД в теплофікаційному циклі, метод комбінованого вироблення теплової і електричної енергії є найбільш прогресивним. При вивченні теми необхідно ознайомитися із загальними поняттями термодинамічних циклів атомних установок.
Цикли холодильних машин
Засвоївши учбовий матеріал цієї теми, необхідно навчитися аналізувати за допомогою Т‑S діаграми роботу холодильних циклів, визначати холодильні коефіцієнти і холодопродуктивність установок. Особливу увагу слід звернути на роботу парової компресорної холодильної установки, що набула найбільшого поширення в промисловості. За зворотним циклом працюють не тільки холодильні машини, але і теплові насоси, в яких теплота, що забирається від навколишнього середовища, за допомогою витраченої роботи підвищує енергетичний рівень робочого тіла і за більш високої температури віддається зовнішньому споживачу. Потрібно з'ясувати поняття коефіцієнта тепловикористання і розібрати принципову схему і роботу теплового насоса.
1.2. Промислові теплоенергетичні установки
Паливо і його характеристика, основи теорії горіння
До палива відносяться кам'яне і буре вугілля, антрацитний дрібняк, торф, продукти перегонки нафти (бензин, дизельне паливо, мазут), природні і штучні гази, які утворюються в технологічних процесах в присутності вуглецю і водню.
Необхідно розрізняти робочу, горючу, суху і органічну маси палива і розбиратися у формулах для перерахунку палива з однієї маси в іншу. Необхідно зрозуміти відмінність між нижчою і вищою теплотою згоряння палива і методику перерахунку при переході від однієї маси тіла до іншої. Потрібно навчитися визначати витрату умовного палива по відомій витраті натурального. Слід з'ясувати, що горіння палива ‑ це фізико-хімічний процес окислення його пальних складових, що супроводжується виділенням теплоти і утворенням продуктів згоряння. Необхідно ознайомитись з впливом сумішоутворення на швидкість розповсюдження полум'я і повноту згоряння палива, а також із шляхами інтенсифікації процесів горіння.
Печі хімічної промисловості
При розгляді типів печей, що застосовуються в хімічній промисловості, особливу увагу слід звернути на вивчення будови і принципу дії елементів паливних печей: топкового пристрою для спалювання палива і організації теплообміну, теплообмінних пристроїв для регенерації теплоти димових газів, утилізаційних установок для використання теплоти відхідних газів, тягових і дуттьових пристроїв. Студент повинен уміти складати тепловий баланс печі, визначати її потужність і теплову продуктивність, питому витрату теплоти і ККД. Слід ознайомиться з аеродинамічним розрахунком опору повітряного і газового трактів печі і методом підбору вентиляторів і димососів.
1.4. Енерготехнологія хіміко-технологічних процесів
Комплексні енерготехнологічні методи використання палива дозволяють значно підвищити коефіцієнт використання теплоти палива та забезпечити економію енергоресурсів і успішно вирішувати задачу захисту навколишнього середовища. В хіміко-технологічних системах енергетичне устаткування напряму з'єднується з хіміко-технологічним устаткуванням, складаючи єдину систему.
Потрібно вивчити найпростіші енерготехнічні (ЕТ) схеми використання твердого, рідкого і газоподібного палива. Слід ознайомитися з ЕТ схемами використання теплоти хімічних реакцій і схемами ядерно-технологічних комплексів.
Вторинні енергетичні ресурси (ВЕР) в хімічних виробництвах
Вторинні енергоресурси ‑ використовуваний енергетичний потенціал основної і побічної продукції, відходів, утворених в технологічних агрегатах, який може бути використаний для енергопостачання інших агрегатів. Необхідно знати напрями використання ВЕР різних видів. Уміти визначати можливу виробітку теплоти за рахунок ВЕР, економію палива за рахунок використання ВЕР, коефіцієнт утилізації ВЕР. Ознайомитися з утилізаційним обладнанням для утилізації горючих відходів, високотемпературних і низькопотенційних теплових відходів, отримання холоду.
2. КОНТРОЛЬНІ ЗАВДАННЯ
Загальні вказівки
При вирішенні задач необхідно вивчити відповідний теоретичний матеріал, заздалегідь розібрати і самому повторити вирішення типових задач в окремих розділах.
При вирішенні задач необхідно дотримувати наступні вимоги:
1) виписувати умови задач повністю, без скорочень;
2) супроводжувати рішення коротким пояснювальним текстом; при застосуванні діаграм приводити графічне зображення рішення і необхідні аналітичні залежності з достатнім поясненням;
3) приводити обчислення в розгорненому вигляді;
4) давати значення фізичних величин в системі СІ;
5) формулювати пояснення по ходу рішення завдань; не допускати скорочень і умовностей в тексті;
6) проводити короткий аналіз отриманих результатів рішення задачі і робити відповідні виводи;
7) виконувати роботу на стандартних листах А-4.
Приклади вирішення задач
А. Рівняння стану ідеального газу
Рівняння Клапейрона:
для 1 кг ідеального газу: 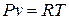 ;
;
для М кг ідеального газу 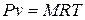 ;
;
для 1 кмоля ідеального газу 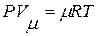 ,
,
де Р ‑ абсолютний тиск газу, Н/м2; v ‑ питомий об'єм газу, м3/кг; V ‑ об'єм газу, м3; Vµ ‑ об'єм 1 кмоля газу, м³; µ ‑ маса 1 кмоля газу, кг; R – газова стала, віднесена до 1 кг газу, Дж/(кг×К); Т ‑ абсолютна температура газу, К.
Газова стала, віднесена до 1 кг газу:
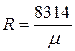 , Дж/(кг×К);
, Дж/(кг×К);
де 8314 ‑ універсальна газова стала 1 кмоля газу, Дж /(кмоль·К).
Абсолютний тиск газу визначається із наступних співвідношень:
‑ якщо абсолютний тиск більше тиску навколишнього середовища
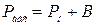 , Н/м²,
, Н/м²,
де Рн ‑ надмірний тиск, вимірюваний манометром, Н/м²;
В ‑ тиск навколишнього середовища, вимірюваний барометром, Н/м²;
‑ якщо абсолютний тиск менше тиску навколишнього середовища
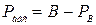 , Н/м²,
, Н/м²,
де РВ ‑ розрідження, вимірюване вакуумметром, Н/м².
Приклад 1. Визначте температуру кисню, який знаходиться в резервуарі місткістю V = 10 м3 за умови, що на манометрі Рн = 7·105 Н/м², барометричний тиск В = 740 мм рт.ст., масса газу М =100 кг.
Рішення. З рівняння Клапейрона для маси М кг газу Т = PV/(MR). Тоді:
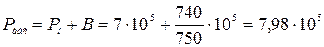 Н/м²;
Н/м²;
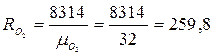 Дж/(кг×К);
Дж/(кг×К);
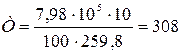 K.
K.
Б. Теплоємність газів
Теплоємність газів ‑ це кількість теплоти, що потрібна для нагріву (або охолоджування) одиниці кількості речовини на 1ºС. Розрізняють відповідно масову С [кДж/(кг·К)]; об'ємну С' [кДж/(м³·К) ] і молярну µС [кДж/(кмоль·К)] теплоємності.
Залежно від умов нагріву (або охолоджування) розрізняють відповідно ізохорну 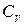 ,
, 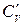 ,
, 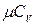 і ізобарну
і ізобарну 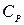 ,
, 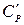 ,
, 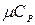 теплоємності.
теплоємності.
Теплоємність ‑ величина змінна і значення теплоємностей ідеальних газів зростають з підвищенням температури. Тому в розрахунках витрати теплоти для нагріву газу використовується не дійсна, а середня теплоємність в заданому інтервалі температур, наприклад:
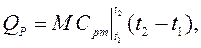
де QР ‑ кількість підведеної теплоти до М кг газу при нагріві в інтервалі температур від t 1 і до t 2 при постійному тиску, кДж;
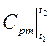 ‑ середня масова теплоємність при постійному тиску в інтервалі температур від t 1 до t 2, кДж /(кг К),
‑ середня масова теплоємність при постійному тиску в інтервалі температур від t 1 до t 2, кДж /(кг К),
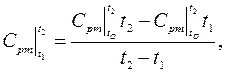
де 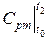 і
і 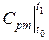 ‑ середні теплоємності при постійному тиску в інтервалі температур від 0 до t 1 і t 2, визначувані за відповідними таблицями.
‑ середні теплоємності при постійному тиску в інтервалі температур від 0 до t 1 і t 2, визначувані за відповідними таблицями.
В деяких розрахунках, що не вимагають великої точності, можна допустити, що C=const, тобто теплоємність не залежить від температури, тоді масові і об'ємні теплоємності визначають з молярних, залежних тільки від атомності газів. Зв'язок між молярною, масовою і об'ємною теплоємностями представлений таким чином:
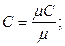
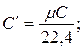
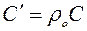 ,
,
де r 0 – густина газу за нормальних умов.
Наближені значення молярних теплоємностей при постійному тиску (C=const) наведені в табл. 2.1.
Таблиця 2.1.
| Параметр | Газ | ||
| одноатомний | двоатомний | трьох- і багатоатомний | |
| μСv, кДж/(кмоль·К) | 12,56 | 20,93 | 29,31 |
| μСp, кДж/(кмоль·К) | 20,93 | 29,31 | 37,68 |
Приклад 2. Визначте середню відповідно масову Сv m и об’ємну С 'vm теплоємність повітря в процесі V=const в межах температур від t1=200°С до t2=500°С, вважаючи, що залежність теплоємності від температури криволінійна.
Рішення
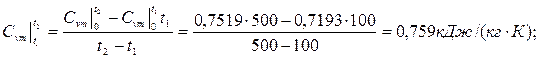
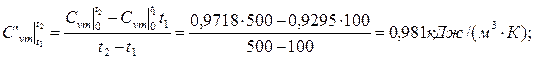
Приклад 3. Визначте кількість теплоти, яку потрібно підвести до резервуару місткістю V0=3 м3 CO2 при Р = 7·10 Н/м², для нагріву від температури t1=200°С до t2=700°С в процесі Р=const. Теплоємність прийняти постійною.
Рішення (у двох варіантах):
Варіант 1.
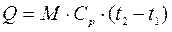
З характеристичного рівняння маса газу 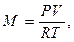
де
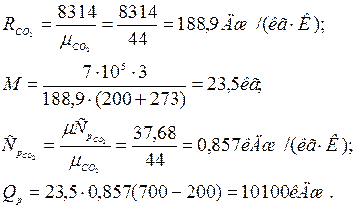
Варіант 2.
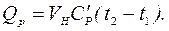
Об'єм газу за нормальних умов з рівняння об'єднаного закону Гей-Люсака і Бойля – Маріота:
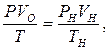
де Р, V0, Т ‑ задані відповідно тиск, об'єм і температура газу; Рн, Vн, Тн ‑ ті ж параметри за нормальних умов.
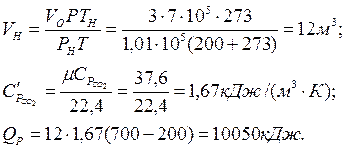
Як видно з рішень по обох варіантах, кількості підведеної теплоти приблизно однакові.
В. Газові суміші
Газова суміш ‑ це механічна суміш газів, що не вступають в хімічні реакції між собою. Вона може бути задана масовими, об'ємними або молярними частками.
Масовою часткою називають відношення маси М i кожного газу, що входить в суміш, до загальної маси М суміші: 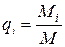 .
.
Об'ємною часткою називають відношення приведеного об'єму Vi газу до загального об'єму суміші Vсу м газів:
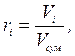
де Vi ‑ приведений об'єм, тобто об'єм, який займав би компонент газу при певній температурі і тиску суміші 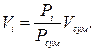
Молярною часткою називається відношення числа молей Ki кожного газу до числа молей суміші К ‑ Кi /К. Молярна частка чисельно дорівнює об'ємній частці:

Газова постійна суміші газів розраховується залежно від способу завдання суміші
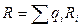 або
або 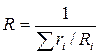 .
.
Середня (уявна) молярна маса суміші
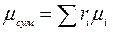 або
або 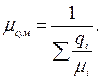
Парціальний тиск кожного газу дорівнює добутку загального тиску суміші на його об'ємну частку: 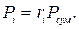
Параметри газової суміші можуть бути обчислені з рівняння Клапейрона PV=MRT, де всі величини, що входять в рівняння, відносяться до суміші газів.
Приклад 4. Об'ємний склад сухих продуктів згоряння палива наступний, %: 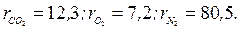 Знайти уявну молярну масу, газову постійну, густину і питомий об'єм продуктів згоряння при В=750 мм рт.ст., t=800°С.
Знайти уявну молярну масу, газову постійну, густину і питомий об'єм продуктів згоряння при В=750 мм рт.ст., t=800°С.
Рішення
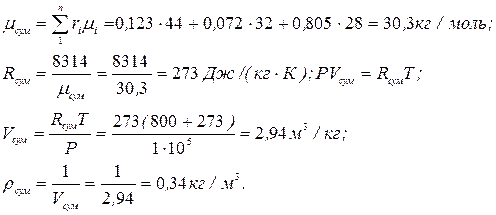
Г. Термодинамічні процеси ідеального газу
Термодинамічним процесом називають зміну параметрів стану робочого тіла. Існує нескінченна кількість термодинамічних процесів, їх називають політропними, і зміна параметрів в них підкоряється рівнянню: PVn = const, де n ‑ показник політропи.
Окремими процесами є ізохорний (V=const), ізобарний (P=const), ізотермічний (T=const) і адіабатний (dq=const), який протікає без відведення і підведення теплоти. Для будь-якого процесу зміна внутрішньої енергії 1 кг газу обчислюється за виразом:
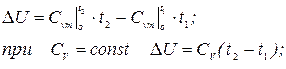
зміна ентальпії:
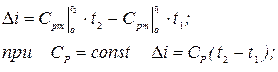
зміна ентропії:

Приклад 5. В закритій посудині знаходиться повітря при тиску Р 1=5 бар і температурі t1=27°С. Визначте тиск повітря після охолоджування до 0°С. Покажіть процес в P‑V і Т‑S -координатах.
Рішення. Залежність між початковими і кінцевими параметрами в ізохорному процесі наступна: 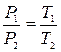 . Тоді
. Тоді
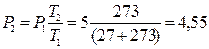 бар.
бар.
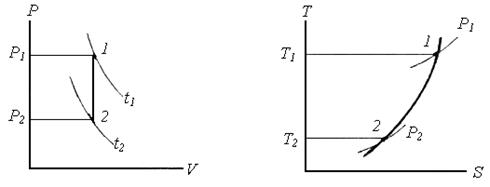
Приклад 6. Визначте роботу ізобарного розширення азоту масою 7 кг при нагріванні в інтервалі температур від t1=2000С до t2=6000С. Покажіть процес в P‑V і Т‑S -діаграмах.
Рішення. Робота розширення
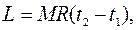

де М ‑ маса газу, R ‑ газова постійна, Дж/(кг×K); t1, t2 ‑ відповідно початкова і кінцева температура азоту, 0С.
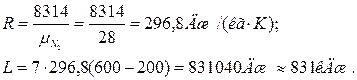
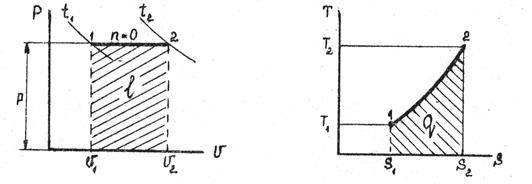
Приклад 7. 0,2 кг кисню при температурі t 1=250С розширюється ізотермічно до триразового збільшення об'єму. Визначте кількість теплоти, що надається тілу.
Рішення. Оскільки в ізотермічному процесі вся підведена теплота йде на здійнення роботи, то
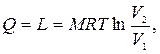
де Q ‑ підведена теплота, Дж; М ‑ маса газу, кг; R ‑ газова постійна, Дж/(кг·К); Т – температура газу, К; V 1 і V 2 ‑ відповідно початковий і кінцевий об'єм, м3.
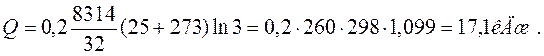
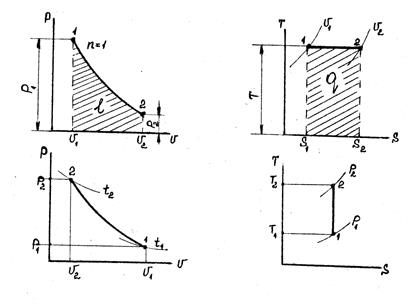
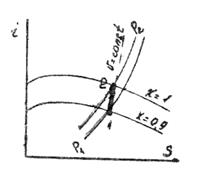
Приклад 8. Газ СО при тиску Р1=0,9 бар і початковій температурі t1=120С адіабатно стискається до тиску Р2=3,6 бара. Визначте температуру в кінці стиснення.
Рішення. Кінцеву температуру визначають із співвідношення параметрів Р і Т в адіабатному процесі:
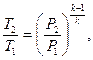
де k – показник адіабати. Для двоатомного газу k =1,4. Тоді
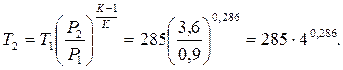
Позначимо  через N. lg N = 0,286×ln4 = 0,286·0,602 = 0,172. Звідси N =1,49. Отже T2 =285·1,49=425 K.
через N. lg N = 0,286×ln4 = 0,286·0,602 = 0,172. Звідси N =1,49. Отже T2 =285·1,49=425 K.
Д. Термодинамічні процеси зміни стану водяної пари
Водяна пара – робоче тіло в парових турбінах і машинах, теплоносій в різних теплообмінниках і т.д. Водяна пара не може розглядатися як ідеальний газ і до неї не застосовні залежності, отримані для ідеальних газів, в тих випадках, коли вони є робочим тілом парових установок.
Графічне зображення термодинамічних процесів з водяною парою
Ізохорний процес (V=const). На P‑V -діаграмі ізохору зображують відрізком прямої, паралельної осі ординат; на T‑S -діаграмі ‑ в області вологої насиченої пари ‑ кривою лінією з опуклістю вгору, а в області перегрітої пари ‑ опуклістю вниз.
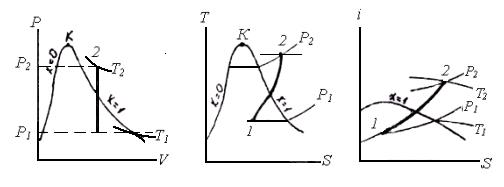
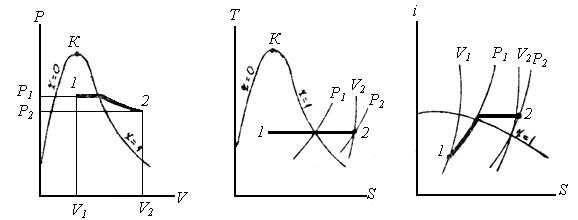
Ізобарний процес (P=const). На P‑V -діаграмі ізобару зображують горизонтальною прямою лінією; на T‑S- діаграмі ‑ в області вологої пари ізобара є одночасно і ізотермою, і її зображають горизонтальною прямою; в області перегрітої пари ‑ кривою з опуклістю вниз; на I‑S- діаграмі в області вологої пари – це похила пряма, а в області перегрітої пари ‑ крива з опуклістю вниз.
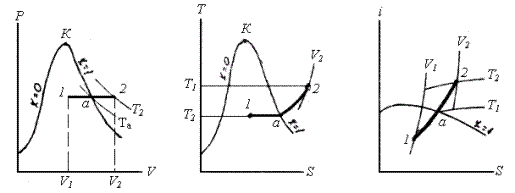
Ізотермічний процес (T=const). На P‑V- діаграмі ізотерму зображають в області вологої пари горизонтальною прямою, в області перегрітої пари ‑ кривою з опуклістю вниз; на T‑S -діаграмі ‑ це горизонтальна пряма. В I‑S -діаграмі в області вологої пари ізотерма співпадає з ізобарою, а в області перегрітої пари її зображають кривою з опуклістю вгору.
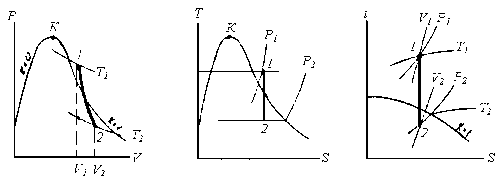
Адіабатний процес. На P‑V -діаграмі адіабату зображають кривою з опуклістю вниз, що йде в області вологої пари більш полого, ніж в області перегрітої пари; на T‑S і I‑S -діаграмах – це вертикальні прямі.
Основні розрахункові формули для процесів, в яких водяна пара є робочим тілом, зведені в табл. 2.2.
Таблиця 2.2
Основні розрахункові формули
| Найменування процесу | Зміна внутрішньої енергії | Теплота, яка бере участь в процесі | Робота процесу |
| Ізохорний | 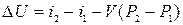
| 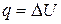
| 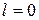
|
| Ізотермічний | 
| 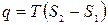
| 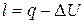
|
| Ізобарний | 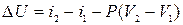
| 
| 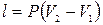
|
| Адіабатний | 
| 
| 
|
Значення параметрів для сухої насиченої пари, води і перегрітої пари беруть з таблиць водяної пари. Значення параметрів вологої насиченої пари визначають за такими формулами:
vx = v'(1-x) + v"x; ix = i'(1-x) + i"x; Sx = S'(1-x) + S"x;
де x ‑ ступінь сухості; v', i', S' і v'', i'', S'' – питомий об'єм, ентальпія і ентропія відповідно киплячої рідині і сухої насиченої пари (беруть з таблиць водяної пари).
Необхідні значення параметрів для будь-якої пари також можуть бути визначені по I‑S -діаграмі, але з меншою точністю.
Приклад 10. Визначте кількість теплоти, що підводиться до 2 кг вологої насиченої пари в процесі v=const при P=5,5 бар і ступені сухості x =0,9 для отримання сухої насиченої пари.
Рішення. Теплота, що підводиться 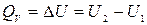 ;
;
 U1 = M (i1 - P1 v1);
U1 = M (i1 - P1 v1);
U2=M (i2-P2 v2).
По I‑S - діаграмі водяної пари знаходимо:
i1 =608 кДж/кг; i2 =660 кДж/кг;
v 1=0,3 м3/кг; v2 =0,3 м3/кг; P2 =6,4 бар.
Тоді
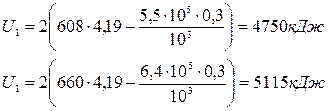
Q υ = U2 - U1 = 5115 – 4750 = 365кДж.
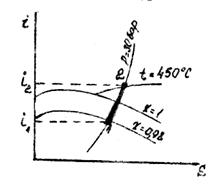 Приклад 11. Визначте кількість теплоти, що витрачається на перегрів 5 кг вологої насиченої пари із ступенем сухості x =0,98 при Р=const =30 бар до температури t = 450°С.
Приклад 11. Визначте кількість теплоти, що витрачається на перегрів 5 кг вологої насиченої пари із ступенем сухості x =0,98 при Р=const =30 бар до температури t = 450°С.
Рішення. По I‑S-діаграмі водяної пари знаходимо: i1 = 660 ккал/кг; i2 = 798 ккал/кг. Тоді:
Qp=M(i2-i1) = 5·4,19(798-660) = 2880 кДж.
Приклад 12. 1 кг вологої насиченої пари при P 1=15 бар і x 1= 0,8 ізотермічно розширюється до P2 = 8 бар. Визначте кількість теплоти, зміну внутрішньої енергії і роботу розширення.
Рішення. По I‑S-діаграмі знаходимо:
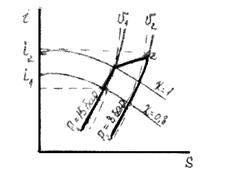 v 1 = 0,105 м3/кг; v 2 = 0,25 м3/кг;
v 1 = 0,105 м3/кг; v 2 = 0,25 м3/кг;
i1 = 573 ккал/кг; i2 = 676 ккал/кг;
S1 = 1,34 ккал/(кг·К);
S2 = 1,62 ккал/(кг·К).
Кількість теплоти:
Q = T(S2-S1) = (198 + 273)·(1,62 - 1,34)·4,19 =
=552 кДж/кг.
Внутрішня енергія в початковому стані:
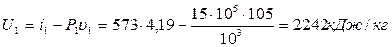 .
.
Внутрішня енергія в кінцевому стані:
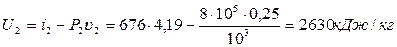 .
.
Робота розширення
і = q – ΔU = 552 – (2630-2242) 552 – 388 = 164 кДж/кг.
Е. Паливо. Матеріальний і тепловий баланси процесу горіння
Елементарний склад твердих і рідких палив записується у вигляді суми вмісту в них вуглецю С, водню Н, кисню О, сірки S, азоту N, золи А і вологи W у відсотках на 1 кг палива. Залежно від того, яка маса палива береться в розрахунок, кожному числу привласнюється відповідний надрядковий індекс:
горюча 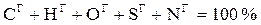 ;
;
суха  ;
;
робоча 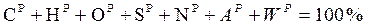 .
.
Елементарний склад палива з однієї маси на іншу перераховують згідно з формулами табл. 2.3.
Таблиця 2.3
Коефіцієнти перерахунку мас палива

Перерахунок елементарного складу палива з однієї вологості (зольності) на іншу ведеться за формулами, %:
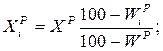
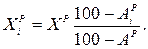
За відсутності табличних даних теплоту згоряння палив необхідно визначати в калориметричних бомбах. Для орієнтовних розрахунків нижча теплота згоряння твердих або рідких палив може бути розрахована по формулі Менделєєва, ккал/кг:
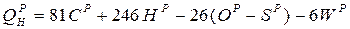 ,
,
або кДж/кг:
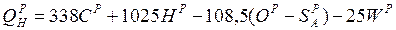 .
.
Вища і нижча теплоти згоряння робочої маси зв'язані виразом:
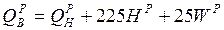 .
.
Для порівняння теплової цінності різних видів палива використовують умовне паливо, яке має теплоту згоряння, рівну 29300 кДж/кг. Витрату натурального палива на умовне перераховують за формулою Ву = В×Е,
де Bу і В ‑ витрата відповідно умовного і натурального палива, кг/с;
Е ‑ тепловий еквівалент палива. 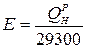 .
.
Мінімальна (теоретична) кількість повітря, необхідна для повного спалювання 1 кг твердого або рідкого палива при α = 1,0 м3/кг:
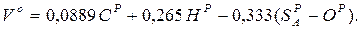
Дійсна кількість повітря визначається добутком коефіцієнта надлишку повітря і теоретичної кількості повітря, м3/кг:
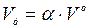 .
.
Об'єм продуктів згоряння, що утворилися при спалюванні 1 кг палива в теоретично необхідній кількості повітря

де об'єми продуктів згоряння кожного компоненту відповідно будуть:
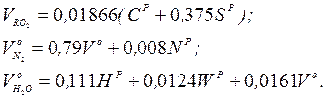
Об'єм продуктів згоряння при спалюванні 1 кг палива і дійсній кількості повітря, м3/кг:
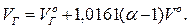
Ентальпія продуктів згоряння IГ (кДж/кг), (кДж/м3) при α=1 визначається як сума добутків об'єму елементарних продуктів згоряння, їх питомої теплоємності С, температури θ, ентальпії надмірного повітря 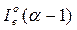 і золи IЗ:
і золи IЗ:
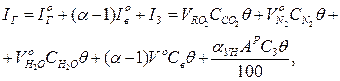
де 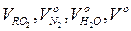 ‑ теоретичні об'єми продуктів згоряння палива і повітря, м3/кг, м3/м3; αун – частка золи, що виноситься газами; СЗ – питома теплоємність золи, кДж/(кг·К).
‑ теоретичні об'єми продуктів згоряння палива і повітря, м3/кг, м3/м3; αун – частка золи, що виноситься газами; СЗ – питома теплоємність золи, кДж/(кг·К).
Елементарний склад газоподібних палив звичайно приводиться як процентний вміст окремих газів: оксиду вуглецю СО, водню Н2, метану СН4, етану С2Н6, кисню О2, азоту N2 та інших.
Теплота згоряння газоподібних палив підраховується як сума добутків теплоти згоряння окремих компонентів і їх вмісту в 1 м3 газоподібного палива, МДж/м3:
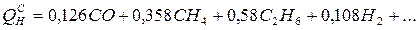
Мінімальний (теоретичний) об'єм повітря, необхідний для спалювання 1 м3 газоподібного палива, м3/м3:
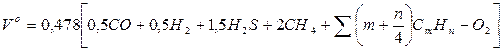 .
.
Теоретичний об'єм азоту:
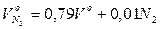 .
.
Об'єм трьохатомних газів:
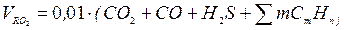 .
.
Об'єм сухих газів:
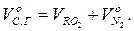
Теоретичний об'єм водяної пари:
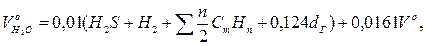
де dГ – вологовміст газоподібного палива, віднесений до 1 м3 сухого газу, г/м3.
Дійсний об'єм продуктів згоряння при α >1, м3/м3:
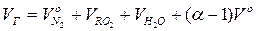 .
.
(При спалювання сланців об'єми продуктів згоряння обчислюються з поправкою на розкладання карбонатів К).
Розрахунковий зміст золи з урахуванням карбонатів, що розклалися, %:
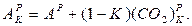
Об'єм вуглекислоти, м3/кг;
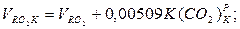 |
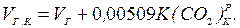 Об'єм газів, м3/кг:
Об'єм газів, м3/кг:
При спалюванні суміші палив об'єми і ентальпії продуктів згоряння пропонується розраховувати для кожного палива окремо на 1 кг твердого або рідкого і на 1 м3 газоподібного палива.
По отриманих для кожного палива значень Vo, VRO2, VN2 визначаються об'єми повітря і продуктів згоряння суміші, м3/кг. Для суміші двох однорідних палив (твердих, рідких або газоподібних):

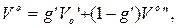
де g' – масова частка першого палива в суміші.
По аналогічних формулах визначають  суміші. Розрахунок ведеться на 1 кг твердого або рідкого палива. Для суміші твердого або рідкого палива з газоподібним паливом заздалегідь визначається кількість газу Х, що приходиться на 1 кг палива.
суміші. Розрахунок ведеться на 1 кг твердого або рідкого палива. Для суміші твердого або рідкого палива з газоподібним паливом заздалегідь визначається кількість газу Х, що приходиться на 1 кг палива.
Об'єм повітря, м3/кг:
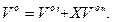
Аналогічно розраховують об'єми вуглекислоти, азоту, водяної пари.
Питома теплоємність продуктів згоряння (середня), кДж/(м3·К):
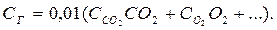
Теоретична температура горіння:
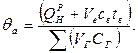
Коефіцієнт надлишку повітря за даними газового аналізу продуктів згоряння визначають по наступних формулах:
- при повному згорянні палива, коли в продуктах згоряння відсутні продукти неповного горіння
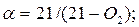
- при вмісті в продуктах згоряння горючих компонентів спочатку визначають надмірний вміст кисню, %:
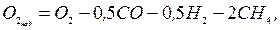
а потім по формулі 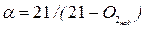 – коефіцієнт надлишку повітря.
– коефіцієнт надлишку повітря.
Приклад 13. Визначте кількість повітря, теоретично необхідну для спалювання 1 кг палива наступного складу, %: CP=37,2; HP=2,6; SP=0,6; NP=0,4; OP=12; WP=40; AP=7,2, а також об'єм продуктів згоряння при коефіцієнті надлишку повітря α=1,2.
Рішення. Визначаємо теоретично необхідну кількість повітря:
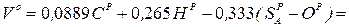
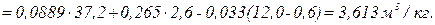
Визначаємо об'єм продуктів згоряння, м3/кг:
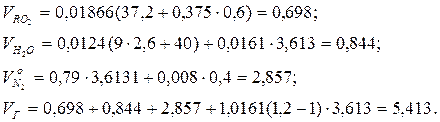
Приклад 14. Визначте нижчу і вищу теплоти згоряння робочої маси вугілля марки Д, якщо склад його горючої маси, %: CГ=78,5; HГ=5,6; 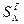 =0,4; NГ=2,5; OГ=13. Зольність сухої маси AС=15,0 % і вологість WP=12,0 %.
=0,4; NГ=2,5; OГ=13. Зольність сухої маси AС=15,0 % і вологість WP=12,0 %.
Рішення. Користуючись коефіцієнтами перерахунку з табл. 2.3, визначаємо зольність робочої маси палива Ар і склад робочої маси, %:
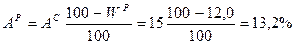
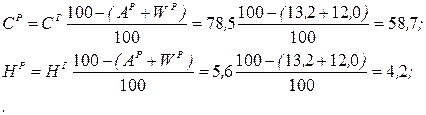
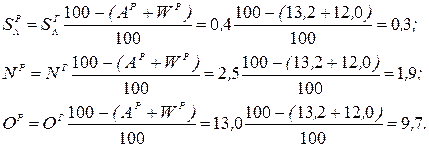
Нижча теплота згоряння робочої маси палива:
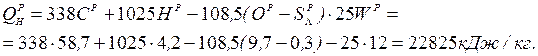
Вища теплота згоряння:
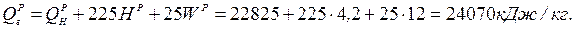
Ж. Вторинніенергоресурси
Використання теплоти відхідних газів для отримання гарячої води і пари
Відхідні котельні гази використовують у водяних утилізаторах (економайзерах) і в котлах-утилізаторах для отримання гарячої води і пари.
Витрата відхідних газів з котельні, м3/с:
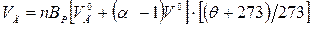
де n ‑ кількість котлоагрегатів; BP ‑ розрахункова витрата палива, кг/с; 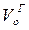 і
і 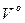 ‑ теоретично необхідний об'єм відповідно газів і повітря, м3/кг (м3/м3); αУ – коефіцієнт надлишку повітря за утилізатором; θ – температура газів на вході в утилізатор, oC.
‑ теоретично необхідний об'єм відповідно газів і повітря, м3/кг (м3/м3); αУ – коефіцієнт надлишку повітря за утилізатором; θ – температура газів на вході в утилізатор, oC.
Кількість теплоти, що віддається відхідними котельними газами утилізатору, кДж/с:
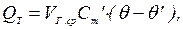
де 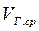 ‑ середня витрата відхідних газів при їх охолоджуванні в утилізаторі від θ до θ', м3/с;
‑ середня витрата відхідних газів при їх охолоджуванні в утилізаторі від θ до θ', м3/с;
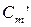 ‑ середня об'ємна теплоємність газів, кДж/(м3·К);
‑ середня об'ємна теплоємність газів, кДж/(м3·К);
θ' ‑ температура газів на виході з утилізатора, oC.
Використання теплоти пічних відхідних газів для отримання пари
Кількість виробленої теплоти у вигляді пари в утилізаторі за рахунок теплоти відхідних газів, кДж/с:
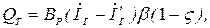
де Іг, Іг ¢ ‑ ентальпія газів на виході відповідно з печі і з утилізатора, кДж/кг (кДж/м3); β ‑ коефіцієнт, що враховує невідповідність режиму і кількості годин роботи утилізатора і агрегату ‑ джерела вторинних енергоресурсів; 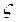 ‑ коефіцієнт втрат теплоти утилізатора в навколишнє середовище.
‑ коефіцієнт втрат теплоти утилізатора в навколишнє середовище.
Економія умовного палива за рахунок вторинних ресурсів, кг/с:
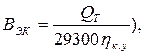
де 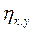 ‑ ККД котельні, що заміщається.
‑ ККД котельні, що заміщається.
Приклад 15. Визначити економію умовного палива при використанні виробленої теплоти у вигляді пари в котлі-утилізаторі за рахунок теплоти відхідних газів двох печей, якщо температура газів на виході з печей θ = 700оС, на виході з котла-утилізатора θ' = 200оС, коефіцієнт надлишку повітря за котлом-утилізатором αУ =1,35. Розрахункова витрата палива двох печей BP =0,036 м3/с, коефіцієнт, що враховує невідповідність режиму і числа годин роботи котла-утилізатора і печей β= 1,0; коефіцієнт втрат теплоти котла-утилізатора в навколишнє середовище V =0,12 і ККД котельні, що заміщається, 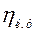 =0,86. Печі працюють на природному газі Шебелінського родовища складу, %: СН4 = 94,1; С2Н6 = 3,1; С3Н8 = 0,6; С4Н10 = 0,2; С5Н12 = 0,8; N2 = 1,2.
=0,86. Печі працюють на природному газі Шебелінського родовища складу, %: СН4 = 94,1; С2Н6 = 3,1; С3Н8 = 0,6; С4Н10 = 0,2; С5Н12 = 0,8; N2 = 1,2.
Рішення. Теоретично необхідний об'єм повітря
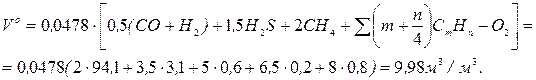
Об'єм трьохатомних газів
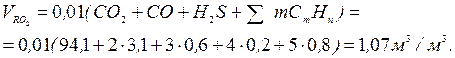
Теоретичний об'єм азоту
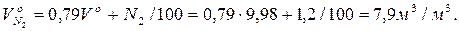
Теоретичний об'єм водяних газів
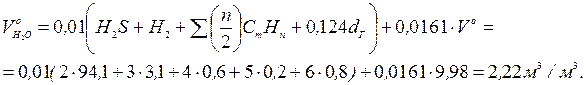
Ентальпія газів на виході з печей
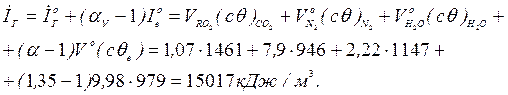
Ентальпія газу на виході з котла-утилізатора
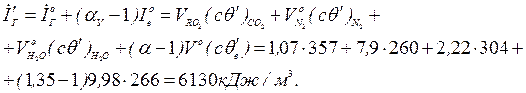
(значення питомих ентальпій газів і золи беруться з додатку).
Кількість виробленої теплоти у вигляді пари в котлі-утилізаторі за рахунок теплоти відхідних газів
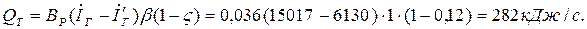
Економія умовного палива при використанні виробленої теплоти у вигляді пари в котлі-утилізаторі за рахунок теплоти відхідних газів
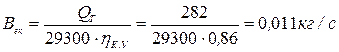 ,
,
або 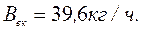
Date: 2015-06-11; view: 478; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |