
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

И водоподготовке
Применение метода ионного обмена в очистке сточных вод
Теоретические сведения
Ионный обмен – это процесс извлечения из воды одних ионов и замена их другими.
В технологии очистки сточных вод методы ионного обмена применяют для извлечения ионов токсичных и радиоактивных металлов (Cu2+, Hg2+, Cd2+, Pb2+, 137Cs+, 90Sr2+), ионов, содержащих мышьяк, хром, фосфор и др.(AsO43-, CrO42-,), а также для утилизации ряда ценных химических веществ.
В водоподготовке метод ионный обмена обычно используют для умягчения воды и обессоливания.
Вещества, проявляющие способность к ионному обмену, получили название иониты. Обычно иониты имеют структуру в виде положительно или отрицательно заряженного каркаса. Этот заряд скомпенсирован подвижными противоионами. Именно противоионы участвуют в ионном обмене.
Иониты классифицируют по происхождению на природные и синтетические, по составу - на неорганические и органические, по знаку заряда обменивающихся ионов – на катиониты, аниониты и амфолиты (последние в зависимости от условий могут обмениваться как катионами, так и анионами). К природным неорганическим ионитам относят цеолиты, глинистые минералы. Их каркас представляет правильную сетчатую структуру алюмосиликата, в полостях которой располагаются ионы щелочных или щелочноземельных металлов, являющихся противоионами. К органическим природным ионитам относят гуминовые кислоты почв и углей.
Синтетическими неорганическими ионитами являются силикагели, алюмосиликаты, оксиды и гидроксиды алюминия, хрома, циркония и др., а органическими – ионообменные смолы.
Наибольшее распространение в области водоочистки получили ионообменные смолы – высокомолекулярные соединения, радикалы которых образуют пространственную сетку (каркас) с фиксированными на ней ионообменными функциональными группами (чаще SO3H+, OH-).
В общем виде реакции ионного обмена можно представить в виде:
1. при контакте с катионитом: 2RSO3H- + MgCl2 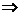 (RSO3)2Mg +2HCl;
(RSO3)2Mg +2HCl;
2. при контакте с анионитом: ROH +NaCl  RCl + NaOH.
RCl + NaOH.
В воде иониты не растворяются, но набухают, причем размеры их пор увеличиваются от 0,5 – 1,0 нм до 4,0 нм, а объем ионита возрастает в 1,5 – 3 раза. Набухание связано с поглощением молекул воды и влияет на селективность (избирательность) ионита, так как при малом размере его пор крупные ионы не могут достичь внутренних функциональных групп.
Наиболее широкое использование в водоочистке находят следующие марки катионитов: КУ–1, КУ - 2; и анионитов АВ – 17, АН – обменная емкость которых составляет 4 – 10 мг-экв/г.
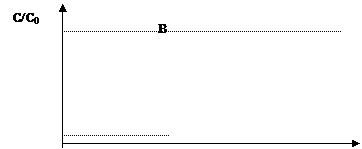
Процесс ионообменной очистки сточных и природных вод осуществляется в основном на установках периодического действия, работающих в динамическом режиме. Основной характеристикой ионита при этом является его динамическая емкость до проскока или до величины ПДК извлекаемого иона в фильтрате, которая определяется по выходной кривой ионного обмена – зависимости концентрации извлекаемого иона в фильтрате от объема пропущенной с определенной скоростью (мл/мин) сточной воды (рис.1).
Площадь АОВD характеризует динамическую емкость ионита до проскока, площадь OADF – полную ионообменную емкость.
 |

|

 | |||||
| |||||
| |||||
Рис. 1. Выходная кривая ионного обмена
После насыщения, то есть полного исчерпания ионообменной емкости, ионит подвергают регенерации. Для катионитов в качестве регенерирующего агента используют растворы кислот или 30 % раствор хлорида натрия, для анионитов – растворы щелочей.
Метод ионного обмена широко используется для умягчения природных вод. Природная вода содержит растворенные органические и неорганические вещества. Наличие растворенных и взвешенных веществ ограничивает возможность применения воды для бытовых и технологических целей.
Содержание в воде ионов кальция и магния обуславливает жесткость природных вод. Общая жесткость характеризуется суммой концентраций ионов кальция и магния, выраженной в мг–экв/дм3. По величине общей жесткости природные воды делятся на:
- очень мягкие – менее 1,5 мг-экв/л;
- мягкие – 1,5 – 3,0 мг-экв/л;
- средней жесткости – 3,0 – 5,4 мг-экв/л;
- жесткие – 5,4 – 10,7 мг-экв/л;
- очень жесткие – более 10,7мг-экв/л.
В воде ионы Ca2+ и Mg2+ связаны с ионами HCO3-, SO42-, Cl- и др. Жесткость воды, обусловленную содержанием гидрокарбонатов кальция и магния, называют карбонатной или временной жесткостью. При нагревании воды соли временной жесткости разлагаются с выделением менее растворимых карбонатов магния и кальция:
Ca(HCO3)2 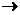 CaCO3 + CO2 + H2O
CaCO3 + CO2 + H2O 
Некарбонатная жесткость (постоянная) обусловлена присутствием в воде сульфатов (растворимость CaSO4 - 2 г/л), хлоридов, гидроксидов кальция и магния.
Date: 2015-07-17; view: 342; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |