
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Обмен и биологическое значение холестерина
Переваривание и всасывание
Холестерин в организме человека бывает 2 видов: 1) холестерин, поступающий с пищей через ЖКТ и называемый экзогенный и 2) холестерин, синтезируемый из Ац – КоА - эндогенный.
С пищей ежедневно поступает  0,2 – 0,5 г, синтезируется
0,2 – 0,5 г, синтезируется  1 г (почти все клетки за исключением эритроцитов синтезируют холестерин, 80% холестерина синтезируется в печени.
1 г (почти все клетки за исключением эритроцитов синтезируют холестерин, 80% холестерина синтезируется в печени.
Взаимоотношения экзо и эндогенного холестерина в определенной степени конкурентны – холестерин пищи ингибирует его синтез в печени.
Фонд холестерина, обнаруживаемого в ЖКТ состоит из 3-х частей: пищевого холестерина слизистой кишечника – может быть до 20% и холестерина желчи (холестерин желчи составляет в среднем 2,5 – 3,0г)
Всасывание холестерина происходит в основном в тощей кишке (пищевой холестерин всасывается почти полностью – если в пище его не очень много), холестерин желчи всасывается примерно на 50% - остальное экскретируется.
Всасывание холестерина осуществляется только после эмульгирования эфиров холестерина. Эмульгаторами являются желчные кислоты, моно- и диглицериды и лизолецитины. Холестеридыгидролизуютсяхолестеринэстеразой поджелудочной железы.
Пищевой и эндогенный холестерин находится в просвете кишечника в неэстерифицированной форме в составе сложных мицелл (желчные, жирные кислоты, лизолецитин), причем поступают в состав слизистой кишечника не вся мицелла целиком, а ее отдельные фракции. Сорбцил холестерина из мицелл – пассивный процесс, идущий по градиенту концентрации. Поступивший в клетки слизистой холестерин этерифицируетсяхолестеринэстеразой или АХАТ (у человека это в основном олеиновая кислота). Из клеток слизистой кишечника холестерин поступает в лимфу в составе АОНП и ХМ, из них он переходит в ЛНП и ЛВП. В лимфе и крови 60-80% всего холестерина находится в этерифицированном виде.
Процесс всасывания холестерина из кишечника зависит от состава пищи: жиры и углеводы способствуют его всасыванию, растительные стероиды (структурные аналоги) блокируют этот процесс. Большое значение принадлежит желчным кислотам (все функции активируют – улучшают эмульгирование, всасывание). Отсюда значение лекарственных веществ, блокирующих всасывание желчных кислот.
Резкое повышение холестерина в пище (до 1,5 г ежедневно) может сопровождаться некоторой гиперхолестеринемией у здоровых людей.
Биосинтез холестерина
Клетки печени синтезируют  80% всего холестерина, примерно 10% холестерина синтезируется в слизистой кишечника. Холестерин синтезируется не только для себя, но и на «экспорт».
80% всего холестерина, примерно 10% холестерина синтезируется в слизистой кишечника. Холестерин синтезируется не только для себя, но и на «экспорт».
Митохондрии являются держателем субстрата для синтеза холестерина. Ацетил-КоА выходит в виде цитрата и ацетоацета.
Синтез холестерина идет в цитоплазме и включает 4 стадии.
1 стадия – образование мевалоновой кислоты:
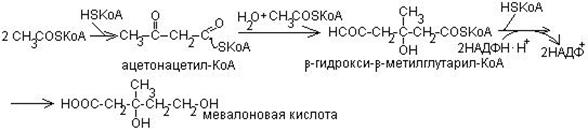
2 стадия – образование сквалена (30 атом С)
Эта стадия (как и 1) начинается в водной фазе клетки, а заканчивается в мембране эндоплазматического ретикулума образованием водо-нерастворимого сквалена.
Затрачивается 6 молей мевалоновой кислоты, 18 АТФ, НАДФ НН с образованием цепочечной структуры из 30 С – сквалена.
3 стадия – циклизация сквалена в ланостерин.
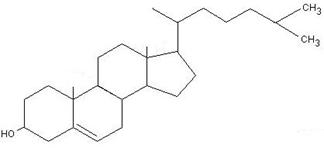 4 стадия – превращение ланостерина в холестерин.
4 стадия – превращение ланостерина в холестерин.
Холестерин – циклический ненасыщенный спирт. Содержит ядро циклопентан-пергидрофенантрена.
Регуляция биосинтеза холестерина
При высоком содержании холестерина, он угнетает активность фермента 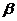 -гидрокси-
-гидрокси- 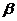 -метилурацил-КоА-редуктазы и синтез холестерина тормозится на стадии образования мевалоновой кислоты – это первая специфическая стадия синтеза.
-метилурацил-КоА-редуктазы и синтез холестерина тормозится на стадии образования мевалоновой кислоты – это первая специфическая стадия синтеза. 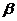 -гидрокси-
-гидрокси- 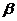 -метилурацил-КоА, не пошедший на синтез холестерина может пойти на синтез кетоновых тел. Это регуляция по типу обраьной отрицательной связи.
-метилурацил-КоА, не пошедший на синтез холестерина может пойти на синтез кетоновых тел. Это регуляция по типу обраьной отрицательной связи.
Транспорт холестерина
В плазме крови здоровых людей содержится 0,8 – 1,5 г/л ЛОНП, 3,2 – 4,5 г/л ЛНП и 1,3 – 4,2 г/л ЛВП.
Липидный компонент практически всех ЛП представлен наружной оболочкой, которая образована монослоем ФЛ и холестерина и внутренним гидрофобным ядром, состоящим из ТГ и холестеридов. Кроме липидов ЛП содержат белок – аполипопротеиды А, В или С. Свободный холестерин, находящийся на поверхности ЛП, легко обменивается между частицами: меченый холестерин, введенный в плазму в составе одной группы ЛП, быстро распределяется между всеми группами.
ХМ формируются в эпителиальных клетках кишечника, ЛОНП и ЛВП независимо друг от друга образуются в гепатоцитах.
ЛП обмениваются своим холестерином с мембранами клеток, особенно интенсивный обмен идет между ЛП и гепатоцитами, на поверхности которых есть рецепторы для ЛПНП. Процесс переноса холестерина в гепатоциты требует энергии.
  Холестерин Холестерин
| ||||
| Экзогенный | Эндогенный | |||
 Холестерин Холестерин
  ЖКТ ЖКТ
| Пищевой | |||
| Холестерин слизистой кишечника | ||||
| Холестерин желчи | ||||
Судьба холестерина в клетке
1. Связывание ЛНП с рецепторами фибробластов, гепатоцитов и др. клеток. На поверхности 1 фибробласта содержится 7500 – 15000 рецепторов, чувствительных к холестерину. Рецепторы для ЛНП содержат эндотелиальные клетки, клетки надпочечников, яйцеклетки, разнообразные раковые клетки. Связывая ЛНП, клетки поддерживают определенный уровень этих ЛП в крови. У всех обследованных здоровых людей интернализация ЛНП неизбежно сопровождается и связыванием с рецепторами клеток. Связывание и интернализация ЛНП обеспечивается одним и тем же белком, входящим в состав рецепторов ЛНП. В фибробластах больных с семейнойгиперхолестеринемией, дефицитных по рецепторам ЛНП интернализация их редко угнетается.
- ЛНП с рецептором подвергается эндоцитозу и включается в лизосомы. Там ЛНП (аполипопротеиды, холестериды) распадаются. Хлороквин – ингибитор лизосомального гидролиза подавляет эти процессы.
- Появление в клетках свободного холестерина ингибирует ОМГ-КоА-редуктазу снижает эндогенный синтез холестерина. При концентрации ЛНП > 50 мкг/мл синтез холестерина в фибробластах подавляется полностью. Инкубация лимфоцитов 2-3 мин с сывороткой, освобожденной от ЛНП, увеличивает скорость синтеза холестерина в 5-15 раз. При добавлении ЛНП к лимфоцитам синтез холестерина замедляется. У больных с гомозиготной семейной гиперхолестеринемией снижения синтеза холестерина в клетках не происходит.
- В клетках, способных превращать холестерин в другие стероиды ЛНП стимулирует синтез этих стероидов. Например, в клетках коры надпочечников 75% прегненалона образуется из холестерина, поступающего в составе ЛНП.
- Свободный холестерин увеличивает активность ацетил-КоА-холестерилацилтрансферазы (АХАТ), приводя к ускореннойреэтерификации холестерина с образованием в основном олеата. Последний иногда накапливается в клетках в виде включений. Вероятно биологический смысл этого процесса заключается в борьбе с накоплением свободного холестерина.
- Свободный холестерин снижает биосинтез рецептора ЛНП, который тормозит захват ЛНП клеткой и тем самым защищает ее от перегрузки холестерином.
- Накопленный холестерин проникает в фосфолипидный бислой цитоплазматической мембраны.Из мембраны холестерин может перейти в ЛВП, циркулирующие с кровью.
Превращение холестерина в организме
То внимание, которое ранее уделяли метаболизму холестерина при обсуждении его роли в организме явно преувеличено. На первое место в настоящее время выдвинута структурная роль холестерина в биомембранах.
  Внеклеточная среда (кровь) Внеклеточная среда (кровь)
|   Плазматическая мембрана Плазматическая мембрана
| Клетка |
| Транспортная форма холестерина | Структурный холестерин | Метаболически активный холестерин |
| ЛП-холестерин в основном эфиры холестерина. Холестерин эритроцитарной мембраны – свободный | Неэстерифицированный холестерин | ЛП – холестерин (эстерифицированный холестерин) |
Внутриклеточно переносится в основном свободный холестерин. Эфиры холестерина внутриклеточно переносятся с очень низкой скоростью только с помощью специальных белков переносчиков или вообще не переносятся.
Эстерификация холестерина
Повышает неполярность молекулы. Этот процесс происходит как вне так и внутриклеточно, он всегда направлен на то, чтобы убрать молекулы холестерина с границы раздела липид / вода вглубь липопротеидной частицы. Таким путем происходит транспортирование или активация холестерина.
Внеклеточнаяэстерификация холестерина катализируется ферментом лецитинхолестеринацетилтрансферазой (ЛХАТ).
Лецитин + холестерин 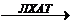 лизолецин + холестерид
лизолецин + холестерид
В основном переносится линолевая кислота. Ферментативная активность ЛХАТ связана преимущественно с ЛВП. Активатором ЛХАТ является апо-А-I. Образующийся в результате реакции эфир холестерина погружается внутрь ЛВП. При этом концентрация свободного холестерина на поверхности ЛВП снижается и таким образом поверхность подготавливается для поступления новой порции свободного холестерина, который ЛВП способен снимать с поверхности плазматической мембраны клеток в том числе и эритроцитов. Таким образом ЛВП совместно с ЛХАТ функционирует как своеобразная «ловушка» холестерина.
Из ЛВП эфиры холестерина переносятся в ЛОНП, а из последних в ЛНП. ЛНП синтезируются в печени и там же катаболизируют. ЛВП приносят холестерин в виде эфиров в печень, а из печени удаляются в виде желчных кислот. У больных с наследственным дефектом ЛХАТ в плазме много свободного холестерина. У больных с поражением печени, как правило, наблюдается низкая активность ЛХАТ и высокий уровень свободного холестерина в плазме крови.
Таким образом, ЛВП и ЛХАТ представляют собой единую систему транспорта холестерина от плазматических мембран клеток различных органов в виде его эфиров в печень.
Внутриклеточно холестерин эстерифицируется в реакции катализируемой ацил-КоА-холестеринацетилтрансферазой (АХАТ).
Ацил-КоА + холестерин 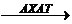 холестрид + HSKoA
холестрид + HSKoA
Обогащение мембран холестерином активирует АХАТ.
В результате этого ускорение поступления или синтеза холестерина сопровождается ускорением его эстерификации. У человека в эстерификации холестерина чаще всего участвует линолевая кислота.
Эстерификацию холестерина в клетке следует рассматривать как реакция сопровождающуюся накоплением в ней стероида. В печени эфиры холестерина после гидролиза используются для синтеза желчных кислот, а в надпочечниках – стероидных гормонов.
Т.о. ЛХАТ разгружает от холестерина плазматические мембраны, а АХАТ – внутриклеточные. Эти ферменты не удаляют холестерин из клеток организма, а переводят его из одной формы в другую, поэтому роль ферментов эстерификации и гидролиза эфиров холестерина в развитии патологических процессов не следует преувеличивать.
Окисление холестерина.
Единственным процессом, необратимо удаляющим холестерин из мембран и ЛП является окисление. Оксигеназные системы обнаружены в гепатоцитах и клетках органов, синтезирующих стероидные гормоны (кора надпочечников, семенники, яичники, плацента).
Существуют 2 пути окислительного превращения холестерина в организме: один из них приводит к образованию желчных кислот, а другой к биосинтезу стероидных гормонов.
На образование желчных кислот расходуется 60-80% всего ежедневно образующегося холестерина, к то время как на стероидогенез – 2-4%.
Окислительное превращение холестерина в обеих реакциях протекает по многоступенчатому пути и осуществляется ферментной системой, содержащей различные изоформыцитохрома Р450. Характерной чертой окислительных превращений холестерина в организме является то, что его циклопентанпергидрофенантреновое кольцо не расщепляется и выводится из организма в неизменном виде. В противоположность этому боковая цепь легко отщепляется и метаболизирует.
Окисление холестерина в желчные кислоты служит основным путем выведения этой гидрофобной молекулы. Реакция окисления холестерина является частным случаем окисления гидрофобных соединений, т.е. процесса лежащего в основе детоксифицирующей функции печени.
Неполярная молекула в пространстве
мембраны
окисление в монооксидазных системах печени и других органов

 Полярная молекула в водном пространстве
Полярная молекула в водном пространстве
 клетки
клетки
 Этерификация конъюгация связанные белки
Этерификация конъюгация связанные белки
Экскреторные органы
Моноокисдазная система.
Содержит цитохром Р450 способный активировать молекулярный кислород (при участии НАДФН) и использует один из его атомов для окисления органических веществ, а второй для образования воды.
С27Н45ОН + НАДФН + Н+ + О2 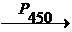 С27Н44(ОН)2 + НАДФ + Н2О
С27Н44(ОН)2 + НАДФ + Н2О
Лимитирующим является первый этап реакции (гидроксилирования в положении 7).
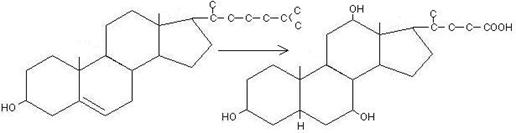
В печени из холестерина синтезируются первичные желчные кислоты (путь окисления холестерина). В просвете кишечника из них образуются вторичные желчные кислоты (под влиянием ферментативных систем микроорганизмов).
Первичными желчными кислотами являются холевая и дезоксихолевая. Здесь же они эстерифицируются глицином или таурином, превращаются в соответствующие соли и в таком виде секретируются в желчь.
Вторичные желчные кислоты возвращаются в печень. Этот цикл называется энтерогепатической циркуляцией желчных кислот обычно каждая молекула совершает в сутки 8-10 оборотов.
Уменьшение поступления желчных кислот в печень в результате дренирования желчного кровотока или применения ионообменных смол стимулирует биосинтез желчных кислот и 7  - гидроксилазу. Введение в диету желчных кислот, наоборот, угнетает желчегенез и ингибирует активность фермента.
- гидроксилазу. Введение в диету желчных кислот, наоборот, угнетает желчегенез и ингибирует активность фермента.
Под действием холестериновой диеты желчегенез у собак увеличивается в 3 – 5 раз, у кроликов и морских свинок такого увеличения не наблюдается. У больных атеросклерозом отмечено снижение скорости окисления холестерина печени. Вероятно это снижение является патологическим звеном развития атеросклероза.
Другой путь окисления холестерина приводит к образованию стероидных гормонов несмотря на то, что в количественном отношении он составляет всего несколько процентов обменивающегося холестерина. Это очень важный путь его использования. Холестерин является основным предшественником всех стероидных гормонов в надпочечниках, яичниках, семенниках и плаценте. Цепь биосинтеза включает множество гидроксилазных реакций, катализируемых изоформамицитохрома Р450. Скорость процесса лимитируется его первой реакцией расщепления боковой цепи. Несмотря на, небольшой количественный вклад стероидогенеза в валовое окисление холестерина угнетение этого процесса в пожилом возрасте длящемся долгие годы может постепенно приводить к накоплению холестерина в организме и развитию атеросклероза.
В коже из дегидрированного холестерина под действием УФ-лучей образуется витамин D3, затем он транспортируется в печень.
В неизменном виде холестерин секретируется желчью. В желчи его содержание доходит до 4 г/л. Холестерин желчи это 1/3 холестерина кала, 2/3 его составляет не всосавшийся холестерин пищи.
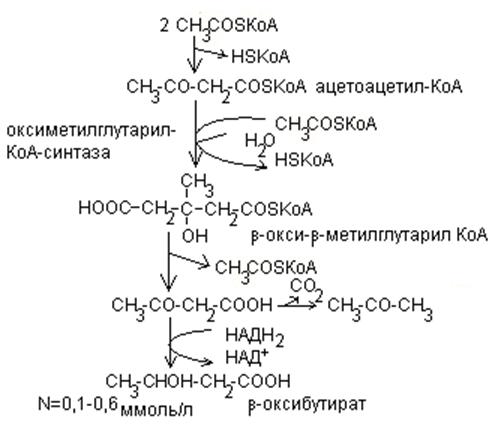
Метаболизм кетоновых тел.
Ацетил-КоА, образовавшийся при окислении жирных кислот, сгорает в цикле Кребса или используется для синтеза кетоновых тел. К кетоновым телам относятся: ацетоацетат, 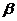 -окусибутират, ацетон.
-окусибутират, ацетон.
Кетоновые тела синтезируются в печени из ацетил-КоА.
Холестерин в патологии.
I. Холестериноз – изменения содержания холестерина в организме.
1. Не осложненныйхолестериноз – (физиологическое старение, старость, естественная смерть) проявляется накоплением холестерина в плазматических мембранах клеток в связи с уменьшением синтеза стероидных гормонов (стероидогенеза).
2. Осложненный – атеросклероз в форме ишемической болезни сердца (инфаркт миокарда), ишемия мозга (инсульт, тромбоз), ишемия конечностей, ишемии органов и тканей, связанный с уменьшением желчегенеза.
II. Изменения содержания холестерина в плазме крови.
1. Семейнаягиперхолестеринэмия – обусловлена дефектом рецепторов для ЛНП. В результате холестерин не поступает в клетки и накапливается в крови. Рецепторы по химической природе являются белками. В результате развивается ранний атеросклероз.
III. Накопление холестерина в отдельных органах и тканях.
Болезнь Вольмана – первичный семейный ксантоматоз – накопление эфиров холестерина и триглицеридов во всех органах и тканях, причина дефицит лизосомальнойхолестеринэстеразы. Ранняя смерть.
Семейная гиперхолестенинэмия или  -липопротеинэмия. Нарушается поглощение ЛНП клетками, повышается концентрация ЛНП, а также холестерина. При
-липопротеинэмия. Нарушается поглощение ЛНП клетками, повышается концентрация ЛНП, а также холестерина. При  -липопротеинэмии наблюдается отложение холестерина в тканях, в частности в коже (ксантомы) и в стенках артерий. Отложение холестерина в стенках артерий главное биохимическое проявление атеросклероза. Вероятность заболевания атеросклерозом тем выше, чем больше отношение концентраций ЛНП и ЛВП в крови (ЛНП снабжает клетки холестерином, ЛВП удаляет из них избыток холестерина). Холестерин образует в стенках сосудов бляшки. Бляшки могут изъязвляться и язвы зарастают соединительной тканью (образуется рубец), в которую откладываются соли кальция. Стенки сосудов деформируются, становятся жесткими, нарушается моторика сосудов, суживается просвет вплоть до закупорки.
-липопротеинэмии наблюдается отложение холестерина в тканях, в частности в коже (ксантомы) и в стенках артерий. Отложение холестерина в стенках артерий главное биохимическое проявление атеросклероза. Вероятность заболевания атеросклерозом тем выше, чем больше отношение концентраций ЛНП и ЛВП в крови (ЛНП снабжает клетки холестерином, ЛВП удаляет из них избыток холестерина). Холестерин образует в стенках сосудов бляшки. Бляшки могут изъязвляться и язвы зарастают соединительной тканью (образуется рубец), в которую откладываются соли кальция. Стенки сосудов деформируются, становятся жесткими, нарушается моторика сосудов, суживается просвет вплоть до закупорки.
Гиперхолестеринемия – главная причина отложения холестерина в артериях. Но важное значение имеют также первичные повреждения стенок сосудов. Повреждения эндотелия могут возникать в следствие гипертонии, воспалительных процессов.
В области повреждения эндотелия в стенку сосудов проникают компоненты крови, в том числе липопротеиды, которые поглощаются макрофагами. Мышечные клетки сосудов начинают размножаться и тоже фагоцитировать липопротеиды. Ферменты лизосом разрушают липопротеиды, кроме холестерина. Холестерин накапливается в клетке, клетка гибнет, а холестерин оказывается в межклеточном пространстве и инкапсулируется соединительной тканью – образуется атеросклеротическая бляшка.
Между отложением холестерина в артериях и липопротеидами крови происходит обмен, но при гиперхолестеринемии преобладает поток холестерина в стенки сосудов.
Методы профилактики и лечения атеросклероза направлены на уменьшение гиперхолестеринемии. Для этого применяют малохолестериновую диету, лекарства увеличивающие эксткрецию холестерина или ингибирующие его синтез, прямое удаление холестерина из крови методом гемодиффузии.
Холестирамин связывает желчные кислоты и исключает их из кишечно-печеночного кровобращения, что приводит к усилению окисления холестерина в желчные кислоты.
Date: 2015-07-17; view: 742; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |