
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Примеры решения задач
ЗАДАЧА 1.1.1 Найти молярную массу воздуха, считая, что он состоит по массе из одной части кислорода и трех частей азота.
Дано:mв = m 1 + 3 m 1.
Найти: 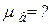
Решение
Воздух, являясь смесью идеальных газов, тоже представляет идеальный газ, и к нему можно применить уравнение Клапейрона -Менделеева
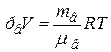 . (1)
. (1)
Для каждой компоненты смеси кислорода и азота запишем соответствующее уравнение:
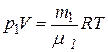 , (2)
, (2)
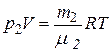 , (3)
, (3)
где р 1и р 2– парциальные давления кислорода и азота.
По закону Дальтона pв = p 1 + p 2. Складываем (2) и (3), получим
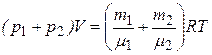 (4)
(4)
или на основании закона Дальтона
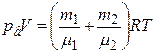 . (5)
. (5)
Сравнивая (1) и (5) и учитывая, что mв = m 1 + m 2, имеем
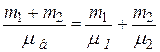 ,
,
откуда 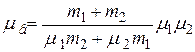 . (6)
. (6)
Подставляя в (6) m 2 = 3 m 1(по условию), найдем молярную массу воздуха
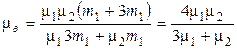 ,
,
где m1 = 32×10-3 кг/моль, m2 = 28×10-3 кг/моль. Подставляя значения, получим
m = 29×10-3 кг/моль.
ЗАДАЧА 1.1.2 В баллоне находится идеальный газ. Когда часть газа выпустили, температура газа в баллоне уменьшилась в 3 раза, а давление – в 4 раза. Какую часть газа выпустили?
Дано: 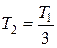 ;
; 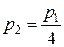 .
.
Найти: 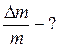
Решение
Для двух состояний уравнениеКлапейрона -Менделеева имеют вид:
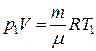 и
и 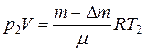 , где m – начальная масса газа,
, где m – начальная масса газа, 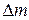 - выпущенная из баллона масса газа. Объём баллона V не изменялся. Решая эти их уравнения совместно, находим
- выпущенная из баллона масса газа. Объём баллона V не изменялся. Решая эти их уравнения совместно, находим 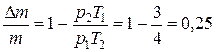 .
.
ЗАДАЧА 1.1.3 В сосуде емкостью 3,5 л находится смесь газов, в которую входит 2·1015 молекул кислорода, 5·1015 молекул азота и 6,6·10-7г аргона. Какова температура смеси, если давление в сосуде 1,74·10-4 мм рт. ст.?
Дано: V = 3,5 л =3,5·10 –3 м3 ; n1 = 2·1015; n2= 5·1015; m3 = 6,6·10-10 кг;
р= 1,74·10-4 мм рт. ст.=2,31·10-2Па; µ = 0,040 кг/моль.
Найти: Т -?
Решение
На основании закона Дальтона 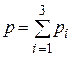 , где парциальное давление равно
, где парциальное давление равно 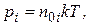 а число молекул можно определить как
а число молекул можно определить как 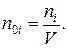
Для аргона число молекул 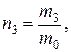 где
где 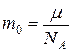 - масса одной молекулы аргона.
- масса одной молекулы аргона.
Тогда давление смеси газов будет равно 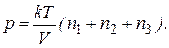
Отсюда искомая температура смеси 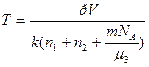 . Подставляя численные значения, получим Т = 346 К.
. Подставляя численные значения, получим Т = 346 К.
I.2 Задачи к теме «Основы молекулярно-кинетической теории»
1. Сколько атомов содержится в 1 г водорода?
2. Сколько атомов содержится в 1 г кислорода?
3. Сколько атомов содержится в 1 г азота?
4. Сколько атомов содержится в 1 г углекислого газа?
5. Сколько атомов содержится в 1 г гелия?
6. Сколько атомов содержится в 1 г воды?
7. Сколько молекул содержится в 1 г водорода?
8. Сколько молекул содержится в 1 г кислорода?
9. Сколько молекул содержится в 1 г азота?
10. Сколько молекул содержится в 1 г углекислого газа?
11. Сколько молекул содержится в 1 г гелия?
12. Сколько молекул содержится в 1 г воды?
13. Каков объем 1 г водорода при нормальных условиях
(p = 1 атм, t = 0°C)?
14. Каков объем 1 г кислорода при нормальных условиях (p = 1 атм,
t = 0°C)?
15. Каков объем 1 г азота при нормальных условиях (p = 1 атм, t = 0°C)?
16. Каков объем 1 г углекислого газа при нормальных условиях (p = 1 атм, t = 0°C)?
17. Каков объем 1 г гелия при нормальных условиях (p = 1 атм, t = 0°C)?
18. Каков объем 1 г водяного пара при нормальных условиях (p = 1 атм,
t = 0°C)?
19. Каков вес 1 л водорода при нормальных условиях (p = 1 атм, t = 0°C)?
20. Каков вес 1 л кислорода при нормальных условиях (p = 1 атм,
t = 0°C)?
21. Каков вес 1 л азота при нормальных условиях (p = 1 атм, t = 0°C)?
22. Каков вес 1 л углекислого газа при нормальных условиях (p = 1 атм,
t = 0°C)?
23. Каков вес 1 л гелия при нормальных условиях (p = 1 атм, t = 0°C)?
24. Каков вес 1 л водяного пара при нормальных условиях (p = 1 атм,
t = 0°C)?
25. Каков (в литрах) объем одного моля водорода при нормальных условиях (p = 1 атм, t = 0°C)?
26. Каков (в литрах) объем одного моля кислорода при нормальных условиях (p = 1 атм, t = 0°C)?
27. Каков (в литрах) объем одного моля азота при нормальных условиях (p = 1 атм, t = 0°C)?
28. Каков (в литрах) объем одного моля углекислого газа при нормальных условиях (p = 1 атм, t = 0°C)?
29. Каков (в литрах) объем одного моля гелия при нормальных условиях (p = 1 атм, t = 0°C)?
30. Каков (в литрах) объем одного моля водяного пара при нормальных условиях (p = 1 атм, t = 0°C)?
31. Какова температура 1 г водорода, если он занимает объем 1 л при нормальном давлении (p = 1 атм)?
32. Какова температура 1 г кислорода, если он занимает объем 1 л при нормальном давлении (p = 1 атм)?
33. Какова температура 1 г азота, если он занимает объем 1 л при нормальном давлении (p = 1 атм)?
34. Какова температура 1 г водяного пара, если он занимает объем 1 л при нормальном давлении (p = 1 атм)?
35. Какова температура 1 г гелия, если он занимает объем 1 л при нормальном давлении (p = 1 атм)?
36. Какова температура 1 г углекислого газа, если он занимает объем 1 л при нормальном давлении (p = 1 атм)?
37. Каково давление 1 г водорода, если он занимает объем 1 л при нормальной температуре (t = 0°C)?
38. Каково давление 1 г кислорода, если он занимает объем 1 л при нормальной температуре (t = 0°C)?
39. Каково давление 1 г азота, если он занимает объем 1 л при нормальной температуре (t = 0°C)?
40. Каково давление 1 г водяного пара, если он занимает объем 1 л при нормальной температуре (t = 0°С)?
41. Каково давление 1 г гелия, если он занимает объем 1 л при нормальной температуре (t = 0°С)?
42. Каково давление 1 г углекислого газа, если он занимает объем 1 л при нормальной температуре (t = 0°С)?
43. В запаянном баллоне находится водород. При температуре 25°C его давление – 2 атм. Каково будет давление при температуре 250°C?
44. В запаянном баллоне находится кислород. При температуре 25°C его давление – 2 атм. Каково будет давление при температуре 250°C?
45. В запаянном баллоне находится азот. При температуре 25°C его давление – 2 атм. Каково будет давление при температуре 250°C?
46. В запаянном баллоне находится углекислый газ. При температуре 25°C его давление – 2 атм. Каково будет давление при температуре 250°C?
47. В запаянном баллоне находится гелий. При температуре 25°C его давление – 2 атм. Каково будет давление при температуре 250°C?
48. В теплоизолированном (при исходной температуре 25°C) цилиндре объемом 4 л под поршнем площадью 20 см2 и массой 5 кг находится водород. На поршень поставили гирю массой 5 кг. Каков станет объем газа?
49. В теплоизолированном (при исходной температуре 25°C) цилиндре объемом 4 л под поршнем площадью 20 см2 и массой 5 кг находится кислород. На поршень поставили гирю массой 5 кг. Каков станет объем газа?
50. В теплоизолированном (при исходной температуре 25°C) цилиндре объемом 4 л под поршнем площадью 20 см2 и массой 5 кг находится азот. На поршень поставили гирю массой 5 кг. Каков станет объем газа?
51. В теплоизолированном (при исходной температуре 25°C) цилиндре объемом 4 л под поршнем площадью 20 см2 и массой 5 кг находится углекислый газ. На поршень поставили гирю массой 5 кг. Каков станет объем газа?
52. В теплоизолированном (при исходной температуре 25°C) цилиндре объемом 4 л под поршнем площадью 20 см2 и массой 5 кг находится гелий. На поршень поставили гирю массой 5 кг. Каков станет объем газа?
53. В теплоизолированном (при исходной температуре 25°C) цилиндре объемом 4 л под поршнем площадью 20 см2 и массой 5 кг находится водород. На поршень поставили гирю массой 5 кг. Какой после этого станет температура газа?
54. В теплоизолированном (при исходной температуре 25°C) цилиндре объемом 4 л под поршнем площадью 20 см2 и массой 5 кг находится кислород. На поршень поставили гирю массой 5 кг. Какой после этого станет температура газа?
55. В теплоизолированном (при исходной температуре 25°C) цилиндре объемом 4 л под поршнем площадью 20 см2 и массой 5 кг находится азот. На поршень поставили гирю массой 5 кг. Какой после этого станет температура газа?
56. В теплоизолированном (при исходной температуре 25°C) цилиндре объемом 4 л под поршнем площадью 20 см2 и массой 5 кг находится углекислый газ. На поршень поставили гирю массой 5 кг. Какой после этого станет температура газа?
57. В теплоизолированном (при исходной температуре 25°C) цилиндре объемом 4 л под поршнем площадью 20 см2 и массой 5 кг находится гелий. На поршень поставили гирю массой 5 кг. Какой после этого станет температура газа?
58. Объем пузырька воздуха по мере всплывания его со дна озера на поверхность увеличивается в 3 раза. Какова глубина озера?
59. Определить плотность смеси, состоящей из 4 г водорода и 32 г кислорода, при температуре 7°C и давлении 93 кПа.
60. Некоторый идеальный газ испытывает сначала изобарное расширение, а затем изотермическое сжатие. Изобразить эти процессы в координатах p, T и V, T.
61. Изобразите графически зависимость плотности 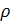 некоторой массы идеального газа от давления p при изотермическом процессе.
некоторой массы идеального газа от давления p при изотермическом процессе.
62. 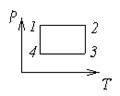 Некоторая масса идеального газа изобарно нагревается, а затем после изотермического сжатия и изохорного охлаждения возвращается в исходное состояние. Изобразить эти процессы в координатах p, T и p, V.
Некоторая масса идеального газа изобарно нагревается, а затем после изотермического сжатия и изохорного охлаждения возвращается в исходное состояние. Изобразить эти процессы в координатах p, T и p, V.
63. Сколько молекул воздуха находится в комнате объемом 240 м3 при температуре 15°C и давлении 10 5 Па?
64. При постоянной температуре концентрация молекул газа уменьшилась в два раза. Как при этом изменились давление и объем?
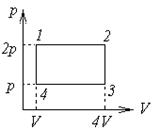
Рисунок 1
65. На рисунке 1 в координатах р, Т представлен замкнутый цикл. Представить этот цикл в координатах V, Т (р – давление, V – объем, Т – температура).
66.  Имеется сосуд объемом 0,5 м3 и поршневой насос с объемом 50 см3. Сколько качаний нужно сделать, чтобы давление в сосуде уменьшилось от 760 мм рт. ст. до 700 мм рт. ст. Считать, что процесс происходит при постоянной температуре.
Имеется сосуд объемом 0,5 м3 и поршневой насос с объемом 50 см3. Сколько качаний нужно сделать, чтобы давление в сосуде уменьшилось от 760 мм рт. ст. до 700 мм рт. ст. Считать, что процесс происходит при постоянной температуре.
67. На рисунке 2 в координатах V, T представлен процесс, проведенный с неизменной массой идеального газа. Представить этот процесс в координатах р, T (V -объем, T-температура, р - давление газа). Рисунок 2
68. Сколько молей воды содержится в ведре вместимостью 9 л, если молярная масса воды 0,018 кг/моль. Плотность воды 103 кг/м3.
69. Предельно допустимая концентрация молекул паров ртути в воздухе равна 3×1016 м-3. При какой массе паров ртути в 1 м3 воздуха появляется опасность отравления?
70. Баллон емкостью 10 л содержит 2 г водорода и 14 г азота при температуре 25˚С. Каково будет давление в баллоне, если в него дополнительно накачать 44 г углекислого газа? Температура при накачивании повысилась на 2˚ С.
71. При постоянной температуре газ сжали от объема 0,15 м3 до 0,1 м3. Давление газа при этом повысилось на 20 Н/см2. Определить начальное давление газа.
72.  В баллоне емкостью 60 л находится 265 г газа при температуре 0°С и давлении 5 МПа. Какой это газ?
В баллоне емкостью 60 л находится 265 г газа при температуре 0°С и давлении 5 МПа. Какой это газ?
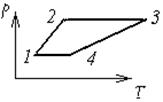
73. Идеальный одноатомный газ совершает замкнутый цикл, состоящий из двух изобар и двух изохор (рисунок 3), причем наибольшее давление газа в два раза больше наименьшего, а наибольший объем в 4 раза больше наименьшего. Определить КПД цикла.
Рисунок 3
74. Теплоизолированный сосуд разделен пористой перегородкой на две равные части. Атомы гелия могут свободно проникать через поры в перегородке, а атомы аргона – нет. В начальный момент в одной части сосуда находится 8 г гелия, а в другой – 40 г аргона. Температура гелия 270С, а температура аргона 3270 С. Определить температуру гелия после установления равновесия в системе.
75. При увеличении абсолютной температуры идеального газа в 4 раза давление газа увеличилось на 50 %. Как и во сколько раз изменился объем? Масса газа постоянна.
76.  На рисунке 4 представлен циклический процесс, проведенный с неизменной массой идеального газа. Представьте этот процесс в координатах V, T и p, V, где V - объем, T - температура, p - давление газа. Рисунок 4
На рисунке 4 представлен циклический процесс, проведенный с неизменной массой идеального газа. Представьте этот процесс в координатах V, T и p, V, где V - объем, T - температура, p - давление газа. Рисунок 4
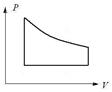
77. 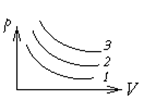 На диаграмме p, V (рисунок 5) изображены изотермы трех газов - кислорода, гелия и углекислого газа. Массы газов одинаковы. Измерения производились при одной и той же температуре. Какая изотерма соответствует какому газу? Дать объяснение.
На диаграмме p, V (рисунок 5) изображены изотермы трех газов - кислорода, гелия и углекислого газа. Массы газов одинаковы. Измерения производились при одной и той же температуре. Какая изотерма соответствует какому газу? Дать объяснение.
Рисунок 5
78. Температура воздуха в комнате изменилась от 7°С до 27° С. На сколько процентов уменьшилось число молекул в комнате?
79. Сколько молекул содержится в 1 л воды и какой объем при нормальных условиях занимает водяной пар той же массы (водяной пар считать идеальным газом)?
80. Найти молярную массу смеси, состоящей из 20 г кислорода, 30 г азота и 60 г окиси углерода.
81. Какой из циклов, изображенных на рисунке 6, соответствует циклу в координатах p, V и состоящему из двух изохор и двух изобар?
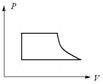
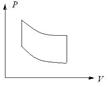
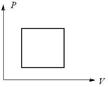
1) 2) 3)
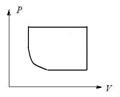
4) 5)
Рисунок 6
82. Какой из перечисленных газов: водород, гелий, кислород, азот в количестве одного моля нужно взять, чтобы создать максимальное давление, одинаковое для всех газов, в сосуде объемом 1 м3 при 273 К?
83. В баллоне находится 2,2 моля газа. Сколько молекул находится в баллоне?
84. Идеальный газ сначала нагревался при постоянном давлении, потом его давление увеличивалось при постоянном объеме, затем при постоянной температуре давление его уменьшилось до первоначального значения. Начертить графики этих процессов в координатах p,T; pV; V,T.
85. Начертите графики изменения плотности идеального газа при изотермическом и изобарическом процессах в координатах плотность-температура.
86.  Из баллона с кислородом, находящимся при высоком давлении р, очень медленно выпустили половину массы газа. Как изменились при этом давление и температура? Что изменится и почему, если этот процесс совершать очень быстро?
Из баллона с кислородом, находящимся при высоком давлении р, очень медленно выпустили половину массы газа. Как изменились при этом давление и температура? Что изменится и почему, если этот процесс совершать очень быстро?
87. При нагревании газа получена графическая зависимость давления от температуры (рисунок 7). Определить по графику, сжимался или расширялся газ во время нагревания? Дать объяснение.
Рисунок 7
88. 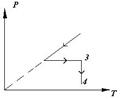 В баллоне находится 0,01 моль газа. Сколько молекул находится в баллоне?
В баллоне находится 0,01 моль газа. Сколько молекул находится в баллоне?
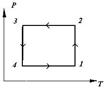
89. На рисунке 8 представлен график изменения состояния идеального газа в координатах p, T. Представьте этот процесс графически в координатах T, V и p, V (p – давление, V – объем, T – температура газа). Рисунок 8
90. Какие процессы представлены на рисунке 9? Изобразите их в координатах p,V м V,T.
Рисунок 9
91. 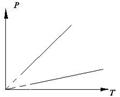 На рисунке 10 изображены зависимости давления от температуры для одной и той же массы газа, помещенного в сосуды различных объемов. Какой из графиков соответствует изменению состояния газа, помещенного в меньший объем? Дать объяснение.
На рисунке 10 изображены зависимости давления от температуры для одной и той же массы газа, помещенного в сосуды различных объемов. Какой из графиков соответствует изменению состояния газа, помещенного в меньший объем? Дать объяснение.
Рисунок 10
92. Найти число молекул в 1 см3 и плотность водорода при давлении
10-6 мм рт. ст. и температуре 17° С.
93. Как и во сколько раз изменится число молекул газа, заключенных в единице объема, если давление газа возрастет с 1 атм до 3 атм, а температура повысится с 0°С до 273°С?
94. Определить число молей и число молекул кислорода, масса которого 0,5 кг.
95. Баллон емкостью 12 л содержит углекислый газ. Давление газа 9 атм, температура 15°С. Определить массу газа и массу молекулы газа.
96. Cколько киломолей и сколько молекул газа находится в колбе объемом 240 см3, если температура газа 20°С и давление 750 мм рт. ст.?
97. Найти число атомов, содержащихся в капельке ртути массой 2 г. Какова масса атома ртути?
98. Во фляжке емкостью 0,5 л находится 0,3 л воды. Турист пьет из нее воду, плотно прижав губы к горлышку так, что во фляжку не попадает наружный воздух. Сколько воды удается выпить туристу, если он может понизить давление оставшегося во фляжке воздуха до 80 кПа? Атмосферное давление считать равным 100 кПа.
99. В сосуде, объем которого 2 л, находится 0,2 моля кислорода. Определить концентрацию молекул газа.
100. В цилиндр, длиной 1,6 м, заполненный воздухом при нормальном давлении, начали медленно вдвигать поршень, площадь основания которого 200 см2. Определить силу, действующую на поршень, если его остановить на расстоянии 10 см от дна цилиндра.
101. В воде на глубине 100 м находится шарообразный воздушный пузырь. На какой глубине пузырь должен расшириться в шар вдвое большего радиуса? Сил поверхностного натяжения не учитывать. Ускорение свободного падения принять равным 10 м/с2.
102. Плотность серебра 15,5 г /см3. Сколько атомов серебра содержится в 1 мм3 ?
103. Баллон емкостью 10 л содержит 2 г водорода и 14 г азота при температуре 25°С. Каково будет давление в баллоне, если в него дополнительно накачать 44 г углекислого газа? Температура при накачивании повысилась на 2°С.
104. В одном баллоне емкостью 15 дм3 находится газ под давлением 0,2 МПа, а в другом - тот же газ под давлением 1 МПа. Баллоны соединены трубкой с краном. Если открыть кран, то в обоих баллонах устанавливается давление 0,4 МПа. Какова емкость второго баллона? Температура газа в баллонах одинакова.
105. Колба емкостью 0,5 л содержит азот при нормальных условиях. Сколько молекул газа находится в колбе?
106. Баллон емкостью 30 л содержит смесь водорода и гелия при температуре 300 К и давлении 0,8 МПа. Масса смеси 24 г. Определить массу водорода и массу гелия.
107. В закрытом сосуде емкостью 2 м3 находится 1,4 кг азота и 2 кг кислорода. Найти давление газовой смеси в сосуде, если температура смеси 27° С. Определить массу молекул азота и кислорода.
108. Определить плотность смеси 4 г азота и 32 г кислорода при температуре 70С и давление 700 мм рт.ст.
109. В сосуде находится газ под давлением 0,15 МПа при температуре 2730 С. Какое количество молекул находится в единице объема сосуда?
110. Найти массу одного атома водорода и число атомов, содержащихся в одном грамме водорода
111. В сосуде, при температуре 1000С и давлении 4∙105 Па, находится 2 м3 в смеси кислорода О2 и сернистого газа SO2. Определить парциальное давление компонентов, если масса сернистого газа 8 кг.
112. Найти число молекул в 1 см3 и плотность азота при давлении 10-6 мм рт. ст. и температуре 15º С.
113. В двух сосудах емкостью по 5 л находится соответственно азот под давлением 1 атм и окись углерода под давлением 5 атм. Сосуды соединяют тонкой трубкой, объемом которой можно пренебречь. Найти установившееся давление смеси, если начальная температура обоих газов равна температуре окружающей среды.
114. Найти объем, занимаемый смесью 2,8 кг азота и 3,2 кг кислорода при температуре 170 С и давлении 4∙105 Н/м2.
115. Найти массу молекулы азота и число молекул, содержащихся в одном грамме азота.
116. Найти число атомов, содержащихся в капельке ртути массой 1 г, и массу атома ртути.
117. Найти плотность воздуха при температуре 270 С и давлении 1013 ГПа. Считать, что воздух состоит (по массе) из 75,4 % азота, 23,2% кислорода, 1,4 % аргона. Содержанием остальных газов пренебречь.
118. Плотность смеси азота и водорода при температуре 47 0С и давлении 2 атм равна 0,30 г/л. Найти концентрацию молекул азота и водорода в смеси.
119. Сколько метана может вместить баллон емкостью 15 дм3 при давлении 106 Па и температуре 270 С? Чему равна масса киломоля и молекулы метана?
120. Газ был сжат адиабатически так, что его объем уменьшился в 8 раз. При этом температура газа возросла 27 0С до 410,3 0С. Сколько атомов содержит молекула данного газа?
121. Определить плотность смеси газов, находящихся при давлении 1 МПа и температуре 270С. Смесь состоит из 5 кмолей азота, 1,5 кмоля кислорода и 0,5 кмоля углекислого газа.
122. В сосуде объемом 10 л находится 2∙1023 молекул газа. Какова температура газа, если давление в сосуде равно 0,12 МПа?
123. В баллоне находилось 2 кг газообразного водорода. В баллон дополнительно накачали 8 кг метана. Во сколько раз изменилось давление в баллоне, если температура газов осталось неизменной?
124. При какой температуре кислород, находясь под давлением 0,2 МПа, имеет плотность 1,2 кг/м3. Какова при этом концентрация молекул кислорода?
125. Какое количество кислорода выпустили из баллона емкостью 10 л, если при этом показания манометра на баллоне изменились от 14 до 10 атм, а температура понизилась от 27 0С до 7 0С?
126. В сосуде при t0С = 270 С и давлении Р = 0,1 МПа содержится смесь газов - кислорода массой m1 = 8 г азота массой m2 = 14 г. Определить плотность смеси.
127. Наименьший объем V1 газа, совершающий цикл Карно, равен 30,6 л. Определить наибольший объем V3 , если объем V2 в конце изотермического расширения и объем V4 в конце изотермического сжатия равны соответственно 120 л и 37,8 л.
128. Один моль идеального двухатомного газа совершает цикл, состоящий из двух изохор и двух изобар. Наименьший объем V1=10 л, наибольший объем V2=20 л, наименьшее давление p1=246 кПа, наибольшее p2=410 кПа. Построить график цикла. Определить температуру Т газа для характерных точек цикла. Определить температуру Т газа для характерных точек и работу цикла.
129. Сколько молей и сколько молекул газа находится в колбе емкостью 480 см3,если температура газа 200С и давление 380 мм рт. ст.?
130. Колба емкостью 1,5 л содержит газ, при нормальных условиях. Сколько молекул газа находится в колбе? Какова масса газа, если это: водород, кислород, азот?
131. В колбе емкостью 500 см3 содержится некоторой газ при температуре Т=300 К. На сколько понизится давление p газа в колбе, если вследствие утечки из колбы выйдет N = 25×1020 молекул?
132. Взрослый человек выдыхает в течение суток приблизительно 0,65 м3 углекислого газа (предполагается, что газ приведен к нормальным условиям). Найти массу чистого углерода, выдыхаемого человеком. Каков был бы объем кубика, содержащего такую же массу? Сколько в нем содержалось бы атомов углерода?
133. В воде на глубине 0,9 м находится шарообразный воздушный пузырь. На какой глубине пузырь должен расширится в шар в 1,5 раза большего радиуса? Силы поверхностного натяжения не учитывать.
134. Ксенон составляет 48∙10-5 % (по массе) атмосферного воздуха. Сколько атомов ксенона находится в 1 см3 воздуха?
135. Плотность серебра 10,5 г/см3. Сколько атомов серебра содержится в 1 мм3?
136. Плотность пара некоторого соединения углерода с водородом равна 3 г/л при 43 0С и 820 мм рт.ст. Какова химическая формула этого соединения?
137. Газ, находящийся при нормальных условиях, имеет объем 44,8 л. Масса газа 32 г. Молекулы газа состоят из атомов углерода и водорода. Какой это газ?
138. Какое давление рабочей смеси установилось в цилиндре двигателя внутреннего сгорания, если к концу такта сжатия температура повысилась с 470С до 3670С, а объем уменьшился с 1,8 до 0,3 л? Первоначальное давление было 0,1 МПа.
139. Сколько молекул водорода находится в объеме 1,55 л при температуре 270С и давлении 570 мм рт. ст.?
140. В баллоне емкостью 2 м3 содержится смесь азота N2 и окиси азота NО. Определить массу окиси азота, если масса смеси равна 14 кг, температура 300 К и давлении 0,6×106 Па.
141. Используя формулы молекулярно-кинетической теории, вычислить удельные теплоемкости аргона, азота, метана.
142. Плотность газа при давлении 720 мм рт. ст. и температуре 00С равна 1,35 г/л. Найти массу киломоля газа и массу молекулы.
143. Два одинаковых по объему баллона соединены трубкой с краном. В одном баллоне находится 32 г метана под давлением 0,5 МПа, в другом смесь 32 г кислорода и 84 г азота. Каково давление смеси? Какое давление установится в баллонах, если открыт кран? Температура всех газов одинакова.
Date: 2015-07-17; view: 16415; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |