
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Направленность анализа. Выбор объектов исследования и метода извлечения токсических веществ. Определение оптимальных параметров извлечения. Комплексный подход при выборе методов.
Для быстрого лабор-го опред-ния природы токсиканта необходим первич. клинический диагноз отравления, на осн. к-го можно провести направленный ан-з биож-сти. Ненаправл. лаборат. поиск токсиканта с послед-ным опред-ем в био. мат-ле в-в разных классов (н-р, барбитуратов, опиатов и др.) занимает много врем., поэт. рез-тат ан-за может потерять свое клиническ. знач. Чаще всего поступающие для иссл-ния мат-лы не сод-жат указаний на направление поиска. В сопроводит. док-тах пишут: «Отравление ток-том неизвест. природы». В таком случае треб-ся проведение ненаправл. ХТА.
Для проведения ХТА у живых лиц берут пробы мочи и промывных вод желудка при отравлении нераспознанным ядом (первая порция 200 мл). Кровь объемом 10 мл отбирают в чистый сухой флакон, сод-щий 2-4 капли антикоагулянта. При подохрении на отравление в-вами, имеющими очень короткую токсикогенную фазу (угар. газ) берут кровь из вены в чист. фл. с антикоагулянтом (гепарин).
Внутр. органы из трупа взросл. ч-ка извл-ся в кол-ве не менее 2 кг. При подозрении на отравление неизвестным ядом д. б. взяты в отдельные банки: желудок с содержимым, по одному метру тонкой и толстой кишок с содержимым из наиболее измененных участков, не менее 1/3 наиболее полнокровных участков печени и желчный пузырь с содержимым, одна почка и вся моча, 1/3 голов. мозга, сердце с сод-щейся в нем кровью, селезенка и не менее 1/4 наиболее полнокровных участков легких. При подозрении на отравление путем введения яда ч/з влагалище, прямую кишку, под кожу или внутримышечно кроме перечисленных объектов на суд.-хим. иссл-ние дополнительно направляют соотв-нно матку с влагалищем, прямую кишку с содержимым, участки кожи и мышц из мест предполагаемого введения в-ва. При подозрении на хронич. отравление соед-ями мышьяка на суд.-хим. иссл-ние дополнительно направляются волосы, ногти и плоские кости. При суд.-мед. экспертизе эксгумированного трупа кроме внутр. органов (в отдельных банках) на суд.-хим. иссл-ние направляются: по 1 кг земли, взятой из шести участков (непосредственно под гробом, над гробом, у боковых пов-стей и концов гроба). На иссл-ние направл-ся т/ж предметы, нах-щиеся в гробу, кусок доски дна гроба (размером 400 см 2).
Выбор метода изолирования и очистки опред-ся следующими ф-рами: 1. Конкретной практической задачей, т.е. природой объекта, метрологическими параметрами методики. 2. Предысторией объекта (предварит. иссл-ние, обстоятельства отравления, указание на происхождение и т.д.). 3. Сочетаемостью выбранного метода изол-ния и очистки с методом последующего обнаружения и определения яд. в-ва в извлечении. При разработке методик определения токсическ. в-в следует учитывать оснащенность лабораторий соврем. приборами.
На начальном этапе ХТА изолируют токсичное в-во из био. мат-ла. Это достигается экстракцией орг. раств-лями при различных рН, реэкстракцией, дистилляцией, сорбцией или минерализацией орг. матрицы (при опред. металлич. ядов). Далее проводится качеств. опред-ние токсиканта хим. р-циями или интсрумент. методами. При качеств. обнаружении какой-либо группы в-в возможно их одновременное колич-ное опред-ние в той же пробе. Независимо от природы яда общая схема изолирования его из био. материала включает этапы подкисления/подщелачивания пробы, экстракции в орг.-водный раств-ль, реэкстракции в водный/орг. р-р. Возможны изм-ние числа и последоват-сть стадий экстракции, природы раств-лей, оптимизация значений рН и выбора орг. раств-ля.
17. Методы предварительного и подтверждающего анализа. Рациональное сочетание методов. Основы построения скрининг-анализа для обнаружения токсических соединений.
Химик-токсиколог для обнаружения в объекте к.-либо группы в-в или опред. в-ва обязан исп-вать т-ко те р-ции и методы, к-е апробированы на био. объектах, рекомендованы для целей химико-токсиколог. ан-за с учетом всех ф-ров, влияющих на получаемые рез-ты. Т-ко в этом случае полученные данные м. б. объективными и застрах-ми от возможных ошибок, среди к-х могут быть ошибки, связанные с получением ложноположительных или ложноотриц. рез-тов. Ложноположит. рез-тат - это заключение о наличии токсических, экзог. в-в при ан-зе по опред. методике при фактическом их отсутствии. Это свидетельствует об исп-нии высокочувст-ной, недостаточно специфичной методики и возможном отсутствии ее апробации на био. объектах, особенно находящихся в стадии гнилостного разложения. Если какое-либо в-во или его метаболит присутствуют в объекте в конц-ции ниже предела их обнаружения, то возможно получение ложноотриц. рез-тов. Причиной этого чаще всего выступает фактор времени, т.е. интервал времени между контактом яд. в-ва с орг-змом ч-ка или живот. и временем взятия и направления объекта на анализ. Выделяют методы и р-ции предварительного анализа и методы и реакции подтверждающего исследования.
Исп-ние предварительного ан-за или предварит. хим. р-ций преследует цель обнаружить или исключить из ан-за группу в-в или к.-либо индивид. в-во. Таким р-циям или методам придают «судебно-хим. значение при отрицат. рез-те». Это означает, что если при исп-нии данного метода или р-ции в-во или группа в-в не обнаружены, дальнейший ан-з на эти соед-я не проводят и в заключении указывают, что данное в-во или группа в-в в иссл-емом объекте не найдены. Предварит. р-ции и методы д. б. чувств-ми, но необязательно специфичными. Среди них - скрининговые методы (ТСХ, ГЖХ - скрининг, им-мунохим. методы) и реакции, к-е оцениваются как имеющие значение при отрицат. рез-те: групповые р-ции осаждения, хромогенные р-ции и др, Эти способы и р-ции д. б. обязательно подтверждены хим. и ф.-хим. методами.
Предварит. р-ции и методы, как прав., не позволяют определить индивид. в-ва. Это требует проведения дополнит. иссл-ний. В токсиколог. химии такие иссл-ния называют подтверждающим ан-зом, подтверждающими (частными) р-циями или частным внутригрупповым скринингом, Среди них методы ВЭЖХ, ГЖХ, ТСХ, УФ- и ИК-спектрометрия, спектрофотометрия в УФ области спектра, масс-спектрометрия, хроматомасс-спектрометрия, люминесцент. ан-з, аналитические р-ции разных типов (кислотно-основ., окисл.-восст., комплексообразования), микрокристаллоскопический метод, фармакогностический анализ, фармаколог. пробы, а также процессы осаждения, экстракции и др. По специфичности подтверждающие методы обычно превосходят предварительные, что снижает кол-во ложноположит. рез-тов.
При проведении химико-токсиколог. ан-за с исп-ем хим. метода необходимо учитывать следующие обстоятельства: 1) Любое чужеродное в-во в орг-зме частично или полностью подвергается метаболизму, и поэт. его можно не обнаружить известными р-циями. 2) В процессе изолир-я яд. в-ва извлекаются не полностью и м. б. частично потеряны, поэт. исп-мые р-ции должны отличаться высокой чувств-стью. 3) Объекты, присылаемые на ан-з, могут находиться в состоянии гнилостного разложения. Продукты разложения (птомаины) обычно извл-ся из объекта вместе с исследуемым в-вом и могут искажать рез-ты ан-за. Поэт. при ан-зе таких объектов исп-ние хим. р-ций возможно после тщательной очистки извлечений. 4) При комбинир. отравлениях (н-р, этил. спиртом и его суррогатами) применение характерных р-ций затруднено присутствием близких по хим. св-вам соед-ний. В этих случаях предусмотрено строгое соблюдение условий воспроизведения р-ций (окисления, температурного режима и т.д.), чтобы предотвратить обнаружение одних соед-ний (более ядовитых) вместо других.
Каждая исп-мая хим. р-ция д. б. рек-вана в опред. модификации применительно к исследуемому объекту. Это особенно важно в тех случаях, когда проводят иссл-ние объекта на «металлич.» яды, поскольку многие из них явл.ся микроэлементами и могут быть обнаружены в извлечениях.
В связи с варьированием содержания элементов в тканях, для количеств. определения металлов в минерализате для каждого катиона предложены не менее 2х методов, к-е позволяют определять их в широких пределах конц-ций.
По схеме дробного метода анализа предусматривается разбавление минерализата до конц-ций, когда естественно содержащийся микроэлемент не м. б. обнаружен, а конц-ция попавшего в орг-зм эл-та останется достаточной для его обнаружения. При проведении р-ций к минерализату доб. опред. объем воды очищенной, а затем вносят соотв-щие реактивы.
Абсолютно специфичных р-ций очень мало. По правилам проведения химико-токсиколог. ан-за для заключения об обнаружении в извлечении из объекта яд. соед-ния необходимо провести не менее 3-4 характерных для данного в-ва р-ций. Рез-ты некот. хим. р-ций оцениваются как «р-ции Corpus delicti» (вещесв. док-во). Это р-ции, продукты взаим-вия к-х можно представить вместе с заключением об отравлении как неоспоримое док-во обнаружения в объекте данного в-ва.
Для увеличения избирательности некоторых р-ций и повышения их чувств-сти иногда рек-ется предварительное выделение яд. в-ва из исследуемого р-ра с исп-ем экстракции и реэкстракции.
При хим. анализе на любое чужеродное соед-е эксперт должен руков-ваться специально изданными и утвержденными методиками и соотв-щими методическими указаниями.
Аналитический скриннинг.
Многообразие лек., нарк., яд.в-в, к-е м. б. причиной отравлений, требует проведения предварит. отсеивающего иссл-ния - аналитический скрининг. Аналит. скрининг - это система методических приемов, позволяющих в ходе исследовательских операций исключить или определить группы в-в (индивид. соед-я) на этапе предварит. иссл-ния.
Аналит. скрининг явл-ся эффективным при его соответствии определенным требованиям: специфичность (чаще групповая); высокая чувств-сть; экспрессность; точность и воспроизводимость; возможность сочетания с другими методами анализа.
Скрининг исп-ся при ан-зе многокомпонент. смесей, а в случае ненаправленного ан-за - при иссл-нии извлечения из био. объекта на неизвестное токсическое в-во.
В настоящее время понятие скрининга в токсикологической химии значительно шире.
Скрининг - это поэтапное движение к выявлению индивид. в-ва путем последов-го исключения групп яд. в-в, а затем отсеивания в-в в обнаруженной группе до выявления конкретного соед-я. Из соврем. скрининговых методов в практике химико-токс. ан-за нашла шир. прим-е хроматография в тонких слоях сорбента (ТСХ). Этот метод доступен, прост в выполнении, отличается высокой чувств-стью, эфф-стью, экспрессностью и достаточной специф-стью (избирательностью). ГЖХ-скрининг исп-ся, в основном, при анализе летучих, лек. и нар. в-в. Имеются разработки по исп-нию в кач-ве скрининговых методов ВЭЖХ, абсорбционной спектроскопии, иммунохим. методов, спектроскопии ядерного магнитного резонанса. При исп-нии этих методов необходима тщательная очистка извлечений от эндогенных соединений, способных исказить результаты анализа и засорить колонки хроматографов.
Характеристика объектов исследования (внутренние органы, ткани, кровь - цельная кровь, сыворотка, плазма; моча, лимфа, слюна, волосы, ногти, диализаты, промывные воды и т.п.). Общие принципы отбора и направления объектов на анализ. Подготовка биологических проб к анализу.
Внутренние органы (печень, почки, мышечная ткань). Хим. состав мышечной ткани, печени, почек сложен и в целом включает след. в-ва: воду - до 70-75%, белки - 18-22%, липиды - 2-3%, неорг. соли - 1-1,5%, углеводы -2-3%, азотистые экстрактивные в-ва - 1-1,7%, безазотистые экстрактивные в-ва - 1-1,5%, а также ферменты, витамины. Благодаря большой молекуляр. массе, белки в органах нах-ся в коллоидном состоянии. Они имеют свободные карбоксильные и аминные группы и являются амфотерными соед-ями. При значении рН>7 белок проявляет свойства к-ты, а при значении рН<7 - основания. Конц-ция водородных ионов (рН среды), при к-й в мол-ле белка устанавливается равенство положит. и отриц. ионов, называется изоэлектрической точкой белка. В этом случае белок электронейтрален. По мере возрастания рН среды увелич-ся отриц. заряд белка, а при значении рН ниже изоэлектрической точки белки имеют положит. заряд. Наибольш. число белков в тканях представлено альбуминами и глобулинами. Альбумины делятся на растворимые в воде и нераств. в насыщенных р-рах сернокислого аммония. Глобулины нерастворимы в воде, но растворимы в ней в присутствии различ. солей. С глобулинами в орг-зме образуют прочные связи «металлические» яды. Т. к. белки выше их изоэлектр. точки имеют отриц. заряд, они могут связывать многие основания (в т. ч. алкалоиды и другие орг. основания). Чем сильнее основание, тем прочнее оно связывается с белками.
Сод-ние углеводов в живом орг-зме достигает 3% сухой массы. Основная масса углеводов находится в печени и мышцах в виде полисахарида гликогена. Липиды (жиры и жироподоб. в-ва) нераств. в воде, раств. в орг. раств-лях (эфире, хлороформе, спирте, ацетоне, толуоле). Жиры в осн. явл-ся триглицеридами, их сод-ние может достигать 50%. Кроме того, в орг-зме сод-ся больш. кол-во фосфол-дов, входящих в сос. всех клеток.
Кровь. Кол-во крови в орг-зме ч-ка сост. 6-7,5% массы тела, у взросл. ч-ка это 5-6 л, у новорожд. ребенка - примерно 240 мл. Кровь сост. из плазмы и взвешенных в ней форменных эл-тов: эритроцитов, лейкоц., тромбоц.. Преобладают в крови эритроциты. Сод-ние воды в крови - 75-85%. Кровь имеет слабощелоч. р-цию среды (рН=7,35-7,4). Плазма крови (белковая ж-сть после удаления форменных эл-тов) сост. 4% от массы тела. Плазма на 90% сост. из воды, в к-й сод-ние белков достигает 70-80 мг/мл, в их числе 40-50 мг/мл составляют альбумины. Осн. часть других белков (до 25 мг/мл) представлена глобулинами, к числу к-х относится фибриноген (~3 мг/мл), отвечающий за сверт-ние крови. В плазме сод-ся 7,5 мг/мл минер. солей, 4-8 мг/мл липидов, в т. ч. 2-2,5 мг/мл фосфолипидов. В плазме (сыворотке) нах-ся много эндогенных низкомолек. орг. в-в. Среди них гормоны, биогенные амины, вит-ны, креатин, креатинин, билирубин, мочевая к-та, мочевина и др. Эти соед-я могут потенциально мешать проведению химико-токс. ан-за на яд. и нарк. в-ва. Многие токсическ. в-ва связываются в крови с белками (иногда до 90%), в основном с альбуминами, реже с глобулинами.
Моча - прозрачная ж-сть, окрашенная в желт. цв. (за счет пигмента урохрома) или в оранж. цвет (за счет пигм. уробилина). Объем мочи в среднем сост. ежесуточно 1,5 л у мужчин и 1,2 л у женщин, что зависит от питьевого режима, и может даже достигать 2-3 л. При стоянии в моче появляется муть, предст-щая соб. фосфаты, карбонаты, оксалаты, сульфаты металлов, в основном второй группы. Моча сод-жит те в-ва, к-е поступают к почкам с кровью, но по составу знач-но отличается от состава плазмы. Моча в норме не сод-жит белок и глюкозу. В моче в 50-100 раз больше, чем в крови, мочевины, вдвое выше конц-ция минер. солей, в 8-10 раз больше уровень мочевой к-ты, креатинииа. За сутки с мочой выделяется 50-70 г сухих в-в. В моче много минер. в-в - за сутки выделяется ~ 20 г солей (в основном хлориды Na и К), что снижает т-ру замерзания мочи до -1,3-2,3°С, что следует учитывать при лиофилизации проб. Значение рН среды в моче в норме от 4,5 до 8,0 и зависит от хар-ра пищи. Из эндогенных соед-ний в моче присутствуют низкомолек. продукты метаболизма аминокислот, сахаров, стероиды и др. В моче содержатся в-ва, явл-щиеся продуктами обезвреживания ядов в орг-зме. К ним относятся эфирсерные кислоты, парные соед-ния с глюкур. к-той, оксигиппгуровая к-та и др. В виде парных соед-ний с глюкур. к-той выдел-ся с мочой яд.е в-ва, образующиеся при гниении в кишечнике (фенол, крезол, индол, скатол), многие лек., нарк. в-ва и их метаболиты (морфин, эфедрин, фенилалкиламины, барбитураты, производные фенотиазина и др.).
Слюна — продукт секреции желез ротовой полости. Она сод-жит ферменты α-амилазу, мальтазу, ионы калия, кальция, гидрокарбонаты, белковые соед-я (альбумины, липопротеиды и др.). Значение рН слюны 6,8-7,1. Чужеродные соед-я, особенно лек. и нарк. в-ва, могут связываться с белками слюны и подвергаться ферментатив. возд-вию. Установлено, что неионизироваиные формы токсических в-в, нах-щиеся в плазме крови, пассивно диффундируют в слюну, и в таких случаях сущ-ет прямая зависимость м/у конц-цией анализируемого в-ва в слюне и его конц-цией в плазме крови.
Волосы явл-ся производными эпидермиса. В волосе различают стержень, выступающий над пов-стью кожи, а также корень, распол-щийся в толще кожи и оканч-щийся утолщением (луковицей). Корень волоса (как и стержень) имеет сердцевину, корковый слой и кутикулу. Клетки сердцевины имеют вид тонких пластинок с ядрами и зернами кератогиалина. Кутикула в верхней части корня сост. из плоских безъядерных чешуек, книзу в них имеются цилиндрическ. клетки с ядрами. Обычно волосы головы вырастают на 0,1-0,5 мм в сутки. За месяц они могут удлиниться на 3-15 мм. Волосы предст. соб. сложную комплексную стр-ру, состоящую, главн. обр., из белков, липидов и меланина. Основной субстанцией волос явл-ся твердый кератин, отличающийся большой прочностью. Он плохо раств. в воде, устойчив к возд-вию хим. в-в - кислот, щелочей. Кератин - белковое в-во. Он богат серой (около 4-5%) и аминок-тами (цистеин - около 14%, лейцин - 14%, глютамин. к-та - 12%, тирозин - 3%), к-е способны связывать некот. металлы. Меланин придает природную окраску волосу. Он сост. из полимеров индольно-хинолииовой стр-ры и способен связываться с большинством физиологически активных в-в. Липиды волос имеют в своем составе полярные группы, в число к-х входят ненасыщ. связи, гидроксильные и эфирные группы, к-е образуют связи с лек. и нарк. в-вами по различ. механизмам. Волосы предст. соб. легкодоступный для отбора и хранения био. субстрат при химико-токсиколог. ан-зе как на неорг., так и на орг. яды. Важно то, что нарк. и лек. в-ва не метаболизируются в волосах. Возникает возможность обнаружения ядов и т.п. в волосах в отдаленные сроки после окончания их приема и даже в тех случаях, когда анализ био. объектов дает отриц. рез-тат.
Ногти. Подобно волосам, ногти также явл-ся производными эпидермиса. Это роговые пластинки, располагающиеся на тыльной пов-сти концевых фаланг пальцев рук и ног. Ногтевая пластинка образована плотно прилегающими др. к др. роговыми чешуйками плоской формы, заполненными твердым кератином, устойчивым к возд-вию хим. в-в. Белок кератин содержит цистин, аргинин, тирозин, лизин, фенилаланин, триптофан, гистидин и др. Ногти содержат 10,1-13,7% воды, 0,15-0,76% жироподобных в-в (холестерин и его эфиры), минер. в-ва (кальций, фосфор, цинк, мышьяк и др.). Установлено, что в ногтях способны накапливаться нарк. в-ва и прежде всего - опиаты.
Подготовка объектов к анализу.
Внутренние органы (печень, почки, мышечная ткань). Органы измельчают до р-ров кусочков 0,5×0,5×0,5 см. Более мелкое изм-чение приводит к увел-нию экстракционной пов-сти и одновр-но к значит-му увеличению кол-ва балласт. эндог. соед-й (белков, фер-тов, пр-ктов распада белковых мол-л, пигментов и др.) в извлечении. При этом химик вынужден будет применить особые способы очистки, что приведет к потере токсическ. в-в, особенно при их следовых кол-вах в объекте. Рек-дуется исп-вать также вымораживание объекта при т-ре -30-40°С. При этом в органах обр-ся льдинки, к-е разрывают клетки, ткани и способ-ют выходу токсическ. в-в в окр. среду, что увелич-ет процент изолирования искомых соед-й. Можно исп-вать лиофилизацию, т.е. высуш-ние объекта при низких т-рах в вакууме. Это приводит к потере объектом воды и получению при изол-нии более чистых извлечений. Если объект законсервирован спиртом, его осторожно удаляют. В случае подозрения на отравление летуч. соед-ями мышьяка, ртути объект подщелачивают перед удалением спирта карбонатом натрия. Для ан-за обычно берут навеску объекта 5,25, 50 или 100 г (зависит от конкрет. методики).
Кровь. Яд. в-ва и их мет-ты в крови нах-ся в свобод. виде или м. б. связаны с белками (альбуминами, глобул.). При пробоподг-ке крови к экстракции исп-ют приемы, позв-щие разрушить комплекс анал-емого в-ва с белком. Для этой цели рек-ваны след. методы. Доб-ние к крови смешивающихся с водой орг. раств-лей (этил., метил. спиртов, ацетонитрила, ацетона). Их кол-во в 10 раз превышает объем крови. Эфф-ность очистки от белков зависит от вел-ны диэлектрическ. прониц-сти (Ɛ) исп-емого раств-теля. При понижении диэл. прон-сти сила притяж. м/у мол-лами растворенных в-в возрастает. В рез-те под влиянием ацетона и спиртов происх. агрегация мол-л белковых в-в крови, понижается раств-сть и происх. выпадение их в осадок. Доб-ние хим. агентов для коаг-ции белков: кислот (трихлоруксус., хлорной), солей тяж. Ме (н-р, солей бария). Термическ. обраб-ка крови - метод исп-ют для яд. в-в, к-е не разлаг-ся при повыш. т-ре. Он не рек-ется при анализе объекта, сод-щего термолаб. соед-я.
Моча. С мочой токсическ. в-ва выдел-ся как в неизм. сост., так и в виде метаб-тов и конъюгатов с серной, уксус., глюкур. к-тами. Пробоподг-ка мочи к экстракции токсическ. в-в и их мет-тов включает проведение разрушения конъюгатов с указанными к-тами. Для этой цели проводят неспецифическ. кислотный или специф. ферментатив. гидролиз. Кислотный г-з явл-ся более быстрым и прост. в осущ-нии. Однако вследствие неспециф-сти р-ции расщепления ковалент. связи и жестких условий проведения в среде конц. к-ты при кипячении в теч. длит. времени или при нагревании в автоклаве под давл., обр-ся большое кол-во побоч. пр-ктов. Экстракция орг. раств-лем из полученного гидролизата дает высокий фон и много постор. пиков при проведении ан-за методом газовой хром-фии. Кислот. г-з пров-ся в герметично закр. сосудах, к-е помещают в вод. бани или специальн. нагревательные блоки. Ферментативный гидролиз проводится в присутствии одного или смеси ферментов β-сульфатазы и β-глюкуронидазы в мягких условиях, что уменьшает образ-е побоч. продуктов, и гидролизат получается более чистым. Сущ-нным недостатком метода явл-ся необх-сть соблюдения строгих условий гидролиза: рН, т-ры, состава буфера, активности ферментов, - а также длит-сть процесса (12-20 ч).
Слюна. Для снижения акт-сти фер-тов слюну при хранении замораживают. Перед экстракцией ее разбавляют водой очищ. (1:3), после чего экстрагируют токсическ. вва орг. раствлями при соотвщем значении рН.
Волосы, ногти. Для удаления внешних загрязнений волосы и ногти отмывают 2 М рром HCl и метанолом (или этанолом), затем сушат при комн. т-ре и отбирают для ан-за навеску 30-40 мг.
Способы консервирования биологических объектов. Первичная обработка различных объектов исследования в зависимости от используемого метода анализа. Особенности обработки проб крови и проб мочи.
При консервации био. мат-ла, изъятого из трупа для производства судебно-хим. иссл-ния, следует применять этил. спирт. Объекты иссл-ния консервируют т-ко при подозрении на отравление сердеч. гликозидами, производными фенотиазина, фосфороорг. пестицидами, алкалоидами и трициклическ. антидепрессантами. Уровень спирта-ректификата, исп-его для консервации, должен превышать уровень внутр. органов в банках для хранения не менее чем на 1 см.
Общая схема пробоподготовки закл-ся в след-щем. При исп-нии соврем. мат-лов определения токсичных в-в достаточна проба биомат-ла массой 5-15 г. На аликвоту биомат-ла (кровь, моча) возд-вуют реагентом, вызывающим осаждение белков. Пробу ткани точной массы желательно предвар-но высушить и обескровить. Затем пробу гомогенизируют с водой или буферн. р-ром. После отделения жидкой фазы (фильтрование или центрифуг-ние) к точному ее объему т/ж доб. реагент для осаждения белков. Затем проводят вторичную экстракцию различ. орг. раств=лями, извлекая незаряженные формы кислот, оснований и амфолитов. Пробу концентрируют жидкостной или твердофазной экстракцией. Токсичное в-во обнаружиают иммунохим. тестами, методами газов. хромат-фии, ТСХ (для летуч. соед-ний с одновременной парофазной экстракцией), спектрофотометрии, высокоэффективной жидкостной хроматографии с хроматомасс-спектрометрией (ВЭЖХ/МС).
Подготовка объектов к анализу.
Внутренние органы (печень, почки, мышечная ткань). Органы измельчают до р-ров кусочков 0,5×0,5×0,5 см. Более мелкое изм-чение приводит к увел-нию экстракционной пов-сти и одновр-но к значит-му увеличению кол-ва балласт. эндог. соед-й (белков, фер-тов, пр-ктов распада белковых мол-л, пигментов и др.) в извлечении. При этом химик вынужден будет применить особые способы очистки, что приведет к потере токсическ. в-в, особенно при их следовых кол-вах в объекте. Рек-дуется исп-вать также вымораживание объекта при т-ре -30-40°С. При этом в органах обр-ся льдинки, к-е разрывают клетки, ткани и способ-ют выходу токсическ. в-в в окр. среду, что увелич-ет процент изолирования искомых соед-й. Можно исп-вать лиофилизацию, т.е. высуш-ние объекта при низких т-рах в вакууме. Это приводит к потере объектом воды и получению при изол-нии более чистых извлечений. Если объект законсервирован спиртом, его осторожно удаляют. В случае подозрения на отравление летуч. соед-ями мышьяка, ртути объект подщелачивают перед удалением спирта карбонатом натрия. Для ан-за обычно берут навеску объекта 5,25, 50 или 100 г (зависит от конкрет. методики).
Кровь. Яд. в-ва и их мет-ты в крови нах-ся в свобод. виде или м. б. связаны с белками (альбуминами, глобул.). При пробоподг-ке крови к экстракции исп-ют приемы, позв-щие разрушить комплекс анал-емого в-ва с белком. Для этой цели рек-ваны след. методы. Доб-ние к крови смешивающихся с водой орг. раств-лей (этил., метил. спиртов, ацетонитрила, ацетона). Их кол-во в 10 раз превышает объем крови. Эфф-ность очистки от белков зависит от вел-ны диэлектрическ. прониц-сти (Ɛ) исп-емого раств-теля. При понижении диэл. прон-сти сила притяж. м/у мол-лами растворенных в-в возрастает. В рез-те под влиянием ацетона и спиртов происх. агрегация мол-л белковых в-в крови, понижается раств-сть и происх. выпадение их в осадок. Доб-ние хим. агентов для коаг-ции белков: кислот (трихлоруксус., хлорной), солей тяж. Ме (н-р, солей бария). Термическ. обраб-ка крови - метод исп-ют для яд. в-в, к-е не разлаг-ся при повыш. т-ре. Он не рек-ется при анализе объекта, сод-щего термолаб. соед-я.
Моча. С мочой токсическ. в-ва выдел-ся как в неизм. сост., так и в виде метаб-тов и конъюгатов с серной, уксус., глюкур. к-тами. Пробоподг-ка мочи к экстракции токсическ. в-в и их мет-тов включает проведение разрушения конъюгатов с указанными к-тами. Для этой цели проводят неспецифическ. кислотный или специф. ферментатив. гидролиз. Кислотный г-з явл-ся более быстрым и прост. в осущ-нии. Однако вследствие неспециф-сти р-ции расщепления ковалент. связи и жестких условий проведения в среде конц. к-ты при кипячении в теч. длит. времени или при нагревании в автоклаве под давл., обр-ся большое кол-во побоч. пр-ктов. Экстракция орг. раств-лем из полученного гидролизата дает высокий фон и много постор. пиков при проведении ан-за методом газовой хром-фии. Кислот. г-з пров-ся в герметично закр. сосудах, к-е помещают в вод. бани или специальн. нагревательные блоки. Ферментативный гидролиз проводится в присутствии одного или смеси ферментов β-сульфатазы и β-глюкуронидазы в мягких условиях, что уменьшает образ-е побоч. продуктов, и гидролизат получается более чистым. Сущ-нным недостатком метода явл-ся необх-сть соблюдения строгих условий гидролиза: рН, т-ры, состава буфера, активности ферментов, - а также длит-сть процесса (12-20 ч).
Слюна. Для снижения акт-сти фер-тов слюну при хранении замораживают. Перед экстракцией ее разбавляют водой очищ. (1:3), после чего экстрагируют токсическ. вва орг. раствлями при соотвщем значении рН.
Волосы, ногти. Для удаления внешних загрязнений волосы и ногти отмывают 2 М рром HCl и метанолом (или этанолом), затем сушат при комн. т-ре и отбирают для ан-за навеску 30-40 мг.
Константы ионизации, диссоциации слабых кислот и оснований. Степень ионизации. Зависимость от рН среды. Растворимость и коэффициенты распределения лекарственных и наркотических веществ, неэлектролитов, ионных соединений.
Характерной особенностью приведенных веществ является их способность давать ионизированные и неионизированные формы. Существование различных форм зависит от величины константы ионизации вещества и значения рН среды. Для кислот константа ионизации определяется уравнением:
 или в логарифмическ. форме
или в логарифмическ. форме 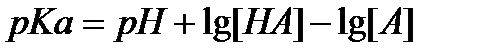
Для оснований:  или
или 
Исходя из этих уравнений, можно считать, что кислота будет полностью (99,9%) ионизирована при рН=рКа+3, а основание - при рН=рКа-3. Эти закономерности справедливы для водных растворов. В смешанных или неводных растворителях эти соотношения могут изменяться, иногда на значительную величину.
Достичь условий полной ионизации веществ удается не всегда. В этих случаях ограничивают значения рН до величины рКа±2 и даже меньше. При этом следует учитывать, что при рН=рКа только 50% вещества будет находиться в ионизированной форме.
Эти закономерности используют как при извлечении ядовитых веществ, так и при очистке полученных экстрактов. Соли кислот и оснований хорошо растворимы в воде и спирте и практически не растворяются в органических растворителях. Свободные кислоты и основания хорошо растворимы в органических растворителях и плохо растворимы в воде и спиртоводных смесях.
Для создания необходимого значения рН среды объект с экстрагентом подкисляют органической или неорганической кислотой. Природа кислоты может оказывать влияние на степень изолирования алкалоидов и органических оснований из биологического материала. Чем лучше растворяются соли ядовитых веществ в данном растворителе, тем лучше они будут извлекаться.
Применение минеральных кислот для подкисления объектов ограничивается возможностью гидролиза эфироподобных токсических веществ (атропин, кокаин и др.) и белковых молекул. В.Ф.Крамаренко установлено, что такие явления не происходят, если для подкисления взята разбавленная минеральная кислота.
Для изолирования слабых кислот, в частности барбитуратов, используют подщелоченную воду. При этом образуются натриевые соли барбитуратов, которые хорошо извлекаются водой.
Выбор величины рН при изолировании обычно учитывает только возможность извлечения ядовитых веществ. Однако пептиды тканей также могут ионизироваться и переходить в раствор. Оптимальным значением рН, препятствующим такому переходу, было бы значение рН, равное изоэлектрической точке белка. В реальных условиях этого достичь не удается. Поэтому извлечения из биологических объектов, полученные на первом этапе, всегда содержат примеси белковых молекул и других эндогенных веществ, а поэтому требуют применения различных способов очистки.
Методы выделения (изолирования) и концентрирования органических и неорганических токсических веществ из различных биологических субстратов и прочих объектов. Методы изолирования, основанные на экстракции - Стаса-Отто, Васильевой А.А., Крамаренко В.Ф., Валова, Грусц-Харди и другие. Методы изолирования, основанные на перегонке с водяным паром, на минерализации.
Метод извлечения яд. в-в из твердых объектов (твердая фаза) водным или спиртовым р-ром к-ты или основания практически всегда явл-ся 1вым этапом изол-ния. На этом этапе измельченные внутр. органы заливают экстрагентом, устанавливают необх. знач. рН и настаивают в теч. опред. времени. Выбор раств-ля и время настаивания зависят от многих ф-ров. Вода и спирт как наиболее часто применяемые раств-ли отвечают многим требованиям, предъявляемым к экстрагентам. В них хор. раств. многие соли оснований и кислот. Время настаивания зависит от скорости проникновения экстрагента внутрь ткани. Продол-сть настаивания опред-ся моментом наступления равновесия м/у конц-цией токсическ. в-ва в ткани и окруж. ж-сти. Вода имеет большее сродство к тканям. Она сод-ся в больш. кол-ве в органах ч-ка. Поэт. вода легко проникает в ткани. Время настаивания объекта с водой и наступление равновесия сост. 1-2 ч. Спирт денатурирует белковые мол-лы на пов-сти кусочков био. мат-ла, его проникновение в ткани затрудняется, и равновесие возникает не менее чем ч/з 6 часов. Для создания необх. значения рН среды объект с экстрагентом подкисляют орг. или неорг. к-той.
Date: 2016-08-31; view: 1573; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |