
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Фосфоенолпируват Молочная кислота
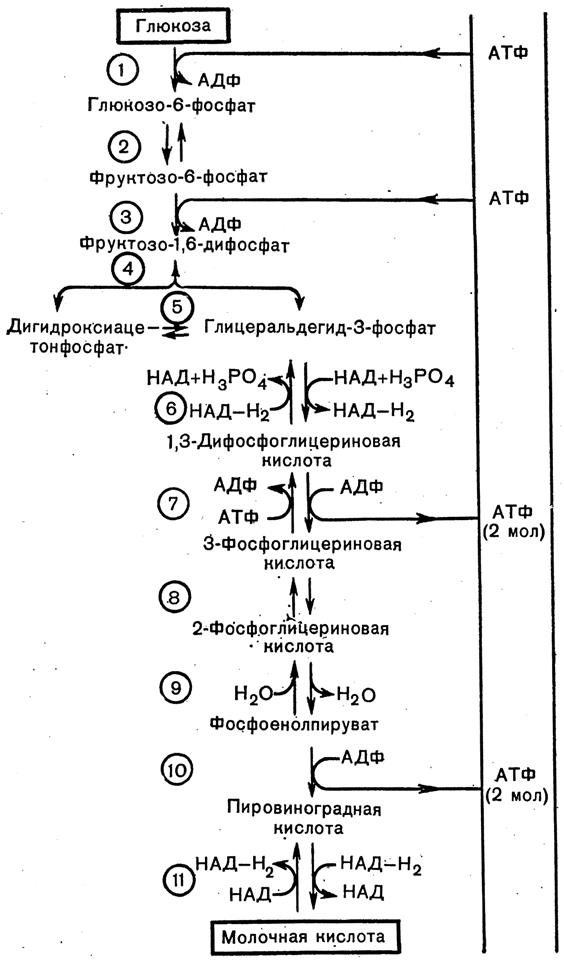
Реакция восстановления пирувата завершает внутренний окислительно-восстановительный цикл гликолиза. НАДH+ при этом играет роль лишь промежуточного переносчика водорода от глицеральдегид-3-фосфата (шестая реакция) на пировиноградную кислоту (одиннадцатая реакция), при этом сам он регенерируется и вновь может участвовать в циклическом процессе, получившем название гликолитической оксидоредукции.
Биологическое значение процесса гликолиза прежде всего заключается в образовании богатых энергией фосфорных соединений. На первых стадиях гликолиза затрачиваются две молекулы АТФ (гексокиназая и фосфофруктокиназная реакции). На последующих образуются четыре молекулы АТФ (фосфоглицераткиназная и пируваткиназная реакции). Таким образом, энергетическая эффективность гликолиза в анаэробных условиях составляет две молекулы АТФ на одну молекулу глюкозы. Известно, что изменение свободной энергии при расщеплении глюкозы до двух молекул молочной кислоты составляет около 210 кДж/моль:
 C6H12O6 2C3H6O3 + 210кДж/моль
C6H12O6 2C3H6O3 + 210кДж/моль
Глюкоза Лактат
Из этого количества энергии около 126 кДж рассеивается в виде тепла, а 84 кДж (максимально) накапливается в форме богатых энергией фосфатных связей АТФ, так как макроэргическая связь в молекуле АТФ соответствует примерно 33,6-42,0 кДж/моль. Таким образом, коэффициент полезного действия анаэробного гликолиза близок к 0,4 (84/210).
Величины изменения свободной энергии точно определены для отдельных реакций гликолиза в интактных эритроцитах человека. Установлено, что восемь реакций гликолиза близки к равновесию, а три реакции (гексокиназная, фосфофруктокиназная, пируваткиназная) сопровождаются значительным уменьшением свободной энергии, т.е. практически являются необратимыми.
В целом последовательность протекающих при гликолизе реакций может быть представлена в следующем виде:
Рис. 4 Общая схема гликолиза.
Гликогенолиз.
Процесс анаэробного распада гликогена получил название гликогенолиза. Вовлечение Б-глюкозных единиц гликогена в процесс гликолиза происходит при участии двух ферментов - фосфорилазы и фосфоглюкомутазы. Образовавшийся в результате фосфоглюкомутазной реакции глюкозо-6-фосфат может включаться в процесс гликолиза. После образования глюкозо-6-фосфата дальнейшие пути гликолиза и гликогенолиза полностью совпадают:
фосфорилаза

 (CH6H10O5)n (CH6H10O5)n-1 + Глюкозо-1-фосфат
(CH6H10O5)n (CH6H10O5)n-1 + Глюкозо-1-фосфат
Гликоген H3PO4
В мышечной ткани

 Гликолиз Глюкозо-6-фосфат
Гликолиз Глюкозо-6-фосфат
Глюкоза
В процессе гликогенолиза в виде макроэргических соединений накапливаются не две, а три молекулы АТФ (не тратится АТФ на образование глюкозо-6-фосфата). На первый взгляд, энергетическая эффективность гликогенолиза выглядит несколько более высокой по сравнению с процессом гликолиза, но эта эффективность реализуется только при наличии активной фосфорилазы а; следует иметь в виду, что в процессе активации фосфорилазы B, расходуется АТФ.
Спиртовое брожение.
Спиртовое брожение осуществляется так называемыми дрожжеподобными организмами, а также некоторыми плесневыми грибами. Суммарную реакцию спиртового брожения можно изобразить следующим образом:
 C6H12O6 2C2H5OH + 2CO2
C6H12O6 2C2H5OH + 2CO2
Механизм реакции спиртового брожения чрезвычайно близок к гликолизу. Расхождение начинается лишь после этапа образования пирувата. При гликолизе пируват при участии фермента ЛДГ и кофермента НАДН2 восстанавливается в лактат. При спиртовом брожении этот конечный этап заменен двумя ферментативными реакциями - пируватдекарбоксилазной и алкогольдегидрогеназной.
В дрожжевых клетках (спиртовое брожение) пируват вначале подвергается декарбоксилированию, в результате чего образуется ацетальдегид. Данная реакция катализируется ферментом пируватдекарбоксилазой, который требует наличия ионов М§ и кофермента тиаминпирофосфата (ТПФ):

Затем образовавшийся ацетальдегид присоединяет к себе водород, отщепляемый от НАДН2, восстанавливаясь при этом в этанол, реакция катализируется ферментом алкогольдегидрогеназой.
 О НАДН2 НАД
О НАДН2 НАД




 СН3 С Н СН3 СН2ОН
СН3 С Н СН3 СН2ОН
Алкогольдегидрогеназа
Таким образом, конечными продуктами спиртового брожения являются этанол и СО2, а не молочная кислота, как при гликолизе.
Процесс молочнокислого брожения имеет большое сходство со спиртовым брожением. Отличие заключается лишь в том, что при молочнокислом брожении пировиноградная кислота не декарбоксилируется, а, как и при гликолизе в животных тканях, восстанавливается при участии ЛДГ за счет водорода НАДН2.
Известны две группы молочнокислых бактерий. Одни из них в процессе брожения углеводов образуют только молочную кислоту, другие из каждой молекулы глюкозы «производят» по одной молекуле молочной кислоты, этанола и CO2.
Существуют и другие виды брожения; конечными продуктами при этом могут являться пропионовая, масляная и янтарные кислоты; а также другие соединения.
Включение других углеводов в процесс гликолиза
ФРУКТОЗА.
Установлено, что фруктоза, присутствующая в свободном виде во многих фруктах и образующаяся в тонком кишечнике из сахарозы, всасываясь в тканях, может подвергаться фосфорилированию во фруктозо-6-фосфат при участии фермента гексокиназы и АТФ.
АТФ АДФ

 Фруктоза Фруктозо-6-фосфат
Фруктоза Фруктозо-6-фосфат
Эта реакция ингибируется глюкозой. Образовавшийся фруктозо-6-фосфат либо превращается в глюкозу через стадии образования глюкозо-6-фосфата и последующего отщепления фосфорной кислоты, либо подвергается дальнейшим превращениям. Из фруктозо-6-фосфата под влиянием 6-фосфофруктокиназы и АТФ образуется фруктозо-1,6-бифосфат.
 АТФ АДФ
АТФ АДФ
 Фруктозо-6-фосфат Фруктозо-1,6-бифосфат
Фруктозо-6-фосфат Фруктозо-1,6-бифосфат
Фосфофруктокиназа
Далее фруктозо-1,6-бифосфат может подвергаться дальнейшим
превращениям по пути гликолиза. Таков главный путь включения фруктозы
в мышечной ткани, почках, жировой ткани.
В печени, однако, для этого существует другой путь. В печени имеется
фермент фруктокиназа, который катализирует фосфорилирование фруктозы
не по 6-му, а по 1 -му атому углерода.
 АТФ АДФ
АТФ АДФ
 Фруктоза Фруктозо-1 -фосфат
Фруктоза Фруктозо-1 -фосфат
Фруктокиназа
Эта реакция не блокируется глюкозой. Образовавшийся фруктозо-1-фосфат расщепляется затем под действием кетозо-1-фосфатальдолазы на диоксиацетонфосфат и В-глицеральдегид.
Образовавшийся О-глицеральдегид под влиянием соответствующей киназы (триоксикиназы) подвергается фосфорилированию до глицеральдегид-3-фосфата. В этот же промежуточный продукт гликолиза переходит и диоксиацетонфосфат.
Существует врожденная аномалия обмена фруктозы, или эссенциальная фруктозурия, которая связана с врожденным недостатком фермента фруктокиназы, т.е. в организме не образуется фруктозо-1 -фосфат. В результате обмен фруктозы возможен только путем фосфорилирования до фруктозо-6-фосфата, но эта реакция тормозится глюкозой, вследствие чего фруктоза накапливается в крови. Почечный порог для фруктозы очень низок, поэтому фруктозурия обнаруживается уже при концентрации фруктозы в крови, равной 0,73 ммоль/л.
Рис. 5 Метаболизм фруктозы
1 - гексокиназа
2 - фосфофруктокиназа
3 - фруктозобифосфатальдолаза
4 - фруктокиназа
5 - кетозо- 1-фосфатальдолаза
6 - триокиназа
7 - глюкозофосфатизомераза
8 - глюкозо-6-фосфатаза
9 - триозофосфатизомераза

Галактоза.
Основным источником галактозы является лактоза пищи, которая впищеварительном тракте расщепляется до галактозы и глюкозы. Обмен галактозы начинается с превращения ее в галактозо-1-фосфат. Эта реакция катализируется галактокиназой с участием АТФ:
АТФ АДФ
 |
 Галактоза Галактозо-1-фосфат
Галактоза Галактозо-1-фосфат
Галактокиназа
В следующей реакции в присутствии УДФ-глюкозы фермент гексозо-1-фосфат-уридилтрансфераза катализирует превращение галактозо-1-фосфата в глюкозо-1-фосфат, одновременно образуется уридиндифосфатгалактоза (УДФ-галактоза)
Образовавшийся глюкозо-1-фосфат в дальнейшем либо переходит в глюкозо-6-фосфат и далее подвергается уже известным превращениям, либо под влиянием фосфатазы образует свободную глюкозу, а УДФгалактоза подвергается весьма своеобразной эпимеризации:
 УДФ-галактоза УДф-глюкоза
УДФ-галактоза УДф-глюкоза
УДФ-глюкозо-
Эпимераза
Затем УДф-глюкоза-пирофосфорилаза катализирует расщепление УДФ-глюкозы с образованием глюкозо-1-фосфата. О дальнейшей судьбе образовавшегося глюкозо-1-фосфата было сказано выше.
Среди патологических состояний, возникающих в результате нарушения обмена углеводов, важное место занимает галактоземия - рецессивно наследуемое заболевание. При этом заболевании общее содержание моносахаридов в крови повышается главным образом за счет галактозы, достигает 11,1 - 16,6 ммоль/л. Концентрация глюкозы в крови существенно не изменяется. Кроме галактозы, в крови накапливается также галактозо-1-фосфат. Галактоземия приводит к умственной отсталости и катаракте хрусталика. Возникновение данного заболевания у новорожденных связано с недостатком фермента гексозо-1-фосфат-уридилтрансферазы. С возрастом наблюдается ослабление этого специфического нарушения обмена углеводов.
Рис. 6 Метаболизм галактозы.

Глюконеогенез.
Глюконеогенез - синтез глюкозы из неуглеводных продуктов. Такими продуктами или метаболитами являются в первую очередь молочная и пировиноградная кислоты, гликогенные аминокислоты, глицерол и ряд других соединений. Иными словами, предшественниками глюкозы в глюконеогенезе могут быть пируват или любое соединение, превращающееся в процессе катаболизма в пируват или один из промежуточных продуктов цикла трикарбоновых кислот. У позвоночных наиболее интенсивно глюконеогенез протекает в клетках печени и почек (корковое вещество).
Большинство стадий глюконеогенеза представляет собой обращение реакций гликолиза. Только три реакции гликолиза (гексокиназная, фосфофруктокиназная и пируваткиназная) необратимы, поэтому в процессе глюконеогенеза на трех этапах используются другие ферменты. Рассмотрим путь синтеза глюкозы из пирувата.
Образование фосфоенолпирувата из пирувата. Синтез фосфоенолпирувата осуществляется в несколько этапов. Первоначально пируват под влиянием пируват-карбоксилазы и при участии С02 и АТФ карбоксилируется с образованием оксалоацетата.

 CH3 COOH
CH3 COOH


 C=O + CO2 + АТФ CH2 + АДФ + H3PO4
C=O + CO2 + АТФ CH2 + АДФ + H3PO4
 COOH Пируваткарбоксилаза C=O
COOH Пируваткарбоксилаза C=O
COOH
Пируват Оксалоацетат
Затем оксалоацетат в результате декарбоксилирования и фосфорилирования под влиянием фермента фосфоенолпируват-карбоксилазы превращается в фосфоенолпируват. Донором фосфатного остатка в реакции служит гуанозинтрифосфат (ГТФ):

 COOH CH2
COOH CH2



 CH2 CHO PO3H2
CH2 CHO PO3H2
 C=O Фосфоенолпируват- COOH
C=O Фосфоенолпируват- COOH
COOH карбоксикиназа
Оксалоацетат Фосфоенолпируват
В дальнейшем было, что в процессе образования фосфоенолпирувата участвуют ферменты цитоплазмы и митохондрий.
Первый этап локализуется в митохондриях. Пируваткарбоксилаза, которая катализирует эту реакцию, является аллостерическим митохондриальным ферментом. В качестве аллостерического активатора данного фермента необходим ацетил-КоА. Мембрана митохондрий непроницаема для образовавшегося оксалоацетата. Последний здесь же в митохондриях восстанавливается в малат.
Реакция протекает при участии митохондриальной НАД-зависимой малатдегидрогеназы. В митохондриях отношение НАДН2/НАД+ относительно велико, в связи с чем внутримитохондриальныи оксалоацетат
легко восстанавливается в малат, который легко выходит из митохондрии, проходя митохондриальную мембрану. В цитоплазме отношение НАДН2/НАД+ очень мало, и малат вновь окисляется в оксалоацетат при участии цитоплазматической НАД-зависимой малатдегидрогеназы.
Дальнейшее превращение оксалоацетата в фосфоенолпируват происходит в цитоплазме клетки.
Рис. 7 Образование фосфоенолпирувата из пирувата.

Превращение фруктозо-1,6-бифосфата во фруктозо-6-фосфат. Фосфоенолпируват, образовавшийся из пирувата, в результате ряда обратимых реакций гликолиза превращается во фруктозо-1,6-бифосфат. Далее следует фосфофруктокиназная реакция, которая необратима. Глюконеогенез идет в обход этой эндергонической реакции. Превращение фруктозо-1,6-бифосфата во фруктозо-6-фосфат катализируется специфической фосфатазой:
 Фруктозо-1,6-бифосфат + H2O Фруктозо-6-фосфат + Фн
Фруктозо-1,6-бифосфат + H2O Фруктозо-6-фосфат + Фн
Образование глюкозы из глюкозо-6-фосфата. В последующей обратимой стадии биосинтеза глюкозы фруктозо-6-фосфат превращается в глюкозо-6-фосфат. Последний может дефосфорилироваться (т.е. реакция идет в обход гексокиназной реакции) под влиянием фермента глюкозо-6-фосфатазы:
 |
Глюкозо-6-фосфат + Н2О Глюкоза + Фн
Рис. 8 Общая схема биосинтеза глюкозы из лактата.

Регуляция глюконеогенеза.
Важным моментом в регуляции глюконеогенеза является реакция, катализируемая пируваткарбоксилазой. Роль положительного аллостерического модулятора этого фермента выполняет ацетил-КоА. В отсутствие ацетил-КоА фермент почти полностью лишен активности. Когда же в клетке накапливается митохондриальный ацетил-КоА, биосинтез глюкозы из пирувата усиливается. Известно, что ацетил-КоА одновременно является отрицательным модулятором пируватдегидрогеназного комплекса. Следовательно, накопление ацетил-КоА замедляет окислительное декарбоксилирование пирувата, что также способствует превращению в глюкозу.
Вторым важным моментом в регуляции глюконеогенеза является реакция, катализируемая фруктозо-1,6-бифосфатазой - ферментом, который ингибируется АМФ. Противоположное действие АМФ оказывает на фосфофруктокиназу, т.е. для этого фермента он является аллостерическим активатором. При низкой концентрации АМФ и высоком уровне АТФ происходит стимуляция глюконеогенеза. Напротив, когда величина отношения АТФ/АМФ низка, в клетке наблюдается расщепление глюкозы.
В 1980 г. группой бельгийских исследователей (Г.Херс и соавт.) в ткани печени был открыт фруктозо-2,6-бисфосфат, который является мощным регулятором активности двух вышеперечисленных ферментов:

Фруктозо-2,6-бисфосфат активирует фосфофруктокиназу и ингибирует фруктозо-1,6-бифосфатазу. Повышение в клетке уровня фруктозо-2,6-бисфосфата способствует усилению гликолиза и уменьшению скорости глюконеогенеза.
При снижении концентрации фруктозо-2,6-бисфосфата отмечается обратная картина.
Установлено, что биосинтез фруктозо-2,6-бисфосфата происходит из фруктозо-6-фосфата при участии АТФ, а распадается он на фруктозо-6-фосфат и неорганический фосфат. Биосинтез и распад фруктозо-2,6- бисфосфата катализируется одним и тем же ферментом, т.е. данный фермент бифункционален, он обладает и фосфокиназной и фосфатазной активностями:
 АТФ АДФ
АТФ АДФ
 | |||
 |
Фруктозо-6-фосфат фосфокиназное действие Фруктозо-2,6-бисфосфат
 |
Н2О Фн
Показано также, что бифункциональный фермент в свою очередь регулируется путем цАМФ-зависимого фосфорилирования. Фосфорилирование приводит к увеличению фосфатазной активности и снижению фосфокиназной активности бифункционального фермента. Этот механизм объясняет быстрое действие гормонов, в частности глюкагона, на уровень фруктозо-2,6-бисфосфата в клетке.
Активность бифункционального фермента регулируется также и некоторыми метаболитами, среди которых наибольшее значение имеет глицерол-3-фосфат. Действие глицерол-3-фосфата на фермент по своей направленности аналогично эффекту, который наблюдается при его фосфорилировании с помощью цАМФ-зависимых протеинкиназ.
В настоящее время фруктозо-2,6-бисфосфат, помимо печени, обнаружен и в других органах и тканях животных, а также у растений и микроорганизмов.
Показано, что глюконеогенез может регулироваться и непрямым путем, т.е. через изменение активности фермента, непосредственно участвующего в синтезе глюкозы. Так, установлено, что фермент гликолиза пируваткиназа существует в двух формах: L и М. Форма L (от англ. liver - печень) преобладает в тканях, способных к глюконеогенезу. Эта форма ингибируется избытком АТФ и некоторыми аминокислотами, в частности анилином. М-форма (от англ. Muscle - мышца) такой регуляции не подвержена. В условиях достаточного обеспечения клетки энергией имеет место ингибирование L-формы пируваткиназы, и как следствие этого, гликолиз замедляется и создаются условия, благоприятствующие глюконеогенезу.
Заключение.
Таким образом, между гликолизом, интенсивно протекающем в мышечной ткани при ее активной деятельности, и глюконеогенезом, особенно характерным для печеночной ткани, существует тесная взаимосвязь. При максимальной активности мышц в результате усиления гликолиза образуется избыток молочной кислоты, диффундирующей в кровь, и в печени значительная его часть превращается в глюкозу (глюконеогенез). Образовавшаяся в печени глюкоза затем может быть использована как энергетический субстрат, необходимый для деятельности мышечной ткани.
Взаимосвязь между процессами гликолиза в мышечной ткани и глюконеогенезом в печени представлена на схеме:
Рис. 9 Взаимосвязь между гликолизом и глюконеогенеза.

Лекцию подготовил:
«____»_________________2008г. _________________________________
Date: 2016-08-29; view: 1250; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |