
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Добування вуглекислого газу
1. У промисловості при розкладі вапняку(крейди):
СаСО3 = СаО + СО2↑
2. У лабораторії із карбонатів металів з сильними кислотами:
СaСO3 + 2HCl = СаCl2 + H2СO3 (СO2 ↑ + H2O)
Затосування вуглекислого газу
1. для газування напоїв і вод;
2. при гасінні пожеж;
3. «сухий лід» для зберігання продуктів.
Карбонатна кислота
H2СО3 – це слабка кислота, двоосновна.
Хімічні властивості карбонатної кислоти
І. Загальні властивості як кислоти:
1. реакція дисоціація (cтупінчасто):
H2СО3 ↔ Н+ + НСО3-
HСО3- ↔ H+ + СО32-
2. реакція з металами до Н:
Mg + H2 СО3 = Mg СО3 + H2↑
З. реакція з оксидами металів:
Mg O + H2СО3= Mg СО3 + H2O
4. реакція з лугами ( утворюють кислу і середню сіль, бо двоосновна кислота):
Na OH + H 2СО3 = Na HСО3 + H2O
Натрій гідрогенкарбонат
2NaOH + H 2СО3 = Na2 СО3 + 2H2O
ІІ. Специфічна реакція:
1. розклад при звичайних умовах:
Н2СO3 ↔ СO2 + Н2О
Добування H2СО3
1. У промисловості і у лабораторії одержують реакцією:
СO2 + Н2О ↔ Н2СO3
Застосування карбонатної кислоти
1. для газування напоїв;
2. у вогнегасниках.
Солі карбонатної кислоти
Карбонатна кислота утворює два ряди солей: одну кислу і одну нормальну.
1. Гідрогенкарбонати:
NaHCO3 , Ca(HCO3)2, Al(HCO3)3
2. Карбонати:
Na2CO3, CaCO3, Al2(CO3)2
Хімічні властивості солей карбонатної кислоти
І. Загальні властивості як солей
1. реакція з сильними кислотами – це якісна реакція на карбонати і гідроген карбонати, бо утворюється газ, який дає помутніння «вапняної води» (СО2).
NaHCO3 + HCl = NaCl + H2СO3 (СO2 ↑ + H2O)
Na2СO3+ 2HCl = 2NaCl + H2СO3 (СO2 ↑ + H2O)
2.реакція з солями:
Na2СO3+ СаCl2 = 2NaCl + СаСO3 ↓
3. реакція з лугами:
Na2СO3+ Са(ОН)2 = 2NaОН + СаСO3↓
ІІ. Специфічні властивості.
1. розклад при нагріванні:
А) Гідрогенкарбонати
а) реакція розкладу гідрогенкарбонатів утворених тільки лужними металами:
2 NaHCO3 = Na2CО3 + H2СO3 (СO2 ↑ + H2O)
б) реакція розкладу гідроген карбонатів всіх інших металів:
Ca(HCO3)2 = СаО + 2СO2 ↑ + H2O
Б) Карбонати
а) реакція розкладу карбонатів тільки лужних металів не відбувається:
Na2СO3 ≠
б) карбонати всіх інших металів розкладаються на оксид металу і вуглекислий газ:
СаСО3 = СаО + СО2
Природні карбонати і гідроген карбонати
- СаСО3 - крейда, мармур, вапняк, ракушник; (у будівництві, виготовлення пам’ятників, одержання негашеного вапна, вуглекислого газу)
- Na2СO3∙10H2O - кристалічна сода
- Na2СO3 - кальцинована сода; (усунення твердості води, одержання звичайного скла, твердого мила)
- NaНСO3 - питна сода (як розпушувач у харчовій промисловості, у вогнегасниках, для пониження кислотності в шлунку)
- Ca(HCO3)2, Mg(HCO3)2 - визначають твердість води.
- СаСО3 ∙ MgCO3 - доломіт
Карбонати і гідрогенкарбонати переходять один в одного такими реакціями:
1. гідроген карбонати в карбонати:
2 NaHCO3 = Na2CО3 + СO2 ↑ + H2O
або
NaHCO3 + NaOH = Na2CО3 + H2O
2. карбонати в гідроген карбонати:
Na2CО3 + H2СO3 (СO2 ↑ + H2O) = 2NaНСO3
Силіцій і його сполуки
Атом Силіціюзнаходиться у ІV-А групі, на зовнішньому шарі в нього 4 електрони, найвища С.О. - +4, а найнижча - -4.
Атом Силіцію у формулах речовин має такі С.О.: -4, 0, +4.
Атом Силіцію подібно як «халькогени», Фосфор і Карбон утворюють декілька простих речовин (алотропія):
1. кристалічний кремній
2. пластичний кремній.
Всі алотропні модифікації Силіцію мають формулу - Si
У природі (на Землі) Силіцій на другому місці по розповсюдженості – 28%, а Оксисен - 49%.
Хімічні властивості кремнію
1. реакція з металами (тільки активними і при високих температурах):
Si0 + 2Са = Са2Si-4 кальцій силіцид
4Al + 3Si0 = Al4Si3-4 алюміній силіцид
Si0 – окисник
2. реакція з неметалами ( при високих температурах):
Si0 + O20 = Si+4O2 «пісок»
Si0 - відновник
Si + C = Si+4C-4 Cиліцій карбід (карборунд)
Si0 + 2Н2 ≠
3. реакція з лугами ( при температурі):
Si + 2NaOH + Н2О = Na2SiO3 + 2H2↑
Добування кремнію
1. реакція з магнієм:
SiО2 + 2Mg = 2MgO + Si
2. реакція з вугіллям (при температурі 2000оС)
SiО2 + 2С = 2СO + Si
Застосування кремнію
1. як напівпровідник;
2. для одержання жаро і кислотостійких сплавів;
3. для виробництва карборунду SiC – наждачний папір
(найтвердіший синтетичний кристал)
Гідрогенові сполуки Силіцію
Атом Силіцію утворює одну таку сполуку: SiH4 - cилан - це рідина, яка на повітрі самозагоряється: SiH4 + 2O2 = SiO2 + 2H2O/
Одержують силан реакцією: Mg2Si +4HOH = 2Mg(OH)2 + SiH4
Оксигенові сполуки Силіцію
Атом Силіцію утворює дві такі сполуки:
1. Si+2 O – силіцій (ІІ) оксид, - несолетвірний оксид
2. Si+4O2 - силіцій (ІV) оксид, «пісок» - кислотний оксид
Силіцій (ІV) оксид
Хімічні властивостіСиліцій (ІV) оксиду
SiO2 має атомну! кристалічну гратку.
І. Загальні властивості як кислотного оксиду.
1. реакція з водою(не взаємодіє):
SiO2 + Н2О ≠
2. реакція з лугами: ( може утворювати середні солі)
SiO2 + 2NaОH ↔ Na2SiO3 + H2O
ІІ. Характерні реакції.
1. реакція з тільки флюоридною(плавиковою) кислотою:
SiO2 + 4HF = SiF4↑ + 2Н2О
3. реакція з магнієм(тільки магній горить уСиліцій (ІV) оксид i):
SiО2 + 2Mg = 2MgO + Si
Силікатна (кремнієва)кислота
H2SiO3 – найслабша із всіх відомих кислот, а також нерозчинна у воді.
(кислота – неелектроліт!)
Хімічні властивості силікатної кислоти
І.Загальні властивості як кислоти
1. тільки реакція з лугами при нагріванні:
2NaOH + H2SiО3 = Na 2 SiО3 + 2H2O
ІІ. Специфічні властивості
1. реакція розкладу при нагріванні:
H2SiО3 = SiО2 + H2O
(«силікагель»(біле вугілля) - адсорбент газів і рідин як деревне вугілля)
Добування силікатної кислоти
У промисловості і у лабораторії одержують дією сильних кислот розчинні силікати:
Na2SiO3 +2HCl = 2NaCl + H2SiO3 ↓
Серед солей силікатної кислоти розчинні у воді тільки Na2SiO3 і К2SiO3 їх називають «розчинним склом»(входять до складу силікатного клею і у будівництві для захисту дерев’яних деталей споруд від руйнування)
Застосування сполук Силіцію
Найбільше в природі сполук Силіцію у вигляді піску, гірських порід, тому переробкою їх займається силікатна промисловість.
Основні її напрямки:
Виробництво скла.
Нагрівають суміш Na2CO3 , CaCO3, SiO2 (1:1: 6) до температури 15000С і відбувається реакція:
Na2CO3 + CaCO3 + 6SiO2 = Na2O + CaO + 2CO2↑ + 6SiO2
- звичайне(віконне і пляшкове) скло - Na2O∙CaO∙6SiO2
- тугоплавке скло - К2O∙CaO∙6SiO2
- кришталеве скло - К2O∙PbO∙6SiO2
2. керамічні вироби (вироби з білої і червоної глини).
3. виробництво цементу ( нагрівають суміш глини з крейдою – мергель – до 10000С)
Природні сполуки Силіцію
1. SiO2 - кремнезем(входить до складу піску), кварц, гірський кришталь;
2. Al2O3∙2SiO2 ∙2H2O - каолініт (складова частина білої глини, а червона глина містить домішки Fe2O3)
ІІІ. Органічна хімія
Вуглеводні
Тема 22.Насичені вуглеводні
Органічна хімія вивчає сполуки Карбону з іншими елементами. Крім Карбону до складу органічних речовин входять: Н, О, N, Галогени і ці елементи називають елементами - органогенами.
У 1861 році російський вчений О.М.Бутлеров сформулював основні положення теорії хімічної будови орг.речовин:
1. Атоми у молекулах орг. речовин розміщені не безладно, а у певній послідовності згідно їх валентності;
2. Властивості орг.речовин залежать не тільки від кількісного і якісного складу, а від послідовності сполучення атомів у молекулах;
3. Атоми або групи атомів в органічних сполуках взаємно впливають одна на одну і це відбивається на хімічних властивостях;
4. За будовою орг.сполук можна розпізнати їх властивості і навпаки за властивостями – будову.
Із першого положення теорії випливає, що елементи-органогени мають постійну валентність в органічних сполуках.
| |
- C - IV - ─C─ ─C═ ═ C═ ─C≡
|
Атом Карбону в органічних сполуках перебуває тільки у збудженому стані і на зовнішньому шарі містить 4 неспарені електрони(тому і чотиривалентний), а саме один (1)s-електрон і три (3)р-електрони.
+ 6 12С 1s22s12p3 збуджений стан

- H - I - H─
- O - II - O ═ ─ O ─
| |
- N - III - ─N─, N═, N≡
- Галогени: Сl, Br, I - I - Cl─, Br ─, I─
Органічні сполуки мають три види формул:
1. молекулярна (емпірична) – це формула в якій показано кількісний і якісний склад молекули.
Метан - СН4
Бензен - С6Н6
3. структурна – це формула в якій показано послідовність сполучення атомів у молекулах за допомогою валентностей (рисочок).
Н
|
метан Н ─C─ Н
|
Н
3. електронна - це формула в якій показано послідовність сполучення атомів у молекулах орг.сполук за допомогою спільних електронних пар.
Н
:
метан Н: C: Н
:
Н
Друге положення пояснює явище ізомерії – це явище існування кількох речовин, які мають однаковий кількісний і якісний склад тобто однакову молекулярну формулу, але відрізняються за послідовністю розміщення атомів у молекулах і тому мають різні хімічні властивості. Ці речовини називаються ізомерами.
С4Н10 С4Н10
1 2 3 4 1 2 3
СН3─СН2─СН2─СН3 СН3─СН─СН3
|
4СН3
н. – бутан ізобутан (2-метилпропан)
С2Н6О С2Н6О
СН3─СН2 ─О─Н СН3─ О ─ СН3
спирти етери
Вуглеводні
Вуглеводні – це орг.сполуки, що містять тільки атоми Карбону і Гідрогену.
Вуглеводні поділяються:
1. насичені;
2. ненасичені;
3. ароматичні.
Насичені вуглеводні
Насичені вуглеводні – це вуглеводні, в молекулах яких між атомами Карбону існує тільки одинарний зв’язок.
Насичені вуглеводні поділяються на:
1. алкани (парафіни)(метанові вуглеводні);
2. циклоалкани (циклопарафіни).
Алкани
Алкани – це насичені вуглеводні, які мають лінійний або розгалужений ланцюг з атомів Карбону.
Загальна формула алканів: СnH2n+2 де: n = 1,2,3 і т.д.
Найпростішим їх предстаником є метан – СН4 – Але існує і цілий ряд їх, який називають гомологічний ряд, а ці вуглеводні називають гомологами – це орг.сполуки, що мають одинакову будову, тобто однакове розміщення атомів у молекулах і однакові хімічні властивості, але відрізняються за складом на одну або де кілька СН2 груп. Група СН2 – називається гомологічна різниця.
Формули і назви алканів:
_С2Н6 1. СН4 - метан 6. С6Н14 - гексан
СН4 2.С2Н6 - етан 7. С7Н16 - гептан
СН2 3. С3Н8 – пропан 8. С8Н18 - октан
4. С4Н10 – бутан 9. С9Н20 - нонан
5. С5Н12 - пентан 10. С10Н22 - декан
Радикали алканів
Радикали – це нейтральні частинки, які утворюються, якщо від молекули відірвати тільки один атом Гідрогену.
Радикали алканів називають - алкіли. Назви алкілів походять від відповідних назв алканів із заміноюзакінчення ан на ил або іл
Назви алканів Назви алкілів
1. СН4 - метан СН3- - метил
2.С2Н6 - етан С2Н5- - етил
3. С3Н8 – пропан С3Н7- - пропіл
4. С4Н10 – бутан С4Н9- - бутил
і т.д.
Номенклатура алканів
Алгоритм
для складання назв розгалужених алканів за структурними формулами:
- Визначити (виокремити) найдовший карбоновий ланцюг – родоначальну структуру (головний ланцюг).
- Пронумерувати атоми Карбону родоначальної структури. При цьому нумерацію необхідно починати з того кінця до якого ближче замісники (розгалуження).
- До замісників відносяться:
- Окремі атоми ( галогени – Cl, Br, I), які можуть знаходитися як біля крайніх атомів, так і всередині родоначальної структури;
- Групи атомів – вуглеводневі радикали (CH3, C2H5, C3H7 і т.д.), які не можуть знаходитися як біля крайніх атомів, тільки всередині родоначальної структури, а також групи атомів (NO2), які можуть знаходитися як біля крайніх атомів, так і всередині родоначальної структури;
- У назві вуглеводню спочатку
наводяться назви замісників, приєднаних до родоначальної структури,
із вказівкою номера атома Карбону, до якого вони приєднані. Номери
атомів Карбону(локанти) відокремлюються від назв замісників дефісом.
- Якщо замісників декілька, то в назві вони наводяться в українському алфавітному порядку (за першими буквами їх назв). Якщо є декілька однакових замісників, то їхня назва вказується тільки один раз, а їхнє число вказується префіксами: ди(два), три(три), тетра(чотири), пента(п´ять) тощо й обов´язково цифрами(локантами) через кому вказується положення кожного з однакових замісників.
- В останню чергу записується назва алкану, що відповідає числу атомів Карбону в родоначальній структурі.
С2Н5
6 5 4 | 3 2 1
СН3─СН─СН─СН─СН─СН2
|| | |
СН3 СН3 СН3 Cl
4-етил-2,3,5-триметил-1-хлорогексан
6 7
С2Н5СН2─СН3
1 2 3 | 4 5 |
СН3─СН─СН─СН2─СН─СН3
|
СН3
3-етил-2,5-диметилгептан
Групи: СН3; С2Н5 ; Cl називаються замісниками або розгалуженням.
Цифри, які стоять у назвах вуглеводнів перед замісниками у родоначальній структурі (головний ланцюг атомів Карбону) називаються локантами.
Атоми Карбону алканів в родоначальній структурі ( головному ланцюзі)поділяються на:
1. первинні[ п.] (атом Карбону зв’язаний тільки з одним атомом Карбону у родоначальній структурі);
2. вторинні[ в.] (атом Карбону зв’язаний тільки з двома атомами Карбону у родоначальній структурі);
3. третинні[ т.] (атом Карбону зв’язаний тільки з трьома атомами Карбону у родоначальній структурі);
4. четвертинні[ ч.] (атом Карбону зв’язаний тільки з чотирьома атомами Карбону у родоначальній структурі);
Наприклад:
СН3СН3
п. т. т. | в. ч. | п.
СН3─СН─СН─СН2─С ─СН3
6 5 | 4 3 2│ 1
СН3 СН3
2,2,4,5-тетраметилгексан
Для всіх атомів Карбону в алканах характерна sp3-гібридизація – це означає, що взаємодіє одна s-електронна хмаринка і 3р-електронні хмаринки атома Карбону і утворюються чотири гібридизовані(одинакові) хмаринки:

Ці електронні хмаринки відштовхуються у просторі! атома Карбону і розміщуються під кутом 109028' до вершин тетраедра.
Між атомами С – С і С -Н виникає ковалентний зв’язок, який називають ще – σ(сигма) - зв’язком – це зв’язок, який утворюється між двома гібридизованими хмаринками атомів С ( С-С) або гібридизованою хмаринкою атома С і не гібридизованою хмаринкою атома Н (С-Н).
Віддаль між атомами Карбону (С-С) в алканах становить 0,154 нм.
Фізичні властивості алканів
Метан – бутан (СН4 – С4Н10) - гази
Пентан - С14Н30 - рідини
С15Н32 і вищі алкани - тверді речовини(парафін).
Хімічні властивості алканів
За хімічними властивостями алкани малоактивні сполуки завдяки
міцним σ - зв’язкам. Вони стійкі до дії кислот, лугів і окисників. Для алканів найбільш характерними будуть реакції заміщення атомів Н на одновалентні атоми або групи атомів, наприклад, галогени.
І. Реакції заміщення
1. реакція галогенування
Це взаємодія алканів з галогенами Cl2, Br2, I2 (тільки не з «хлорною» чи «бромною водою») і при цьому один або всі почергово атоми Н заміщуються на Галоген. Каталізатор – світло, опромінення.
СН4 + Cl2 → CH3Cl + HCl
хлорметан
CH3Cl + Cl2 → CH2Cl2 + HCl
дихлорметан
CH2Cl2 + Cl2 → CHCl3 + HCl
трихлорметан
CHCl3 + Cl2 → CCl4 + HCl
тетрахлорметан
C3H8 + Cl2 → C3H7Cl + HCl
або
C3H8 + 8Сl2 → C3Сl8 + 8HCl
На заміщення одного атома Н в алканах необхідно одна молекула галогену.
(Алкани не знебарвлюють«бромну воду»)
2. реакція нітрування або реакція Коновалова
Це реакція алканів з нітратною кислотою в присутності конц. сульфатної кислоти (як каталізатора) і при цьому тільки один атом Н в алканах заміщується на нітро-групу.
HNO3 - HO-NO2 – структурна формула нітратної кислоти
-NO2 - нітро-група
k. H2SO4
СН4 + HO-NO2 → CH3NO2 + H2O
ІІ. Реакція розкладу
1. реакція крекінгу
Це реакція розкладу алканів на менші алкани і алкени, починаючи з пропану
СН4 ≠; С2Н6 ≠
С3Н8 → СН4 + С2Н4
Пропан метан етен
2. реакція термічного розкладу
При температурі 10000С алкани розкладаються на вуглець і водень.
СН4 → С + 2Н2↑
С3Н8 → 3С + 4Н2↑
Виняток: тільки метан при температурі 15000С розкладається:
2СН4 → С2Н2 + 3Н2
Етин(ацетилен)
3. реакція дегідрування(дегідрогенізації)
Це реакція відщеплення молекули водню від алканів (починаючи з етану) і при цьому утворюється алкен і водень. Каталізатор – платина.
С2Н6 → Н2 + С2Н4
етен
ІІІ. реакція ізомеризації
Починаючи з бутану нормальні (лінійні) алкани перетворюються в розгалужені алкани і навпаки. Каталізатор – сполуки Алюмінію.
С4Н10 С4Н10
1 2 3 4 1 2 3
СН3─СН2─СН2─СН3 → СН3─СН─СН3
Н.-бутан |
4СН3 ізобутан
н. – бутан ізо бутан (2-метилпропан)
IV. реакція окиснення
1. реакція горіння (повне і неповне):
Внаслідок реакції повного горіння вуглеводнів утворюється завжди СО2 і Н2О.
C3H8 + 5О2 → 3CО2 + 4H2О повне окиснення
(2C3H8 + 7О2 → 6CО + 8H2О) неповне окиснення
(C3H8 + 2О2 → 3C + 4H2О) неповне окиснення
2C6H14 + 19О2 → 12CО2 + 14H2О
2. реакція окиснення розчином KMnO4
Алкани не окислюються розчином KMnO4 і не знебарвлюють його
Добування алканів
І. СН4
1. У промисловості одержують метан із природніх родовищ і реакцією:
С + 2Н2 → СН4
2. У лабораторії:
А) реакцією алюміній карбіду з водою або кислотами
Al4C3 +12H-OH → 3CH4 ↑ + 4Al(OH)3↓
або HCl
Б) реакцією натрій етаноату(ацетату) з NaOH:
CH3COONa +NaOH → CH4↑ + Na2CO3
ІІ. Загальні методи добування
1. Реакція В’юрца
Це реакція двох! однакових або різних моногалогеналканів з лужними металами при цьому утворюється алкан із більшою кількістю атомів Карбону і сіль.
2СН3Cl + 2Na → C2H6 + 2NaCl
C2H5Cl + 2Na + ClCH3 → C3H8 + 2NаСl
3. Реакція «водяного газу»
Суміш алканів можна одержати на основі «водяного газу»(суміш карбон(ІІ) оксиду і водню). Каталізатор Fe, Co і тиск.
nCO + (2n + 1)H2 → CnH2n + 2 + H2O
Застосування алканів
І. СН4 (рудниковий чи болотний газ)
1. як газоподібне паливо у промисловості та побуті і як газ-пальне для автомобілів;
2. для одержання розчинників, сажі, різних орг.сполук;
3. для різання та зварювання металів.
ІІ. Інші алкани
1. етан, пропан, бутан використовується для одержання пластмас, канчуків.
(пропан і бутан - у вигляді скрапленого газу в балонах і запальничках)
2. рідкі алкани (від пентану) використовуються як пальне для автомобілів – бензин і ДП;
3. тверді алкани використовуються для виготовлення парафінових свічок, а також в медицині;
4. суміш рідких і твердих алканів використовується для одержання мазей у лікувальних цілях.
Циклоалкани
Циклоалкани(циклопарафіни) – це насичені вуглеводні, які мають замкнутий ланцюг із атомів Карбону.
Загальна формула циклоаканів:: СnH2n де: n = 3,4,5,6 і т.д.
Назви циклоалканів походять від відповідних назв алканів, які мають таку ж кількість атомів Карбону, із додаванням префікса –цикло-

C3H6 C4H8 C6H12
Циклопропан циклобутан циклогексан

C5H10 циклопентан
Фізичні властивості циклоалканів
Циклопропан і циклобутан- гази,
Циклопентан і циклогексан- рідини
Хімічні властивості циклоалканів
Для циклоалканів як і для алканів найбільш характерні реакції типу заміщення, однак в циклоалканах гібридизований кут не відповідає 109028', в циклопропані - 600 , циклобутані – 900, циклогексані – 1200.Тому в циклоалканах є напруження у циклі, яке може привести до розриву циклу. Для циклоалканів ще характерними будуть реакції типу приєднання із розривом циклу.
І. Реакції заміщення
1. реакція галогенування (подібно як алкани)
C5H10 + Cl2 → C5H9Cl + HCl
хлороциклопентан
Виняток: циклопропан і циклобутан вступає в реакцію галогенування не як заміщення, а як приєднання і при цьому відбувається розрив циклу і по місцях розриву відбувається приєднання двох атомів галогенів.
C3H6 + Cl2 → ClСН2-СН2-СН2Cl
1,3-дихлоропропан
C4H8 + Cl2 → ClСН2-СН2-СН2-СН2Cl
1,4-дихлоробутан
(Циклоалкани не знебарвлюють«бромну воду» подібно як алкани)
2. реакція нітрування або реакція Коновалова( подібно як алкани)
k. H2SO4
С3Н6 + HO-NO2 → C3H5NO2 + H2O
нітроциклопропан
ІІ. Реакція розкладу
1. реакція термічного розкладу (подібно як алкани)
С3Н6 → 3С + 3Н2↑
2. реакція дегідрування(дегідрогенізації) (подібно як алкани)
С3Н6 → Н2 + С3Н4
циклопропен
Виняток: тільки циклогексан вступає реакцію дегідрування з утворенням бензену:
С6Н12 → С6Н6 + 3Н2
циклогексан бензен
ІІІ. реакція ізомеризації (починаючи з циклобутану)
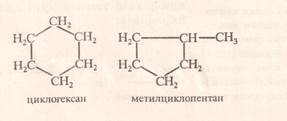
Циклогексан → метилциклопентан
IV. реакція окиснення
1. реакція горіння (повне і неповне):
Внаслідок реакції повного горіння вуглеводнів утворюється завжди СО2 і Н2О.
2C3H6 + 9О2 → 6CО2 + 6H2О повне окиснення
(C3H6 + 3О2 → 3CО + 3H2О) неповне окиснення
(2C3H6 + 3О2 → 6C + 6H2О) неповне окиснення
2C5H10 + 15О2 → 10CО2 + 10H2О
2. реакція окиснення розчином KMnO4
Циклоалкани не окислюються розчином KMnO4 і не знебарвлюють його.
V. Реакція приєднання
1. реакція гідрування(гідрогенізації)
Це реакція приєднання водню до циклоалканів і при цьому розривається цикл і по місцях розриву приєднуються два атоми Гідрогену і утворюється алкан
C3H6 + Н2 → СН3-СН2-СН3
Циклопропан пропан
Добування циклоалканів
І. Загальні методи добування
1. Реакція В’юрца
Це реакція ди галогеналканів (галогени знаходяться по двох крайніх атомах С) з лужними металами при цьому утворюється циклоалкан і сіль.
ClСН2-СН2-СН2Cl + 2Na → C3H6 + 2NaCl
1,3-дихлоропропан Са циклопропан
2. Циклогексан одержують гідруванням бензену
С6Н6 + 3Н2 → С6Н12
Бензен циклогексан
Застосування циклоалканів
1. циклопропан як засіб для наркозу;
2. циклогексан і циклопентан як розчинники і як сировина для одержання різних орг. речовин.
Тема 23. Ненасичені вуглеводні
Ненасичені вуглеводні - це вуглеводнів молекулах яких між атомами Карбону існує подвійний або потрійний зв’язок.
Ненасичені вуглеводні поділяються:
1. алкени(етиленові вуглеводні);
2. алкіни (ацетиленові вуглеводні).
Алкени
Алкени – це ненасичені вуглеводні в молекулах яких є тільки один подвійний зв’язок між атомами Карбону.
Загальна формула алкенів: СnH2n де: n = 2,3,4 і т.д.
Номенклатура алкенів
За міжнародною (систематичною або номенклатурою ІЮПАК) назви алкенів походять від відповідних назв алканів із заміною закінчення ан на ен.
За історичною номенклатурою назви алкенів походять від відповідних назв радикалів алканів з додаванням закінчення ен
С2Н4 С3Н6 С4Н8
СН2 = СН2 СН2 = СН – СН3 СН2 = СН - СН2 - СН3
Етен пропен бут-1-ен
Етил ен пропіл ен бутил ен
Радикали алкенів
Радикали алкенів називають - алкеніли.
Назви алкенів Назви алкенілів
С2Н4 - етен СН2 = СН - - етеніл або
СН2 = СН2 вініл
Ізомерія алкенів
Для алкенів характерні такі види ізомерії:
1. структурна ізомерія
А) ізомерія пов’язана із розміщенням подвійного зв’язку
(починаючи з бутену): С4Н8
СН2 = СН - СН2 - СН3 СН3 - СН = СН - СН3
Бут-1-ен бут-2-ен
Б) ізомерія пов’язана із розгалуженням, розміщенням замісників
(починаючи з бутену): С4Н8
СН2 = СН - СН2 - СН3 СН2 = СН - СН3
Бут-1-ен |
СН3
2-метилпроп-1-ен
Алгоритм
для складання назв розгалужених алкенів(алкінів) за структурними формулами:
- Визначити (виокремити) найдовший карбоновий ланцюг – родоначальну структуру (головний ланцюг), що містить кратний зв´язок
(подвійний чи потрійний).
- Пронумерувати атоми Карбону родоначальної структури. При цьому нумерацію необхідно починати з того кінця, до якого ближче кратний зв´язок.
- У назві вуглеводню спочатку
наводяться назви замісників, приєднаних до родоначальної структури,
із вказівкою номера атома Карбону, до якого вони приєднані. Номери
атомів Карбону(локанти) відокремлюються від назв замісників дефісом.
- Якщо замісників декілька, то в назві вони наводяться в українському алфавітному порядку (за першими буквами їх назв). Якщо є декілька однакових замісників, то їхня назва вказується тільки один раз, а їхнє число вказується префіксами: ди(два), три(три), тетра(чотири), пента(п´ять) тощо й обов´язково цифрами(локантами) через кому вказується положення кожного з однакових замісників.
- Після цього записується назва алкану (перший склад), що містить таке ж число атомів Карбону в родоначальній структурі.
- Потім вказують цифрою(локантом) атом Карбону родоначальної структури, до якого найближче розміщений кратний зв´язок, відокремлюючи двома дефісами (справа і зліва).
- В останню чергу записуємо закінчення – ен (ин).
6 7
С2Н5СН2 ─СН3
1 2 3 | 4 5 |
СН3─С=С─СН2─СН─СН3-
|
СН3
3-етил-2,5-диметилгепт-2-ен
2. геометрична, оптична (цис-, транс-) ізомерія (можлива !, починаючи з бут-2-ену, якщо подвійний зв’язок знаходиться в середині молекули, а не біля крайніх атомів Карбону)
Якщо розмістити атоми або групи атомів, які знаходяться біля двох атомів подвійногозв’язку, під кутом 1200 і провести горизонтальну вісь через атоми Карбону, якщо одинакові групи атомів будуть знаходитися по одну із сторін – це цис-ізомер, а якщо по різні – тран-ізомер.
Наприклад: СН3 - СН = СН - СН3 Бут-2-ен
СН3 Н Н Н
---- С = С ------ ----- С = С --------
Н СН3 СН3 СН3
Транс- бут-2-ен Цис- бут-2-ен
Цифри, які стоять у назвах вуглеводнів перед замісниками і перед розміщенням подвійного зв’язку називаються локантами.
Будова алкенів
Для двох атомів Карбону при подвійному зв’язку в алкенах характерна sp2-гібридизація – це означає, що із 4 електронів (1s і 3p) взаємодіє тільки одна s-електронна хмаринка і 2р-електронні хмаринки атома Карбону і утворюються три гібридизовані (одинакові) хмаринки:

Ці електронні хмаринки відштовхуються і розміщуються на площині! двох атомів Карбону і розміщуються під кутом 1200

Між атомами С – С і С -Н виникають – σ(сигма) - зв’язки.
Кожен із двох атомів Карбону при подвійному зв’язку ще має по одному не гібридизованому р-електрону(гантель), які розміщені перпендикулярно до площини. Р-електронні хмаринки перекриваючись над і під площиною утворюють ще один зв’язок – π(пі)- зв’язок (це зв’язок, який утворюється тільки між не гібридизованимир-електронними хмаринками атомів Карбону).
π- зв’язок є слабший за σ - зв’язки і легко може розірватися бо він розпорошений, утворюєься у двох точках простору.
Отже, подвійний зв’язок містить 1 σ(сигма) - зв’язок і 1 π(пі) - зв’язок.

Віддаль між атомами Карбону (С=С) в алкенах становить 0,134 нм.
Фізичні властивості алкенів
Етен – бутен (С2Н4 – С4Н8) – гази, нерозчинні у воді.
Хімічні властивості алкенів
Для алкенів найбільш характерними будуть реакції приєднання,
які відбуваються із розривом подвійного, а саме π - зв’язку і по місцях розриву приєднуються атоми.
І. Реакції приєднання
1. реакція гідрування
Це приєднання водню до молекули алкенів і утворюються алкани
СН2 = СН2 + Н2 → СН3- СН3
С2 Н4 + Н2 → С2Н6
2. реакція галогенування
Це приєднання галогенів Cl2, Br2, I2 (з «хлорною» чи «бромною водою») до алкенів.
C3H6 + Cl2 → C3H6Cl2
СН2 = СН – СН3 + Cl2 → СН2 - СН – СН3
| |
Cl Cl
1,2-дихлоропропан
(Алкени знебарвлюють«бромну воду» (із червоного на безбарвний) - це якісна реакція на ненасичені вуглеводні)
3. реакція гідрогалогенування
Це реакція приєднання до алкенів галогеноводнів (Hδ+Clδ-, Hδ+Brδ-, H δ+Iδ-)
СН2 = СН2 + HBr → СН3-СН2
|
Br
А гомологи етилену вступають в реакцію гідрогалогенування за правилом Марковникова: «Атом Н із галогеноводнів приєднується до того атома С при подвійному зв’язку де вже є більше атомів Н(більш гідрогенізований.)»
СН2 = СН – СН3 + НCl → СН3 - СН – СН3
|
Cl
2-хлоропропан
4. реакція гідратації
Це приєднання води до алкенів при цьому утворюються спирти
СН2 = СН2 + HОН → СН3-СН2
|
ОН спирт
Гомологи етилену вступають в реакцію гідратації за правилом Марковникова:
СН2 = СН – СН3 + Нδ+ОНδ- → СН3 - СН – СН3
|
ОН спирт
5. реакція полімеризації
Це сполучення великої кількості алкенів з утворенням однієї макромолекули полімеру
nСН2 = СН2 → (-СН2-СН2-)n
етилен поліетилен
nСН2 = СН – СН3 → (-СН2 - СН -)
пропілен |
CН3 поліпропілен
IІ. реакція окиснення
1. реакція горіння (повне і неповне):
Внаслідок реакції повного горіння вуглеводнів утворюється завжди СО2 і Н2О.(а при неповному окисненні - СО і Н2О або С і Н2О)
2C3H6 + 9О2 → 6CО2 + 6H2О
2. реакція окиснення розчином KMnO4
Алкени окиснюються розчином KMnO4 і знебарвлюють його(із фіолетового на безбарвний) – це якісна реакція на ненасичені вуглеводні.
СН2 = СН2 + Н2О + [О] → СН2 – СН2
розчин KMnO4 | |
ОН ОН етиленгліколь
Добування алкенів
І. С2Н4
1. У промисловості одержуютьреакцією дегідрування етану:
С2Н6 → С2Н4 + Н2
2. У лабораторії реакцією дегідратації етилового спирту в присутності конц. сульфатної кислоти:
C2H5 -OH → C2H4 ↑ + H2О
ІІ. Загальні методи добування
1. Реакція реакція дегідрогалогенування моногалогеналканів в присутності спиртового розчину лугу! ( відщеплення HCl, HBr, HI)
Спирт.р-н лугу
C2H5Cl → C2H4 + HCl або
C2H5Cl + NaOH → C2H4 ↑ + NaCl + Н2О
Застосування алкенів
І. С2Н4
1. для виробництва пластмас (поліетилену, поліпропілен);
2. для дозрівання овочів та фруктів;
3. для одержання розчинників, спиртів.
Алкіни
Алкіни – це ненасичені вуглеводні в молекулах яких є тільки один потрійний зв’язок між атомами Карбону.
Загальна формула алкенів: СnH2n-2 де: n = 2,3,4 і т.д.
Номенклатура алкінів
За міжнародною (систематичною або номенклатурою ІЮПАК) назви алкінів походять від відповідних назв алканів із заміною закінчення ан на ін або ин.
Історичну номенклатуру має тільки перший представник - С2Н2 – етин(ацетилен).
С2Н2 С3Н4 С4Н6
СН ≡ СН СН ≡ С – СН3 СН ≡ С - СН2 - СН3
Етин пропін бут-1-ин
ацетилен
5
С2Н5 СН3
1 2 3| 4 5 |6
СН≡С─СН─СН2─С─СН3
|
СН3
3-етил-5,5-диметилгекс-1-ин
Будова алкінів
Для двох атомів Карбону при потрійному зв’язку в алкінах характерна sp-гібридизація – це означає, що із 4 електронів (1s і 3p) взаємодіє тільки одна s-електронна хмаринка і 1р-електронні хмаринки атома Карбону і утворюються дві гібридизовані (одинакові) хмаринки:

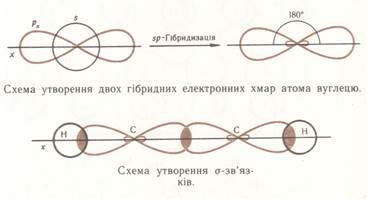
Ці електронні хмаринки відштовхуються і розміщуються на лінії! двох атомів Карбону і розміщуються під кутом 1800. Між атомами С – С і С -Н виникають – σ(сигма) - зв’язки.
Кожен із двох атомів Карбону при потрійному зв’язку ще має по два не гібридизованих р-електронів(гантель), які розміщені перпендикулярно до лінії. Р-електронні хмаринки перекриваючись над і під лінією, а також з тилу і фронту лінії утворюють два – π(пі)- зв’язки.

π- зв’язки є слабшими за σ - зв’язки і легко може розірватися бо вони розпорошені, утворюєься у двох точках простору.
Отже, потрійний зв’язок містить 1 σ(сигма) - зв’язок і 2π(пі) - зв’язки.
Віддаль між атомами Карбону (С-С) в алкінах становить 0,120 нм.
Фізичні властивості алкінів
Етин – бутин (С2Н2 – С4Н6) – гази, нерозчинні у воді. Працюючи з ацетиленом, його не можна подавати в реакційну суміш металічними трубками, а тільки трубками, виготовленими з гуми або скла, бо буде вибух.
Хімічні властивості алкінів
Для алкінів найбільш характерними будуть реакції приєднання,
які відбуваються із розривом потрійного, а саме поступовим розривом двох π - зв’язків. На відміну від алкенів до молекул алкінів приєднуються по дві молекули Н2, Cl2, HCl.
І. Реакції приєднання
1. реакція гідрування
СН ≡ СН + 2Н2 → СН3-СН3
С2 Н2 + 2Н2 → С2Н6
2. реакція галогенування
.
1. C3H4 + 2Cl2 → C3H4Cl4
СН ≡ С – СН3 + 2Cl2 → СНCl2 – СCl2 – СН3
1,1,2,2-тетрахлоропропан
(Алкіни знебарвлюють«бромну воду» - це якісна реакція на ненасичені вуглеводні)
3. реакція гідрогалогенування
Це реакція приєднання до алкенів галогеноводнів (HCl, HBr, HI)
СН ≡ СН + 2HBr → СН3-СН Br2
А гомологи ацетилену вступають в реакцію гідро галогенування за правилом Марковникова.
СН ≡ С – СН3 + 2НCl → СН3 - СCl2 – СН3
2,2-дихлоропропан
4. реакція гідратації або реакція Кучерова (тільки для ацетилену)
О
СН ≡ СН + HОН → СН3-С оцтовий альдегід
Н
5. реакція полімеризації
Тільки для ацетилену характерна реакція тримеризації:
3 С2Н2 → С6Н6
етин бензен
IІ. реакція окиснення
1. реакція горіння (повне і неповне):
Внаслідок реакції повного горіння вуглеводнів утворюється завжди СО2 і Н2О.
C3H4 + 4О2 → 3CО2 + 2H2О
2C3H4 + 5О2 → 6CО + 4H2О
C3H4 + О2 → 3C + 2H2О
2. реакція окиснення розчином KMnO4
Алкіни окислюються розчином KMnO4 і знебарвлюють його – це якісна реакція на ненасичені вуглеводні.
IІІ. Реакція заміщення (тільки для алкінів) – це якісна реакція на алкіни.
1. реакція алкінів з AgNO3 і Cu+1NO3:
Під час реакції тільки атоми Гідрогену при потрійному зв´язку заміщуються на одновалентні метали Ag, Cu і утворюються ацетиленіди металів (вибухові речовини). Вона характерна тільки для алкінів як ненасичених вуглеводнів (збільшується віддаль між С-Н, а віддаль між С≡С зменшується у порівнянні з (С=С) зв’язком)
СН ≡ СН + 2AgNO3 → СAg ≡ СAg ↓ + 2HNO3
Аргентум (І) ацетиленід
Добування алкінів
І. С2Н2
1. У промисловості одержуютьреакцією розкладу метану:
2СН4 → С2Н2 + 3Н2
2. У лабораторії реакцією кальцій карбіду з водою або кислотами
СаC2 +2H-OH → C2H2 ↑ + Са(OH)2↓
або HCl
(CaO +3C = CaC2 + CO - добування СаС 2)
ІІ. Загальні методи добування
1. Реакція реакція дегідрогалогенування дигалогеналканів ( два галогени можуть знаходитися біля одного атома Карбону або біля двох сусідніх атомів Карбону ) в присутності спиртового розчину лугу ( відщеплення HCl, HBr, HI)
Спирт.р-н лугу
СН2Cl- CH2Cl → CH≡CH + 2HCl
1,2-дихлороетан
СНCl2- CH3 → CH≡CH + 2HCl
1,1-дихлороетан
Застосування алкінів
І. С2Н2
1. для автогенного різання і зварювання металів (при згорянні ацетилену в кисні утворюється температура 28000С);
2. для одержання різних орг.сполук (розчинників, бензену, оцтового альдегіду).
3. для одержання вибухових речовин (ацетиленіди важких металів)
Тема 24. Ароматичні вуглеводні (арени)
Ароматичні вуглеводні – це вуглеводні в молекулах яких є цикл, який складається із 6(шести) атомів Карбону (бензенове ядро)
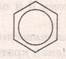
Найпростішим представником аренів є бензен, його формула – С6Н6. Вперше структурну формулу запропонував Кекуле
Формула Кекуле

Із формули видно, що кожен із 6 атомів Карбону перебуває в
sp2-гібридизації.

Кожен із 6 атомів С містить по одному не гібридизованому р-електрону, які розміщуються перпендикулярно до площини гібридизованих. Всі вони перекриваються над і під площиною шестикутника(бензенового ядра) і утворюють єдиний π-зв’язок, який складається із 6 електронів,що називається спряженням (вирівнювання). Доказом цього є те, що віддаль між атомами Карбону в бензеновому ядрі є одинакова і становить 0,140 нм.
Сучасна формула бензену,яка відповідає його будові:
або 
Номенклатура аренів
За міжнародною номенклатурою назви аренів походять від відповідних назв радикалів (замісників) з додаванням слова – бензен.
С6Н6 бензен

С6Н5-СН3 метилбензен (толуен)

С6Н4(СН3)2 1,2-диметил бензен (ксилен)

Date: 2016-07-25; view: 495; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |