
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Расчет значений рН и рОН в разбавленных растворах сильных и слабых кислот и оснований
Зная концентрацию разбавленных растворов кислот и оснований, можно рассчитывать величины водородного показателя (рН) и гидроксидного показателя (рОН), определяя тем самым активную реакцию среды.
1. В водных растворах сильных кислот (HNO3, HCl, H2SO4 и др.):

| (11) |
или

| (11´) |
где С(  к-ты) - молярная концентрация эквивалента кислоты (для одноосновных кислот она равна молярной концентрации кислоты);
к-ты) - молярная концентрация эквивалента кислоты (для одноосновных кислот она равна молярной концентрации кислоты);
 - кажущаяся степень диссоциации (в долях от единицы).
- кажущаяся степень диссоциации (в долях от единицы).
В предельно разбавленных водных растворах сильных кислот кажущаяся степень диссоциации  » 1, поэтому [Н+] практически равняется общей концентрации растворов этих кислот:
» 1, поэтому [Н+] практически равняется общей концентрации растворов этих кислот:


2. В растворах слабых кислот (H2CO3, HCN, СН3СООН и др.):

| (12) |
или

| (12´) |
где a - степень диссоциации в долях от единицы;
 - константа диссоциации кислоты (для многоосновных кислот, учитывают диссоциацию только по первой ступени);
- константа диссоциации кислоты (для многоосновных кислот, учитывают диссоциацию только по первой ступени);
 , pa и рС(
, pa и рС(  к-ты) - отрицательные десятичные логарифмы соответствующих величин.
к-ты) - отрицательные десятичные логарифмы соответствующих величин.
3. В водных растворах сильных оснований (NaOH, КОН, Са(ОН)2, Sr(OH)2 и др.):

| (13) |
где  С(
С(  осн) - молярная концентрация эквивалента основания (для однокислотных оснований она равна молярной концентрации основания);
осн) - молярная концентрация эквивалента основания (для однокислотных оснований она равна молярной концентрации основания);
В предельно разбавленных водных растворах сильных оснований кажущаяся степень диссоциации  » 1, поэтому [ОН-] практически равняется общей концентрации растворов этих щелочей:
» 1, поэтому [ОН-] практически равняется общей концентрации растворов этих щелочей:

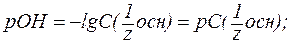

4. В растворах слабых оснований (NH3∙H2O):
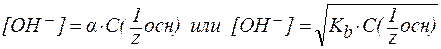 ; ;
| (14) |

| (14´) |

| (14´´) |
где  ‑ константа диссоциации основания.
‑ константа диссоциации основания.
Date: 2016-07-25; view: 616; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |