
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Ионное произведение воды. Водородный показатель
Вода относится к очень слабым амфотерным электролитам. Чистая вода в незначительной степени диссоциирует на ионы:
H2O ⇄ Н+ + ОН-.
В водном растворе ионы водорода не существуют в свободном состоянии, а образуют ионы гидроксония Н3О+. Поэтому более строгой является следующая запись процесса диссоциации воды:
2H2O ⇄ Н3O+ + ОН-.
Однако для простоты пишут Н+.
Применяя закон действующих масс, можно написать:
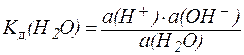 . .
| (1) |
 В чистой воде, и в разбавленных водных растворах кислот, гидроксидов и солей активность ионов (а) практически не отличается от концентрации, поэтому:
В чистой воде, и в разбавленных водных растворах кислот, гидроксидов и солей активность ионов (а) практически не отличается от концентрации, поэтому:
 . .
| (1¢) |
Так как степень диссоциации воды незначительная, то равновесную концентрацию недиссоциированных молекул воды [Н2О] можно считать постоянной и объединить ее с  (H2O) в одну величину
(H2O) в одну величину  :
:

| (2) |
Константу K W, равную произведению концентраций ионов Н+ и ОН-, называют ионным произведением воды.
Строго говоря, постоянной величиной является произведение не концентраций, а активностей ионов Н+ и ОН-:

| (3) |
Однако в разбавленных растворах, в которых коэффициенты активности близки к единице, этим различием при не очень точных расчетах можно пренебречь.
Величина  постоянна только при данной температуре. При увеличении температуры степень диссоциации воды возрастает (диссоциация воды ‑ процесс эндотермический), что приводит к повышению концентраций ионов Н+ и ОН-. Следовательно, повышение температуры увеличивает значение
постоянна только при данной температуре. При увеличении температуры степень диссоциации воды возрастает (диссоциация воды ‑ процесс эндотермический), что приводит к повышению концентраций ионов Н+ и ОН-. Следовательно, повышение температуры увеличивает значение  : при изменении температуры от 0 до 1000С оно возрастает приблизительно в 300 раз.
: при изменении температуры от 0 до 1000С оно возрастает приблизительно в 300 раз.
 (H2O) была определена методом электропроводности и при 220С ее величина составила 1,8×10-16. Этим же методом было установлено, что в одном литре воды (1000 г) на ионы диссоциирует 10-7 моль воды. Таким образом, из 55,6 моль
(H2O) была определена методом электропроводности и при 220С ее величина составила 1,8×10-16. Этим же методом было установлено, что в одном литре воды (1000 г) на ионы диссоциирует 10-7 моль воды. Таким образом, из 55,6 моль  , содержащихся в 1 л воды, только 10-7 моль находятся в диссоциированном состоянии. Следовательно:
, содержащихся в 1 л воды, только 10-7 моль находятся в диссоциированном состоянии. Следовательно:

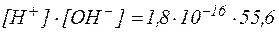

| (4) |
Таким образом, при температуре 20-250С ионное произведение воды  = 10-14, а показатель ионного произведения воды pK W = 14 (pK W = -lg K W = -lg10-14 = 14).
= 10-14, а показатель ионного произведения воды pK W = 14 (pK W = -lg K W = -lg10-14 = 14).
Так как в чистой воде и в разбавленных водных растворах кислот, оснований и солей величина K W постоянная, то концентрации ионов Н+ и ОН- являются величинами сопряженными, т. е. зависящими друг от друга.
Например, если в растворе при 20-250С [Н+] = 10-3 моль/л, то в этом же растворе:

В чистой воде при диссоциации ее молекул образуется одинаковое количество ионов Н+ и ОН-, следовательно, при 20-250С:
[H+] = [OH-] = 10-7 моль/л.
В водных растворах различных соединений в зависимости от соотношения концентраций ионов Н+ и ОН– реакция среды может быть:
нейтральная:
[H+] = [OH-] = 10-7 моль/л;
кислая:
[H+] > [OH-],
[H+] > 10-7 моль/л; [OH-] < 10-7 моль/л;
щелочная:
[H+] < [OH-],
[H+] < 10-7 моль/л; [OH-] > 10-7 моль/л.
На практике наиболее важное значение имеет активная реакция среды, определяемая активностью (концентрацией) ионов Н+ или ионов ОН-, содержащихся в данной среде (активная кислотность, активная щелочность).
Активную кислотность принято характеризовать отрицательным десятичным логарифмом активности (концентрации) ионов водо-рода - водородным показателем (рН):
 , ,
| (5) |
а для разбавленных растворов:
 . .
| (6) |
Водородный показатель (рН) - количественная характеристика активной кислотности.
Для количественной характеристики активной щелочности применяют гидроксидный показатель (рОН):
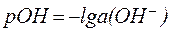 , ,
| (7) |
а для разбавленных растворов:
 . .
| (8) |
Если выражение K W = [Н+]×[ОН-] прологарифмировать (записать отрицательный десятичный логарифм левой и правой части), то получим:
 ,
,
иначе говоря:

| (9) |
Так как при t0 = 20-250С pK W = 14 (K W = 10-14), то при этой температуре:
| pH + pOH = 14 | (10) |
При помощи водородного показателя удобно выражать характер среды:
нейтральная среда: рН = 7 (рН = рОН),
кислая среда: рН < 7 (рН < рОН),
щелочная среда рН > 7 (рН > рОН).
Таким образом, увеличение концентрации ионов Н+ уменьшает рН (величина рОН при этом возрастает), а уменьшение концентрации ионов Н+ увеличивает рН (величина рОН при этом уменьшается). При сопоставлении значений pН разных растворов следует относить эти значения к одной и той же температуре.
В растворах кислот различают: активную кислотность, потенци-альную кислотность и общую кислотность.
Активная кислотность обусловлена наличием свободных ионов Н+ в растворе. Эта кислотность характеризуется определенным значением рН.
Потенциальная кислотность обусловлена наличием ионов Н+, связанных в молекулах кислот.
Общая кислотность - сумма активной ипотенциальной кислотностей.
В разбавленных растворах кислот, полностью диссоциированных на ионы, общая кислотность практически равна активной кислотности.
В растворах слабых кислот активная кислотность всегда меньше общей кислотности:
CH3COOH ⇄ Н+ + CН3COO-.
Шкала значений pH
 Таблица 3. Взаимосвязь концентраций ионов H+ и OH-.
Таблица 3. Взаимосвязь концентраций ионов H+ и OH-.
| рН | |||||||||||||||
[H  ], моль/л ], моль/л
| 100 | 10−1 | 10−2 | 10−3 | 10−4 | 10−5 | 10−6 | 10−7 | 10−8 | 10−9 | 10−10 | 10−11 | 10−12 | 10−13 | 10−14 |
[OH  ], моль/л ], моль/л
| 10−14 | 10−13 | 10−12 | 10−11 | 10−10 | 10−9 | 10−8 | 10−7 | 10−6 | 10−5 | 10−4 | 10−3 | 10−2 | 10−1 | 100 |
| рОН |
Date: 2016-07-25; view: 761; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |