
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Кинетика равновесных процессов
С течением времени скорость любой реакции, измеряемая по убывающим концентрациям исходных веществ, уменьшается, так как по мере взаимодействия веществ их концентрации уменьшаются. Если реакция является обратимой, то одновременно с уменьшением концентраций исходных веществ и, следовательно, с уменьшением скорости прямой реакции будет увеличиваться скорость обратной реакции, так как увеличиваются концентрации продуктов реакции.
Так, для гомогенной реакции:
aA + bB ⇄ cC + dD,
скорость прямой реакции: 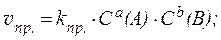
скорость обратной реакции: 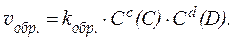
Как только скорости обеих реакций становятся одинаковыми, в системе устанавливается динамическое равновесие и дальнейшее изменение концентрации всех участвующих в реакции веществ прекращается.
Таким образом, в состоянии химического равновесия мы имеем:
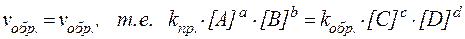
Данное соотношение можно преобразовать следующим образом:
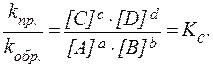
Полученная формула показывает, что при обратимых реакциях равновесие наступает тогда, когда отношение произведения равновесных концентраций образующихся веществ к произведению равновесных концентраций вступающих в реакцию веществ, взятых в степенях, соответствующих стехиометрическим коэффициентам, станет равно некоторой постоянной для данной реакции величине. Эта величина Кс – константа химического равновесия, заменяющая собой отношение двух постоянных величин kпр. и kобр.. Данная связь константы равновесия с равновесными концентрациями представляет собой выражение закона действующих масс для равновесных систем.
В случае гетерогенных реакций в выражение константы химического равновесия, так же, как и в выражение закона действующих масс для скорости химической реакции, не входят концентрации веществ, находящихся в твердой фазе.
Например:
3Fe(тв.) + 4H2O(пар) ⇄ Fe3O4(тв.) + 4H2(газ),
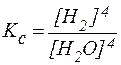
Для реакций, протекающих между газами, константа равновесия может быть выражена через парциальные давления газов p:

Например:
2NO + O2 ⇄ 2NO2,
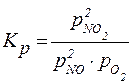
Несложно видеть, что между константой равновесия, выраженной через равновесные концентрации (Kc) и константой равновесия, выраженной через парциальные давления (Kp) существует взаимосвязь:
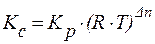
где Dn – разность числа молекул между левой и правой частями уравнения.
Отметим основные свойства константы равновесия:
1. Численное значение константы равновесия зависит от природы реагирующих веществ и от температуры, но не зависит от концентраций реагентов (парциальных давлений для газофазных реакций).
2. Катализатор не влияет на величину константы равновесия. Присутствие катализатора в системе лишь приближает момент наступления равновесия.
3. Численное значение константы равновесия при стандартных условиях можно найти из термодинамических данных, не проводя химических экспериментов. Действительно, по уравнению:

величину K можно вычислить из табличных данных DH0 и DS0:
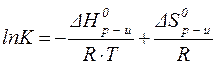
4. Величина K никогда не бывает равной нулю или бесконечности, т.е., для любой реакции выход отличается от нуля, хотя положение равновесия может быть сильно сдвинуто в любую сторону.
Date: 2016-07-25; view: 382; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |