
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Групповой реагент, общие и фармакопейные реакции анионов III аналитической группы.
БИЛЕТ №9
1.Реакция при температуре 60°С протекает за 1 мин.30сек. За сколько времени закончится эта реакция при температуре 80°С, если в данном интервале температурный коэффициент (у) равен 3?
Решение: в соответствии с правилом Вант-Гоффа при увеличении температуры от 60°С до 80°С скорость реакции возрастает:
 =
=  ,
,  = 32=9
= 32=9
Увеличивается в 9 раз.
2) скорость реакции обратно пропорциональна времени реакции. Следовательно:
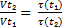 , или τ(t₂)= τ(t₁)*
, или τ(t₂)= τ(t₁)* 
Где τ(t₁) и τ(t₂) – время реакции при температурах t1 и t2. Учитывая, что τ(t₁)= 90 сек. (1мин. 30 сек.), определяем время реакции при температуре t2: τ(t₁)= 90 сек* 1/9= 10 сек. Ответ: 10 сек.
2.Напишите характерные реакции на ион K+.
Реакция окрашивания пламени.
Летучие соли калия окрашивают бесцветное пламя горелки в фиолетовый цвет
Винная кислота Н2С4Н4О6 при достаточной концентрации ионов К+ в растворе дает белый кристаллический осадок гидротартрата калия
KCl + Н2С4Н4О6 = KHC4H4O6↓ + HCl
K+ + HC4H4O6- = KHC4H4O6↓
Гексанитритокобальтат (III) натрия Na3 [Co(NO2)6] осаждает из нейтрального или слабокислого раствора желтый кристаллический осадок гексанитритокобальтата (III) калия-натрия:
Na3 [Co(NO2)6] +2KCl = K2 Na [Co(NO2)6]↓ + 2NaCl
2K+ + Na+ + [Co(NO2)6]3- = K2Na[Co(NO2)6]↓
Микрокристаллоскопическая реакция – нитрит натрия – свинца (II) Na2PbCu (NO2)6, реагирует с солями калия в нейтральной среде, образуя характерные кубические кристаллы коричневого или черного цвета:
2KCl + Na2PbCu(NO2)6 = K2PbCu(NO2)6↓ + 2NaCl
Групповой реагент, общие и фармакопейные реакции анионов III аналитической группы.
Группового реагента нет
Реакция нитрит-иона NO2-
Разбавленная серная кислота разлагает все нитриты на холоде с выделением бурого газа – оксида азота (IV):
NaNO2 + H2SO4 = NaHSO4 + HNO2
2HNO2 = NO2↑ + NO↑ + H2O
2NO + O2 = 2NO2↑
(из воздуха)
Реакция является фармакопейной.
Реакция нитрат-иона NO3-
Сульфат железа (II) FeSO4 окисляется азотной кислотой или ее солями с выделением оксида азота (II)NO. Реакция проходит в присутствии концентрированной серной кислоты:
2NaNO3 + 6FeSO4 + 4H2SO4 + 3Fe2(SO4)3 + Na2SO4 + 2NO↑ + 4H2O
Оксид азота (II) образует с FeSO4 бурое соединение:
FeSO4 + NO = [Fe(NO)]SO4
Несмотря на то, что вследствие реакции образуется то же соединение, что и при реакции иона NO2, можно различить эти ионы.
Если неизвестно, нитрат или нитрит находится в растворе, необходимо сначала провести реакцию с разбавленной серной кислотой. Образующееся бурое соединение подтверждает присутствие NO2.
Реакция ацетат-иона СН3СОО-
Серная кислотаH2SO4 вытесняет уксусную кислоту из ее солей, о чем свидетельствует характерный запах, особенно при нагревании:
2CH3COONa + H2SO4 = 2CH3COOH + Na2SO4
Реакция является фармакопейной.
4.Образуйте заданную комплексную частицу в соединение и укажите для него:
- внешнюю координационную сферу;
- внутреннюю координационную сферу;
- комплексообразователь;
- лиганды;
- координационное число;
- назвать полученные соединения.
[Fe(CN)6]*,где Fe2+
-Внутренняя координационная сфера- [Fe(CN)6]
-Комплексообразователь-Fe2+
-Лиганды-CN-
-КЧ-6
-гексацианоферрат (2)…
5.Составьте уравнения гидролиза солей:
Al2S3, NH4Cl, СH3COONa, СH3COONH4, Cu(NO3)2, K2CO3,
| <== предыдущая | | | следующая ==> |
| Финансовое обеспечение стратегических решений | | | Программно-целевой подход в управлении. |
Date: 2016-07-22; view: 321; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |