
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Групповой реагент, общие и фармакопейные реакции анионов I аналитической группы.
БИЛЕТ №16
1.Определите температурный коэффициент скорости реакции если при понижении температуры на 45°С реакция замедлилась в 25 раз.
Решение: в соответствии с правилом Вант-Гоффа при уменьшении температуры на 45°С скорость реакции понижается:
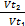 =
= 
V2=V1* γ ^((T2-T1)/10)
γ =(V2/V1)^(10/(T2-T1))=(1/25)^(10/(-45))=0,04^(-0,22)=2,03
Ответ: 2,03.
2.Напишите характерные реакции на ион Br-.
Реакция с нитратом серебра (фармакопейная).
NaBr + AgNO3 = AgBr↓ + NaNO3
Ag+ + Br- = AgBr↓
дает желтовато-белый осадок бромида серебра.
Осадок не растворяется в азотной кислоте, плохо растворим в аммиаке, в отличие от хлорида серебра и хорошо растворяется в растворе тиосульфата натрия:
AgBr + Na2S2O3 = NaBr + Na[Ag(S2O3]
Реакция с сильными окислителями (фармакопейная). Сильные окислители (KMnO4, KBrO3, NaClO, хлорамин и др.) в кислой среде окисляют бромид-ионы до молекулярного брома, например:
10Br - + 2MnO4- + 16H+ → 5Br2 + 2Mn2+ +8H2O
5Br - + BrO3- + 6H+ → 3Br2 + 3H2O
Образующийся молекулярный бром придает раствору бурую окраску.
Групповой реагент, общие и фармакопейные реакции анионов I аналитической группы.
Групповой реагент – раствор BaCl2
Реакции сульфат-иона SO42-
Хлорид бария BaCl2 осаждает из разбавленных растворов сульфатов белый осадок сульфата бария:
BaCl2 + Na2SO4 = BaSO4↓ + 2NaCl
Ba2+ + SO42- = BaSO4↓
Сульфат бария нерастворим в кислотах. Этим он отличается от других бариевых солей анионов первой группы. Реакция является фармакопейной.
Реакция фосфат-иона РО43-
1. Хлорид бария BaCl2 выделяет из нейтральных растворов белый аморфный осадок гидрофосфата бария:
Na2HPO4 + BaCl2 = BaHPO4↓ + 2NaCl
HPO42- + Ba2+ = BaHPO4↓
Осадок растворим в минеральных кислотах (кроме серной) и в уксусной кислоте.
Если проводить реакцию в слабощелочной среде или с раствором соли Na3PO4, выделяется осадок Ba3(PO4)2↓
3Ba2+ + 2PO43- = Ba3(PO4)2↓
2. Нитрат серебра AgNO3дает с фосфатом-ионом желтый осадок фосфата серебра, легко растворимый в азотной кислоте и в растворе аммиака. Полное осаждение возможно только в нейтральной или щелочной среде:
Na3PO4 + 3AgNO3 = AgPO4↓ + 3NaNO3
PO43- + 3Ag+ = AgPO4↓
Реакция является фармакопейной.
Реакции карбонат-иона СО22-
1. Хлорид бария BaCl2 из растворов карбонатов осаждает на холоде белый осадок карбоната бария:
BaCl2 + Na2CO3 = BaCO3↓ + 2NaCl
Ba2+ + CO32- = BaCO3↓
Осадок легко растворим в разбавленных хлороводородной, азотной и в уксусной кислотах. При кипячении кристаллизуется и становится более плотным.
2. Кислоты разлагают все карбонаты с бурым выделением оксида углерода (IV):
Na2CO3 + 2HCl = 2NaCl + CO2↑ + H2O
CO32- + 2H+ = H2O + CO2↑
Реакция является фармакопейной.
4.Образуйте заданную комплексную частицу в соединение и укажите для него:
- внешнюю координационную сферу;
- внутреннюю координационную сферу;
- комплексообразователь;
- лиганды;
- координационное число;
- назвать полученные соединения.
[Cu(NH3)4]*, где Cu2+
- внутренняя координационная сфера [Cu(NH3)4]*
- комплексообразователь Сu2+
- лиганды (NH3)
- КЧ = 4
5.Составьте уравнения гидролиза солей:
NaNO3, NH4Cl, (NH4)2SO4, FeCl3, Rb2SO3, Cu(NO3)2,
Date: 2016-07-22; view: 1082; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |