
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

электролиз на ртутном катоде.
3-ая группа:
Методы разделения, основанные
на удалении одного из компонентов в виде газа.
Эта группа методов имеет важное, хотя и ограниченное значение. Сюда относятся определения влаги в различных материалах, карбонатов отгонкой СО2, а также отделение кремния в виде фторида и др.
Каждая из названных групп методов может включать как химические, так и физические методы концентрирования.
Различают абсолютное концентрирование и относительное концентрирование.
Абсолютное концентрирование - это перевод микрокомпонента из большой массы (или большого объема) образца в малую массу (или в малый объем). При этом повышается концентрация микрокомпонента.
Относительное концентрирование (обогащение) - это увеличение отношения между количествами микрокомпонента и макрокомпонента.
К числу наиболее распространенных методов разделения и концетрирования относятся следующие:
Методы испарения (упаривание, перегонка, сублимация) основы, в которой содержится концекrpируемый компонент. Обычно различают упаривание и выпаривание.
Упаривание - испарение основы, при котором часть ее остается в системе по окончании процесса испарения. Выпаривание (досуха) - испарение основы, при котором последняя удаляется полностью.
Сублимация (или возгонка) – процесс непосредственного перехода твердого вещества в газообразное состояние, минуя жидкую фазу. Обратный процесс – переход газообразного вещества в твердую фазу (минуя жидкую) – называют десублимацией.
Испарение (отгонка) – переход вещества из жидкого или твердого состояния в газообразное (парообразное).
Дистилляция. Методы дистилляции основаны на разной летучести веществ. Вещество переходит из жидкого состояния в газообразное, а затем конденсируется, образуя снова жидкую или иногда твердую фазу.
Простая отгонка (выпаривание) – одноступенчатый процесс разделения и концентрирования.
› Озоление - метод, при котором исходный анализируемый материал путем термической обработки на воздухе превращают в минеральный остаток - золу. Применяют тогда, когда определяемый компонент (например, металлы-микроэлементы) распределен в большой массе сгораемой основы. Метод часто используют при анализе растительного лекарственного сырья - осторожно сжигают на воздухе сухую массу сырья.
Метод осаждения – наиболее простой классический метод разделения, основанный на равновесии между твердой и жидкой фазами.
Соосаждение – это распределение микроэлемента между раствором (жидкая фаза) и осадком (твердая фаза), причем микрокомпонент не образует в данных условиях собственной твердой фазы.
Кристаллизация - метод, применяемый для концентрирования примесных веществ (например, так называемый метод зонной плавки).
Экстракция – это метод разделения и концентрирования веществ, основанный на распределении вещества между двумя несмешивающимися фазами, чаще всего между двумя жидкостями (обычно между водой и органическим растворителем).
15.Применение экстракции в аналит.химии.Принцип и некоторые основные понятия жидкостной экстракции.
Экстракция-это метод выделения,разделения и концентрирования веществ,основаный на распределении растворенного вещества между двумя несмешивающимися жидкими фазами(растворителями). Экстракционные методы используют при извлечении различных компонентов из растительного и минерального сырья, для выделения газов из металлов и сплавов при высоких температурах, для отделения одних компонентов раствора от других и т.д
В большинстве случаев в аналитике используют комбинацию двух контактирующих несмешивающихся жидких фаз - органический
растворитель и водный раствор разделяемых (извлекаемых) веществ. В таких случаях говорят о жидкостной экстракции.
Жидкостная экстракция основана на использовании различной способности веществ распределяться между двумя несмешивающимися контактирующими жидкими фазами, т.е. на их различной растворимости в этих жидких фазах. Жидкостную экстракцию можно использовать как для разделения, так и для концентрирования веществ. Экстракционные методы обладают рядом достоинств - это простота, доступность, избирательность, возможность работы как с большими, так и с очень малыми концентрациями, быстрота проведения операций, дешевизна оборудования и т.д.
Разработаны методики экстракции практически всех химических элементов (их соединений) из водной фазы в органическую.
Экстрагент - органический растворитель в индивидуальном состоянии или содержащий какие-либо реагенты, извлекающий (экстрагирующий) данное вещество из водной фазы.
Экстракционный реагент - составная часть экстрагента, взаимодействующая с извлекаемым веществом с образованием экстрагирующегося соединения.
Экстракт - отделенная жидкая органическая фаза, содержащая экстрагированное из водной фазы вещество.
Реэкстракция - процесс обратного извлечения вещества из экстракта в водную фазу.
Реэкстрагент - раствор реагента (обычно водный), используемый для извлечения вещества из экстракта.
Реэкстракт - отделенная водная фаза, содержащая вещество, извлеченное из экстракта
16.Экстракционное равновесие.Закон распределения Нернста-Шилова.Константа распределения.Коэффициент распределения.Степень извлечения.Фактор разделения двух веществ.Условия разделения двух веществ.
Под экстракционными равновесиями в аналитической практике понимают равновесия, которые устанавливаются при распределении вещества (или нескольких веществ) между двумя несмешивающимися жидкостями и, в частности, между водным раствором и несмешивающимся с ним органическим растворителем.
Коэффициент распределения D – отношение общей концентрации компонента (если вещество присутствует в различных химических формах) в органической и водной фазах при установившемся равновесии:
СåD=оргСå/водн.
Коэффициент распределения для каждой данной системы при постоянной температуре может изменяться в зависимости от концентрации извлекаемого компонента, а также оставаться практически неизменным в некоторых пределах концентраций.
А(водн) = А(орг) (9.3)
рассматривать в качестве химического равновесия, то это равновесие будет характеризоваться константой равновесия Р, равной 
где а(орг) и а(водн) - равновесные активности вещества А в органической и водной фазе соответственно. Величина Р в данном случае называется константой распределения (истинная термодинамическая), она постоянна при постоянной температуре для данной системы.
 Эта форма закона распределения
Эта форма закона распределения
Если в такую систему добавить третье вещество, растворимое в обеих жидкостях, то после достижения равновесия этот третий компонент распределится между обоими слоями, образуя растворы различной концентрации и отношение концентраций в обоих слоях будет постоянным при данной температуре. Это положение называют за коном распределения Нернста-Шилова.
Под степенью извлечения R понимают выраженное в процентах отношение суммарной массы (суммарного количества) экстрагируемого вещества в органической фазе к его общей массе (суммарному количеству) в обеих фазах:
 (9.9)
(9.9)
где  - соответственно количество данного вещества в орга-
- соответственно количество данного вещества в орга-
нической и водной фазах, моль;  - концентрации данного
- концентрации данного
вещества соответственно в органической и водной фазах, моль/л,  и
и  - объем жидкой органической и водной фаз.
- объем жидкой органической и водной фаз.
Фактор разделения S двух веществ. Условия разделения двух веществ. Под фактором разделения S двух веществ А и В подразумевают отношение коэффициентов распределения D(А) и D(B) этих двух
разделяемых веществ, причем обычно - большего коэффициента распределения к меньшему (так, чтобы S был > 1):
 (9.11)
(9.11)
При S(A/B) = 1 разделение двух веществ А и В невозможно. Разделение возможно, если соблюдаются следующие два условия:
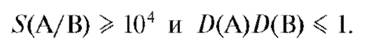
1) Пусть экстрагируются два вещества А и В, причем Vводн = Vорг, а D(А) = 1O4 и D(B) = 1O-1.
Тогда S(A/B) = D(A)/D(B) = 1O4/1O-1 = 1O5 > 1O4, т.е. первое условие выполняется. Однако произведение коэффициентов распределения D(A)D(B) = 1O4 1O-1 = 1O3 >1, т.е. второе условие не выполняется. Поскольку одно из условий не соблюдено, то полное разделение не осуществляется. Действительно, согласно (9.1O)

Следовательно, хотя вещество А извлекается практически полностью (на 99,99%), однако одновременно с ним извлекается и заметное количество вещества В (до ~9%), т.е. разделение двух веществ А и В экстракцией в данном случае неэффективно.
2) Пусть теперь D(A) = 1O2, D(B) = 1O-3 и, как и ранее, Vводн = Vорг. Тогда S(A/B) = D(A)/D(B) = 1O2/1O-3 = 1O5 > 1O4, т.е. первое условие выполнено. Далее D(A)D(B) = 1O2 • 1O-3 = 1O-1 < 1, т.е. и второе условие также соблюдается. Следовательно, разделение двух веществ А и В методом экстракции возможно. Действительно, в соответствии с (9.1O) имеем:
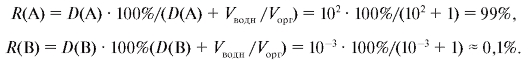
Таким образом, вещество А на 99%, а вещество В - только на O,1% перешли в органическую фазу, т.е. разделение проведено вполне удовлетворительно.
17.Хроматография,сущность метода.Классификация хроматографических методов анализа.
Хроматографией называется процесс, основанный на перемещении дискретной зоны вещества вдоль слоя сорбента в потоке подвижной фазы и связанный с многократным повторением сорбционных и десорбционных актов. (от греч. «хроматос» - цвет).
Хроматографический процесс осуществляется при сорбционном распределении вещества между двумя фазами, одна из которых перемещается относительно другой.
При анализе происходит разделение веществ между двумя фазами, одна из которых неподвижная (стационарная), а другая – подвижная. Подвижной фазой является сама анализируемая смесь (раствор или смесь газов), неподвижной – сорбент, взаимодействующий с компонентами смеси, или носитель, на который нанесены вещества, способствующие разделению.
Разделение наблюдается в том случае, если стационарная фаза проявляет различную сорбционную способность по отношению к компонентам определяемой смеси. Разная степень сорбции этих компонентов влияет на скорость их передвижения относительно неподвижной фазы и приводит к их пространственному разделению.
Классификация методов хроматографии:
К основным признакам классификации относятся:
1) агрегатное состояние фаз;
2) природа элементарного акта;
3) способ относительного перемещения фаз;
4) способ аппаратурного оформления процесса;
5) цель осуществления процесса.
По характеру взаимодействия разделяемых веществ с неподвижной фазой различают - адсорбционную, осадочную, распределительную и ионообменную хроматографию.
По способу проведения процесса – колоночную, бумажную и тонкослойную хроматографию.
По цели хроматографирования выделяют аналитическую хроматографию (качественный и количественный анализ); препаративную хроматографию (для получения веществ в чистом виде, для концентрирования и выделения микропримесей); промышленную (производственную) хроматографию для автоматического управления процессов. По агрегатному состоянию анализируемой смеси – жидкую и газовую хроматографию.
18.Адсорбционная хроматография.Тонкослойная хроматография.Сущность метода ТСХ.Коэффициент подвижности,относительны коэффициент подвижности,степень разделения.Материалы и растворители,применяемые в методе ТСХ.
Адсорбционная хроматография основана на избирательной адсорбции молекул. При выполнении анализа исследуемый раствор пропускают через хроматографическую колонку, заполненную адсорбентом (алюмогель Al2O3, силикагель SiO2, H2SiO3 и др.). Компоненты смеси поглощаются адсорбентом и располагаются послойно по всей длине колонки в соответствии с сорбционной способностью каждого компонента, происходит разделение смеси. Для более полного разделения через колонку пропускают растворитель.
В результате в колонке получают хроматограмму, на которой каждому компоненту соответствует определенная зона, расположенная тем ближе к началу колонки, чем больше сорбционная способность компонента.
Метод тонкослойной хроматографии (ТСХ) заключается в следующем. На небольшую стеклянную пластинку наносят тонкий слой твердого сорбента-носителя. На стартовую линию этого слоя (как и в бумажной хроматографии) помещают пробу. Край пластинки погружают в систему растворителей так, чтобы линия старта была несколько выше уровня растворителя. Отметив границу подъема жидкости, пластинку сушат и проявляют. На хроматограмме фиксируют зоны отдельных компонентов. Хроматограммы в тонком слое сорбента получают либо в закрепленном слое носителя, либо в незакрепленном.
В качестве сорбентов чаще всего применяют диоксид кремния силикагель SiО2 и оксид алюминия Al2О3, а также некоторые другие материалы (активированный уголь, сахарозу, карбонат кальция, целлюлозу, тальк, полиамидныe смолы и т. д.).
Для характеристики разделяемых компонентов в системе вводят коэффициент подвижности Rf (или Rf фактор):
Rf =V i /VE = (l I / t)/(L/ t)= l I / L, (1)
где V i = l I / t и VE = L / t - соответственно скорости перемещения i- гoкомпонента и растворителя Е; lI и L - путь, пройденный i- мкомпонентом и растворителем соответственно; t - время, необходимое для перемещения растворителя от линии старта до линии фронта растворителя.. Обычно коэффициент подвижности лежит в пределах Rf = 0-1. Оптимальное значение составляет 0,3-0,7.
Для нивелирования влияния условий проведения процесса вводят относительный коэффициент подвижности Rs:
Rs = l / lст = Rf / Rf(ст) (2)
где Rf = l / L; Rs = lст / L; l(ст) - расстояние от линии старта до центра пятна стандарта (см. рис. 6).
Относительный коэффициент подвижности Rs является более объективной характеристикой подвижности вещества, чем коэффициент подвижности Rf.
Для характеристики разделения двух компонентов А и В в данных условиях вводят степень (критерий) разделения R(A/В):
R(A/B) = ∆ l/[а(А)/2+ а(В)/2)] = 2∆l/[а(А) + а(В)], (3)
где ∆l - расстояние между центрами пятен компонентов А и В; а(А) и а (В) - соответственно диаметры пятен А и В на хроматограмме.
Материалы, применяемые в методе ТСХ. Сорбенты. Важнейшей характеристикой сорбента является его активность, т.е. способность сорбировать (удерживать) компоненты разделяемой смеси. В качестве сорбентов чаще всего применяют диоксид кремния - силикагель SiO2 и оксид алюминия А12O3, а также некоторые другие материалы (активированный уголь, сахарозу, карбонат кальция, целлюлозу, тальк, полиамидные смолы и т.д.).
Растворители. Выбор растворителя в методе ТСХ определяется природой сорбента и свойствами анализируемой смеси. Каких-либо строгих правил не существует. Обычно принимают во внимание общие практические рекомендации. Часто готовят смеси нескольких растворителей в качестве ПФ.
При выборе растворителей учитывают их элюирующую способность, т.е. способность вытеснять соединения, сорбированные на НФ. Она зависит от сочетания свойств растворителя и НФ. Существуют
элюотропные ряды для данного сорбента, облегчающие в какой-то мере выбор растворителя для ТСХ.
В качестве примера используемых в ТСХ смесей растворителей можно указать (в скобках указано объемное соотношение компонентов смеси):
- бутанол + уксусная кислота + вода (4:1:5);
- изопропанол + водный аммиак (7:3);
- 15% водный раствор уксусной кислоты;
- 3O% раствор ацетонитрила.
19.Распределительная хроматография.Бумажная хроматография.
Распределительная хроматография основана на явлении распределения компонентов анализируемой смеси между двумя несмешивающимися жидкостями.
Адсорбент-носитель, которым заполнена колонка, пропитывается растворителем (неподвижная жидкая фаза) и через колонку пропускается анализируемый раствор.
Затем через колонку очень медленно пропускают растворитель (подвижная жидкая фаза), не смешивающийся с первым.
В качестве неподвижных растворителей используют воду и другие полярные растворители. Неподвижную фазу наносят на гидрофильные носители: целлюлозу, силикагель, ионообменные смолы.
Бумажная хроматография является вариантом распределительной хроматографии, отличающаяся предельной доступностью и простотой выполнения, возможностью разделять микроколичества компонентов сложных смесей. В качестве носителя используют фильтровальную бумагу, очищенную от примесей, - хроматографическую бумагу разных марок. Из-за большой гигроскопичности ее волокна покрыты тонким слоем влаги, которая представляет собой неподвижную жидкую фазу. Техника выполнения бумажной хроматографии состоит в том, что на расстоянии 2-3 см от края бумажной полоски (стартовая линия) наносят каплю исследуемого раствора и после высыхания капли подвешивают эту полоску в стеклянную закрытую камеру.
Конец полоски хроматографической бумаги опускают на 0,5 см в слой органического растворителя ниже стартовой линии, которая играет роль подвижной фазы. Подвижный растворитель, перемещаясь вверх по бумаге, увлекает за собой отдельные компоненты анализируемой смеси, каждый из которых перемещается с определенной скоростью. Через некоторое время (от нескольких часов до суток) полученную хроматограмму вынимают из камеры, высушивают и «проявляют». Наличие тех или иных компонентов устанавливают по соответствующей окраске зон.
20.Осадочная хроматография.Сущность метода.Классификация способов осадочной классификации.
Осадочная хроматография основана на различной растворимости малорастворимых соединений. Для выполнения анализа колонку заполняют «носителем» алюмогелью, который смешивают или пропитывают осадителем, способным образовывать осадки с ионами анализируемой смеси.
На получаемой хроматограмме осадки располагаются в определенной последовательности, соответствующей увеличению их растворимости в направлении сверху вниз.
Если осадки бесцветны или слабо окрашены, хроматограмму проявляют.
различают колоночную осадочную хроматографию, проводимую в хроматографических колонках, и плоскостную осадочную хроматографию, реализуемую на бумаге или в тонком слое сорбента.
В качестве сорбентов в осадочной хроматографии применяют смеси инертных носителей с осадителем; сорбенты, удерживающие осадители в виде ионов (ионообменные смолы) или в виде молекул (активированный уголь);бумагу, пропитанную раствором осадителя.
Носителями чаще всего выбирают силикагелъ, крахмал, оксиды алюминия, кальция, сульфат бария, ионообменные смолы и т. д. Носитель используется в тонкодисперсном состоянии с размерами частиц около 0,02-0,10 мм.
В качестве осадителей применяют такие реагенты, которые образую малорастворимые осадки с хроматографируемыми ионами, например, иодид натрия NaI, сульфид натрия Na2S, сульфат серебра Ag2SО4, ферроцианид калия К4[Fe(CN)6l, оксихинолин, пиридин и т. д.
| <== предыдущая | | | следующая ==> |
| | | Основные идеи философии И. Канта |
Date: 2016-07-18; view: 361; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |