
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

П. Бретан-младший, М. Малоун СердечНО-СОСудиСТЫе Заболевания 1 page
 ТРАНСПЛАНТАЦИЯ ПОЧКИ
ТРАНСПЛАНТАЦИЯ ПОЧКИ
Сегодня трансплантация почки — главный и наиболее экономически эффективный метод лечения терминальной почечной недостаточности. За последние 10 лет отмечены огромные достижения в области и трансплантации почки, и диализа, но современные данные свидетельствуют, что существенно повысить качество жизни и заметно сократить частоту осложнений и смертность при терминальной почечной недостаточности позволяет только трансплантация почки. Последнее десятилетие, названное эпохой циклоспорина, сопровождалось бурным развитием трансплантологии. Сегодня в США ежегодно проводится более 10 тысяч трансплантаций почки. Однако число их, которое, скорее всего, будет расти, не столь важно: куда важнее дальнейшее увеличение частоты успешных трансплантаций, надеяться на которое позволяет появление новых методов хранения донорских органов и более совершенных иммунодепрессантов. Достижения последних лет отражают данные более чем о 5500 трансплантациях почки, проведенных в Калифорнийском университете (Сан-Франциско). Этот опыт, равно как и опыт других крупных центров трансплантологии, во многом повлиял на наши взгляды на хирургическое и медикаментозное лечение больных до и после трансплантации почки, которые изложены в этой главе.
ОТБОР И ПОДГОТОВКА
РЕЦИПИЕНТОВ
В США 36% случаев ХПН обусловлены сахарным диабетом, 30% — гипертоническим нефросклерозом, 24% — хроническим гломерулонефритом, 12% — аутосомно-до-минантным поликистозом почек. ХПН у детей и подростков, как правило (в 45% случаев), обусловлена пороками развития мочевых путей, в частности их обструкцией с гидронефрозом. Трансплантация почки при этих заболеваниях не противопоказана, но повышен риск послеоперационных осложнений и летального исхода. Абсолютные противопоказания к трансплантации почки, помимо острых инфекций и злокачественных опухолей, немногочисленны. Выживаемость реципиентов и трансплантатов возросли, а критерии отбора кандидатов на трансплантацию почки стали мягче. Подход к отбору кандидатов должен быть строго индивидуальным, и помимо возрастных ограничений (70 лет) следует учитывать прочие факторы (скажем, при продолжительности предстоящей жизни менее 5 лет, по-видимому, целесообразнее проводить диализ). Возможность трансплантации почки зависит от наличия факторов риска летального исхода и отторжения трансплантата. При выявлении таких факторов решить вопрос о трансплантации можно только после дополнительных исследований или лечения.
Больным с высоким риском ишемической болезни сердца (стенокардия в анамнезе, пожилой возраст, сахарный диабет и т. д.) проводят коронарную ангиографию. Неинвазивные исследования, например эхокардиогра-фия, тоже полезны, но по их данным невозможно определить, целесообразно проводить больному коронарное шунтирование или оно бесполезно либо сопряжено с высоким риском летального исхода. Успешное коронарное шунтирование, в свою очередь, существенно снижает риск летального исхода после трансплантации.
Злокачественные опухоли
Наличие злокачественной опухоли является абсолютным противопоказанием для трансплантации почки — иммуносупрессивная терапия после трансплантации нередко провоцирует прогрессирование. Срок проведения трансплантации после лечения по поводу злокачественной опухоли зависит от степени дифференциров-ки и стадии опухоли, т. е. от риска ее прогрессирования. При низком риске прогрессирования он составляет 1 —2 года, при высоком — 5—6 лет. Этот риск рассчитан на основании данных Трансплантологического реестра злокачественных опухолей за 1993 г. (табл. 37.1—37.3).
Таблица 37.1. Выявленные до трансплантации злокачественные опухоли с низким риском прогрессирования3
Число больных
Злокачественные Число с прогрессиро- Число
опухоли __________ больных ванием ________ умерших
Рак почки 59 0(0%) 0
Злокачественные 34 1 (3%) 0
опухоли яичка
Рак шейки матки 59 3 (5%) 2
Рак щитовидной 39 3 (8%) 1
железы
Лимфомы 29 3(10%) 2
а Все опухоли протекали бессимптомно, диагностированы случайно.
Таблица 37.2. Выявленные до трансплантации злокачественные опухоли с умеренным риском прогрессирования
Число больных с
Злокачественные Число прогрессирова- Число
опухоли __________ больных нием __________ умерших
Рактеламатки 19 2(11%) 2
Нефробластома 61 10(16%) 8
Рак толстой кишки 38 8(21%) 5
Рак предстательной 21 5(21%) 1
железы
Рак молочной железы 64 16(25%) 13
Глава 37. Трансплантация почки
 |
| трансплантации злокаче-риском прогрессирования |
Таблица 37.3. Выявленные до ственные опухоли с высоким
| Число больных с | |||
| Злокачественные | Число | прогрессирова- | Число |
| опухоли | больных | нием | умерших |
| Рак мочевого пузыря | 11(26%) | ||
| Саркомы мягких | 4(28%) | ||
| Меланома | 6 (30%) | ||
| Рак почки с клини- | 51 (30%) | ||
| ческими проявле- | |||
| ниями | |||
| Злокачественные | 49 (62%) | ||
| опухоли кожи (кро- | |||
| ме меланомы) | |||
| Миеломная болезнь | 7(88%) |
Прогрессирование в большинстве случаев возникает в первые два года после трансплантации (рис. 37.1). Если установлено, что его риск незначителен, трансплантация безопасна.
Вопрос о трансплантации почки у больного с объемным образованием в предстательной железе, повышением уровня ПСА или раком предстательной железы стадии А1 в анамнезе решают только после шеститочечной биопсии предстательной железы. Если уровень ПСА превышает 10 нг/мл или выявлен рак предстательной железы (кроме стадии А1), трансплантация почки, по-видимому, нецелесообразна.
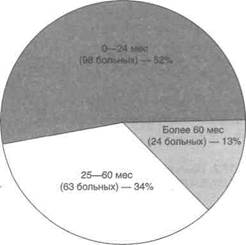
Рисунок 37.1. Частота прогрессирования злокачественных опухолей в зависимости от срока с момента начала их лечения до проведения трансплантации. Чем больше срок с момента начала лечения, тем ниже вероятность прогрессирования. Perm I: The effect of immunosuppression in pre-existing cancers. Transplantation 1993; 55:742.
Инфекционные болезни
Острая инфекция — абсолютное противопоказание к трансплантации почки. Важно отличать бессимптомную бактериурию от истинной инфекции — цистита, пиелонефрита или простатита. Устранить бессимптомную бактериурию легко: больному назначают антимикробные средства, а во время операции перед вскрытием мочевого пузыря его промывают антимикробным средством через трехканальный катетер Фоли. В сомнительных случаях, например при рецидивирующей инфекции мочевых путей неясной этиологии, решить вопрос о трансплантации почки можно только после полного урологического обследования. Инфекцию у ВИЧ-инфицированных всегда считают острой, и трансплантация почки им противопоказана в любом случае, поскольку после нее неминуемо развивается СПИД.
Системные и метаболические нарушения
При вирусных гепатитах (обнаружении антител к вирусу гепатита С или антигенов вируса гепатита В) в 2—3 раза повышен риск прогрессирующего цирроза печени и летального исхода от него. Вирусный гепатит считают относительным противопоказанием к трансплантации почки. Она допустима, если биохимическое исследование крови не выявляет изменений, а больной знает о возможных осложнениях и согласен на операцию. Аналогично целесообразность операции оценивают при прочих системных заболеваниях (болезни Фабри, цистинозе, васкулитах, СКВ, амилоидозе и первичной оксалурии): в каждом случае важно учесть тяжесть и распространенность патологии. Главное правило таково — трансплантация почки целесообразна, если польза от нее превосходит риск осложнений.
Болезни ЖКТ
При язвенной болезни трансплантацию почки можно ' проводить только вне обострения. В сомнительных случаях перед операцией проводят эзофагогастродуодено-скопию. Если клиническая картина либо исследование кала на скрытую кровь указывают на заболевание толстой кишки, выполняют ирригоскопию или колоноскопию для исключения рака и хронических воспалительных заболеваний кишечника. Больным с дивертикулитом в анамнезе после трансплантации почки показано наблюдение.
Заболевания мочевых путей и половых органов
Нарушения мочеиспускания и рецидивирующие инфекции мочевых путей в анамнезе служат показанием к микционной цистоуретрографии, которая позволяет выявить пузырно-мочеточниковый рефлюкс и оценить функцию нижних мочевых путей. При значительном
Глава 37. Трансплантация почки
 объеме остаточной мочи для исключения инфравези-кальной обструкции, гипоактивного мочевого пузыря, гиперактивности сфинктера мочеиспускательного канала проводят цистометрию и профилометрию. При выраженном пузырно-мочеточниковом рефлюксе с гидронефрозом может потребоваться двусторонняя нефр-эктомия. Если пузырно-мочеточниковый рефлюкс сочетается со снижением емкости и рецептивной релаксации мочевого пузыря, показана цистопластика. По некоторым данным, у больных с трансплантированной почкой и нарушенной функцией мочевого пузыря удовлетворительные результаты отмечаются и после операций по отведению мочи. Однако качество жизни после них ниже, чем после цистопластики, и больные обычно предпочитают последнюю ношению мочеприемника. Кроме того, у мужчин после отведения мочи в 20% случаев развивается эмпиема мочевого пузыря. Каждый вариант цистопластики — гастро-, илео- или сигмоцисто-пластика — характеризуется своими осложнениями, и выбрать оптимальную операцию сложно. Для цистопластики можно использовать расширенный мочеточник. Такую операцию уже выполняют у больных с нейроген-ной дисфункцией мочевого пузыря перед трансплантацией почки. Из-за рецидивирующего пиелонефрита им часто проводят нефрэктомию, после которой уретеро-цистопластика более чем уместна и позволяет избежать осложнений, возникающих при цистопластике участком ЖКТ.
объеме остаточной мочи для исключения инфравези-кальной обструкции, гипоактивного мочевого пузыря, гиперактивности сфинктера мочеиспускательного канала проводят цистометрию и профилометрию. При выраженном пузырно-мочеточниковом рефлюксе с гидронефрозом может потребоваться двусторонняя нефр-эктомия. Если пузырно-мочеточниковый рефлюкс сочетается со снижением емкости и рецептивной релаксации мочевого пузыря, показана цистопластика. По некоторым данным, у больных с трансплантированной почкой и нарушенной функцией мочевого пузыря удовлетворительные результаты отмечаются и после операций по отведению мочи. Однако качество жизни после них ниже, чем после цистопластики, и больные обычно предпочитают последнюю ношению мочеприемника. Кроме того, у мужчин после отведения мочи в 20% случаев развивается эмпиема мочевого пузыря. Каждый вариант цистопластики — гастро-, илео- или сигмоцисто-пластика — характеризуется своими осложнениями, и выбрать оптимальную операцию сложно. Для цистопластики можно использовать расширенный мочеточник. Такую операцию уже выполняют у больных с нейроген-ной дисфункцией мочевого пузыря перед трансплантацией почки. Из-за рецидивирующего пиелонефрита им часто проводят нефрэктомию, после которой уретеро-цистопластика более чем уместна и позволяет избежать осложнений, возникающих при цистопластике участком ЖКТ.
j Инфравезикальная обструкция
I Лечение стриктур мочеиспускательного канала или аденомы предстательной железы можно проводить и после трансплантации почки. Такие нарушения нередко наблюдаются у больных, у которых до трансплантации почки наблюдалась анурия. В этом случае восстановление оттока мочи после операции снижает риск контрактуры шейки мочевого пузыря. Кроме того, после транс- '' плантации почки хотя и медленно, но обычно полностью I восстанавливается функция детрузора. Пока этого не произойдет, либо проводят периодическую катетеризацию, либо накладывают эпицистостому.
Приобретенные кисты почек и рак почки
Установлено, что ХПН существенно повышает риск приобретенных кист почек и рака почки. Кисты почек возникают у 45% больных, страдающих ХПН более 3 лет. Это заболевание характеризуется двусторонним поражением почек и является предраковым. У 20% больных с приобретенными кистами почек развивается
] рак почки, у 1—2% больных — диссеминированный. В связи с этим при терминальной почечной недостаточности перед трансплантацией обязательно исключают
1 рак почки. Для этого проводят УЗИ. Кроме того, исключать рак почки необходимо при наличии одного фактора высокого риска (боль в пояснице, объемное об-
разование почки в анамнезе, макрогематурия) или двух факторов промежуточного риска (рост кист, диализ в течение более 4 лет, мужской пол, подозрение на солидное образование почки). При подозрении на солидное образование почки больного регулярно обследуют (желательно выполнять КТ). При подтверждении диагноза показана радикальная нефрэктомия.
Перитонеальный диализ
При трансплантации почки от живого родственного донора катетеры для перитонеального диализа обычно удаляют во время операции, после завершения трансплантации. При трансплантации трупной почки мы удаляем катетеры для перитонеального диализа позже, особенно если трансплантат начинает функционировать не сразу или высок риск его отторжения. Если после трансплантации возникает необходимость в перито-неальном диализе, мы его проводим безотлагательно. Когда функция трансплантата восстановится (через 1—8 нед после операции), катетеры для перитонеального диализа можно извлечь под местной анестезией.
Двусторонняя нефрэктомия перед трансплантацией почки
Нефрэктомию редко выполняют заранее. Основные показания — пиелонефрит, не поддающаяся лечению ре-новаскулярная гипертония, злокачественная опухоль почки, нефротический синдром. В отдельных случаях при реноваскулярной гипертонии вместо нефрэктомии проводят эндоваскулярную деструкцию почки. Изредка к двусторонней нефрэктомии перед трансплантацией почки прибегают при значительном увеличении почек при поликистозе или при постоянном присутствии антител к базальной мембране клубочка. Наиболее удобным считается абдоминальный доступ. При небольшом размере почек выполняют нефрэктомию из поясничного доступа. При выраженном двустороннем пузырно-мочеточниковом рефлюксе важно тщательно осмотреть мочевой пузырь и оценить необходимость цистопластики. Если она требуется, лучше прибегнуть к уретероцисто-пластике. С появлением препаратов рекомбинантного эритропоэтина аргументы в пользу сохранения почек при их тяжелом поражении устарели.
Удаление трансплантата
Если повторную трансплантацию можно провести с другой стороны, удалять нефункционирующий, но не влияющий на общее состояние больного трансплантат при хроническом отторжении необязательно. Прогноз повторной трансплантации почки зависит прежде всего от срока гибели первого трансплантата. Вероятность успеха низка, если отторжение и гибель пересаженной почки наступили в первые 6 мес после операции. Показания к удалению трансплантата — острое отторжение
Глава 37. Трансплантация почки

 на фоне диализа, лихорадка, макрогематурия, миалгия в результате системной воспалительной реакции, болезненность в области трансплантата, плохое самочувствие больного, инфекция и не поддающаяся лечению артериальная гипертония. Избежать повреждения подвздошных артерий при удалении трансплантата позволяет субкапсулярная нефрэктомия.
на фоне диализа, лихорадка, макрогематурия, миалгия в результате системной воспалительной реакции, болезненность в области трансплантата, плохое самочувствие больного, инфекция и не поддающаяся лечению артериальная гипертония. Избежать повреждения подвздошных артерий при удалении трансплантата позволяет субкапсулярная нефрэктомия.
ОТБОР ДОНОРОВ
Типы доноров
Живой родственный донор
У потенциального донора должны отсутствовать заболевания, при которых повышен риск осложнений нефр-эктомии и которые после взятия почки могут привести к ХПН или снижению качества жизни. Результаты трансплантации при использовании донорской почки от родственников первой степени лучше, чем при трансплантации трупной почки. Результаты длительных (до 45 лет) исследований подтверждают, что при соблюдении жестких требований к состоянию здоровья доноров донорство почки не приводит к ХПН и сопровождается приемлемой частотой осложнений и незначительной летальностью во время и после операции.
В настоящее время Т1/2 трансплантатов, взятых у живого родственного донора, превышает Т1/2 трансплантированной трупной почки более чем на 10 лет (13,4 и 2,8 года соответственно). При трансплантации почки от живого родственного донора выживаемость реципиентов и трансплантатов при совместимости по одному га-плотипу HLA и применении циклоспорина не отличаются от таковых при совместимости по двум гаплотипам. Ценность органов от живых родственных доноров объясняется не только прекрасными результатам трансплантации, но и все более ощутимым недостатком трупных органов.
Живой неродственный донор
Во всем мире растет недостаток трупных органов, в связи с чем все чаще используют почки, взятые у живых неродственных доноров. По опубликованным данным, 1-летняя выживаемость таких трансплантатов составляет 83—93%. В то же время критерии отбора доноров пока четко не определены. Есть данные, что в развивающихся странах трансплантируют почки, купленные у неизвестных лиц. Исследование результатов таких трансплантаций свидетельствует о низкой 1-летней выживаемости реципиентов (71—85%) и трансплантатов (63—82%). Кроме того, при них 5 реципиентов были заражены ВИЧ. Все это указывает на недопустимость легализации торговли донорскими органами. Трансплантация почки, взятой у живого неродственного донора, должна быть оправдана с медицинской и этической точек зрения. С медицинской точки зрения она оправдана, если результат трансплантации трупной поч-
ки предположительно будет хуже. С этической точки зрения она оправдана, когда донора и реципиента связывают долгие близкие отношения (например, супружеские). Пренебрежение этими правилами способно подорвать альтруистический дух донорства и пагубно для трансплантологии в целом. Когда же они строго соблюдаются, выживаемость трансплантатов и реципиентов при трансплантации почки от живого неродственного донора не уступает таковой при трансплантации почки от живого родственного донора.
Труп
Трупная почка пригодна для трансплантации, если донор не страдал заболеваниями, при которых поражаются почечные сосуды и нарушается почечное кровообращение, — артериальной гипертонией, сахарным диабетом, злокачественными опухолями с высоким риском диссеминации или инфекциями. Возраст донора старше 60 лет, подозрение на системное заболевание или его ранняя стадия служат показаниями к биопсии почки. Если при биопсии обнаруживают выраженный гломе-рулосклероз (поражено более 10—20% клубочков), гиперплазию интимы, интерстициальный фиброз, атрофию канальцев, признаки ДВС-синдрома, почку считают нежелательной или неприемлемой для трансплантации. Кроме того, донор ни в коем случае не должен принадлежать к группе риска ВИЧ-инфекции. Предпочтительны доноры без выраженных нарушений гемодинамики и остановки кровообращения, чреватых артериальной гипотонией с олигурией и острым канальцевым некрозом. Последнее осложнение гораздо реже развивается у молодых людей, поэтому в качестве доноров почки лучше использовать именно их. Частота успешных трансплантаций трупной почки наиболее высока при возрасте донора 2—60 лет. Трансплантация трупной почки, взятой у донора младше 2 лет, тоже дает хорошие результаты, если проводится иммуносупрессивная терапия препаратами антител, а размер трансплантата не слишком сильно отличается от размера почки реципиента. В Калифорнийском университете (Сан-Франциско) получены блестящие результаты трансплантации почки, взятой у детского трупа (младше 2 лет или весом менее 14 кг), после которой проводилась иммуносупрессивная терапия по соответствующим схемам. Трансплантировали как обе трупные почки единым блоком, так и одну трупную почку.
ПОДГОТОВКА К ТРАНСПЛАНТАЦИИ Подготовка к взятию трупной почки
Принципы ведения донора, у которого планируется взять трупную почку, просты, но иногда трудновьшол- I нимы. Как правило, они нарушаются на заключитель- j ном этапе реанимации больных с остановкой дыхания и со смертью мозга, когда предпринимаются последние попытки предотвратить необратимые изменения в ЦНС.
Глава 37. Трансплантация почки
В этот момент во избежание отека мозга часто ограни-| чивают инфузионную терапию. Кроме того, у большинства (74%) больных с изолированным повреждением ' ЦНС развивается несахарный диабет с относительной полиурией, которая приводит к артериальной гипотонии и ОПН. Важность полноценной инфузионной терапии и поддержания ОЦК перед взятием трупной почки недооценивают в связи с существенными различиями в | частоте острого канальцевого некроза у реципиентов почки — в мире она колеблется от 5 до 50%. Эти разли-I чия свидетельствует о том, что в отличие от правил взя-I тия и трансплантации почки правила подготовки к взя-I тию трупной почки не определены.
Переливание крови
Раньше считалось, что переливание крови реципиентам перед трансплантацией снижает риск отторжения трансплантата. С появлением циклоспорина и рекомбинант-ного эритропоэтина стало очевидно, что переливание крови (в том числе взятой у донора почки) оказывает благоприятное действие, если эффективна иммуносу-прессивная терапия. Наши исследования показали, что переливание крови улучшает результаты трансплантации у реципиентов, получающих циклоспорин и пред-j низон, и не влияет на результаты трансплантации при более интенсивной иммуносупрессивной терапии. По: сообщению хьюстонских исследователей, выживаемость j трансплантата у 200 реципиентов почки, которым про-I водилось переливание крови, и у 100 реципиентов, ко-I торым кровь не переливали, оказалась одинаковой. Переливание крови не только связано с риском заражения вирусами гепатита и цитомегаловирусом. Оно j приводит к сенсибилизации реципиента к антигенам HLA и снижает вероятность совместимости донора и 1 реципиента по антигенам HLA. В связи с этим переливание крови никогда не будет играть важной роли в иммуносупрессивной терапии при трансплантации донорской или трупной почки.
Совместимость по антигенам HLA
Точно установлено, что выживаемость трансплантата
напрямую зависит от совместимости донора и реципи-
I ента почки по антигенам HLA (А, В и DR). Большее
совпадение по антигенам HLA с родственниками пер-
i вой степени (родными братьями и сестрами, родителя-
I ми, детьми) обусловлено тем, что гены HLA, которые
локализуются на 6-й хромосоме, наследуются кодоми-
нантно. Соответственно, определение совместимости
близких родственников по антигенам HLA сводится к
сопоставлению групп аллелей HLA (гаплотипов).
Добиться совместимости по антигенам HLA при трансплантации трупной почки или почки от живого неродственного донора гораздо труднее, поскольку в отсутствие родства вероятность различий антигенов HLA значительно выше. Результаты трансплантации совместимых
по антигенам HLA трупных почек не слишком впечатляют, а данные о влиянии совместимости трупной почки с тканями реципиента по антигенам HLA на выживаемость трансплантата противоречивы: одни транс-плантологические центры отмечают положительное влияние, другие — его отсутствие. Тем не менее огромный опыт позволяет утверждать, что при совместимости тканей по 6 антигенам HLA результаты трансплантации почки значительно лучше, чем при низкой совместимости по антигенам HLA. По данным исследования Объединенной сети по распределению донорских органов, в группе перенесших трансплантацию почки, совместимой по 6 антигенам HLA, 1 -летняя выживаемость трансплантатов составила 87%, Т1/2 трансплантатов — 13 лет, а в контрольной группе перенесших трансплантацию почки без предварительного типирования HLA — 79% и 7 лет соответственно. Кроме того, в основной группе отмечена меньшая частота отторжения трансплантата (подсчиты-валось среднее число случаев отторжения трансплантата на одного реципиента).
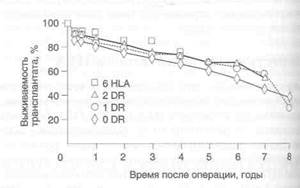
Чтобы оценить клиническое значение совместимости по антигенам HLA при трансплантации трупной почки, мы сравнили результаты трансплантации почки при совместимости по 6 антигенам HLA с результатами трансплантации при других вариантах совместимости. Мы изучали результаты всех трансплантаций трупной почки (1420 больных), проведенных в Калифорнийском университете (Сан-Франциско) с января 1984 г. по сентябрь 1992 г., когда уже применялся циклоспорин. Были определены следующие группы реципиентов: совместимые по 6 антигенам HLA (57 реципиентов), по 2 антигенам DR (133 реципиента), по 1 антигену DR (418 реципиентов), несовместимые по антигенам DR (734 реципиента). Исследование показало, что совместимость по антигенам HLA снижает риск отторжения трансплантата. Так, в группах реципиентов, совместимых по 6 антигенам HLA (р < 0,008) и по 2 антигенам DR (р < 0,03), частота отторжения трансплантата оказалась существенно ниже, чем в группах реципиентов, совместимых по 1 антигену DR и несовместимых по антигенам DR (рис. 37.2). Нами также установлено, что в целом совместимость по антигенам HLA оказывает выраженный (р < 0,05) положительный эффект на выживаемость трансплантата (рис. 37.3). Кроме того, наше исследование продемонстрировало высокую выживаемость трансплантата (1-летняя выживаемость составила 92%) и существенно меньшую частоту его отторжения при совместимости по 6 антигенам HLA. Эти данные наряду с полученными ранее свидетельствуют в пользу обязательного распределения донорских органов в США через Объединенную сеть по распределению донорских органов. Совместимость по антигенам DR повышает выживаемость трансплантата и снижает частоту его отторжения, но в меньшей степени, чем совместимость по 6 антигенам HLA. Совместимость по антигенам DR, таким образом, очень важна, но соблюдать ее целесообразно только в пределах района или штата, но не в рамках
Глава 37. Трансплантация почки



Рисунок 37.2. Совместимость по антигенам HLA и частота отторжения трансплантата. Совместимость по антигенам HLA снижает частоту отторжения трансплантата. При совместимости по 6 антигенам HLA (р < 0,008) и по 2 антигенам DR (р < 0,03) частота отторжения трансплантата статистически значимо ниже, чем при совместимости по 1 антигену DR и несовместимости по антигенам DR. Данные Реестра трансплантации почки Калифорнийского университета (Сан-Франциско) о 1420 трансплантациях трупной почки, проведенных в 1984-1992 гг.
страны — за время, которое уйдет на подбор реципиента и доставку органа, преимущества трансплантации частично совместимой по антигенам HLA почки сойдут на нет.
ХРАНЕНИЕ ПОЧКИ
Простое охлаждение и растворы для перфузии
Для хранения предназначенных для трансплантации почек используют простое охлаждение либо гипотерми-ческую аппаратную перфузию. Правила каждого метода хранения и показания к ним подробно описаны. Чаще прибегают к простому охлаждению. Почку перфузиру-ют холодным консервирующим раствором сразу после нефрэктомии. Для перфузии донорской почки требуется раствор, осмоляльность которого соответствует таковой внеклеточной жидкости (раствор Рингера с лакта-том), поскольку в этом случае время холодовой ишемии невелико (1—3 ч). При более продолжительной холодовой ишемии перфузия таким раствором может спровоцировать переход воды во внутриклеточное пространство и отек клеток. Чтобы этого не произошло, применяют растворы с высокой осмоляльностью. Сегодня чаще всего используют раствор Висконсинского университета (UW-1). С его появлением возможности хранения органов значительно расширились. Раствором Висконсинского университета проводят перфузию большинства трупных почек. У 80% доноров забирают несколько органов (обычно печень, почки и поджелудочную железу),
для их перфузии и хранения применяют также раствор Висконсинского университета.
Гипотермическая аппаратная перфузия
Гипотермическую аппаратную перфузию обычно используют для хранения почек, пригодность которых для трансплантации считают спорной. Таким образом хранят не более 20% почек, поскольку их сложно распределять и доставлять — потребность в них мала, а оборудование слишком громоздкое.
Результаты
Оба метода обеспечивают хорошую сохранность почек, если время холодовой ишемии не превышает 24 ч. При сроке хранения почки более 48 ч существенно возрастает частота острого канальцевого некроза и позднего начала функционирования трансплантата. У больных с длительно не функционирующим трансплантатом нередко остается незамеченной реакция отторжения, поскольку обычные клинические показатели, позволяющие диагностировать ее, если трансплантат начал функционировать сразу, в данном случае неприменимы. По нашему опыту (1420 трансплантаций трупной почки в 1984—1992 гг.), выживаемость трансплантированной трупной почки значительно выше (р < 0,04), если срок ее хранения (время холодовой ишемии) не превышал 24 ч (рис. 37.4). Аналогичные результаты получены и в других крупных исследованиях. Методы простого охлаждения почки хорошо изучены и отработаны. Мы надеемся, что с развитием этой области трансплантологии частота позднего начала функционирования трансплантата, обусловленного погрешностями хранения почки, сократится и в конечном счете повысится выживаемость трансплантатов.
Date: 2016-11-17; view: 314; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |