
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Камни мочеиспускательного канала и полости крайней плоти 6 page
повышение проницаемости капилляров, артериальная гипотония, другие сердечно-сосудистые нарушения, а также нарушения функции почек и печени. П/к препараты ИЛ-2 больные вводят самостоятельно. Побочные эффекты при этом менее выражены. Обычно это недомогание и другие общие симптомы. Оптимальная схема применения препаратов ИЛ-2 пока не выработана. Частота ремиссий редко превышает 20%. Длительные полные ремиссии наблюдаются только после высокодоз-ной терапии. Попытка комбинировать препараты ИЛ-2 с другими иммуномодуляторами, например препарата- I ми интерферона а, и цитостатиками не повысила эффективность лечения.
Интерферон а — цитокин, оказывающий цитотоксическое, иммунорегуляторное и, возможно, антипроли-феративное действие. Он усиливает экспрессию антиге- I нов HLA класса II на поверхности макрофагов, повышая их антигенпредставляющую способность. Препараты интерферона а применяют при раке почки и мочевого пузыря. Их основные побочные эффекты — лихорадка,! недомогание и другие общие симптомы, при применении в высоких дозах возможны угнетение кроветворения, токсическое действие на ЦНС и печень. По данным ряда авторов, монотерапия препаратами интерферона а вызывает ремиссии у 20% больных раком почки. Однако длительные полные ремиссии в отличие от лечения препаратами ИЛ-2 отмечаются редко. Препараты интерферона а применяют местно при раке мочевого пузыря, когда неэффективна 1-я линия лечения БЦЖ (гл. 21).
Адоптивная иммунотерапия
Адоптивная иммунотерапия подразумевает введение активированных ex vivo эффекторных клеток иммунной системы больного. Цель адоптивной иммунотерапии -стимуляция противоопухолевого иммунитета. Этот ме- | тод обязан своим появлением тому факту, что Т-лимфо-циты, взятые у больных меланомой или раком почки, способны распознавать антиген на клетках первичной опухоли. Таким образом, эти клетки можно взять у боль- 1 ного, активировать ex vivo и ввести обратно. При диссе- I минированном раке почки применялись как LAK-клет- I ки (NK-лимфоциты, стимулированные ИЛ-2), так и I стимулированные ИЛ-2 лимфоциты, инфильтрирующие I опухоль. Нередко одновременно назначались препараты I ИЛ-2. Однако контролируемые клинические испытания I не продемонстрировали повышения частоты ремиссий и 1 выживаемости после адоптивной иммунотерапии. Им- I мунотерапия рака почки описана в гл. 22.
ЛИТЕРАТУРА
Agarwala SS, Kirkwood JM: Interferons in the treatment of solid I tumors. Oncology 1994; 51:129.
Anichini A, Fossati G, Parmiani G: Clonal analysis of the cytolytic I T-cell response to human tumors. Immunol Today 1987; 8:385.
Berd D: Cancer vaccines: Reborn orjust recycled? Semin Oncol 1998; I 25:605.
Глава 20. Иммунология в диагностике и лечении злокачественных опухолей
 Berd D et al.: Treatment of metastatic melanoma with an autologous tumor-cell vaccine: Clinical and immunologic results in 64 patients. J Clin Oncol 1990; 11:1858.
Berd D et al.: Treatment of metastatic melanoma with an autologous tumor-cell vaccine: Clinical and immunologic results in 64 patients. J Clin Oncol 1990; 11:1858.
Berd D, Maguire HC Jr, Mastrangelo MJ: Induction of cell-mediated immunity to autologous melanoma cells and regression of metastases after treatment with a melanoma cell vaccine preceded by cyclophosphamide. Cancer Res 1986; 46:2572.
Bukowski RM: Natural history and therapy of metastatic renal cell carcinoma: The role of interleukin-2. Cancer 1997; 80:1198.
Fyfe G et al.: Results of treatment of 255 patients with metastatic RCC who received high-dose recombinant interleukin-2 therapy. J Clin Oncol 1995; 13:688.
Gitlitz BJ, Belldegrun A, Figlin R: Immunotherapy and gene therapy. Semin Urol Oncol 1996; 14:237.
Goedegebuure PS, Eberlen TJ: Vaccine trials for the clinician: Prospects for viral and non-viral vectors. Oncologist 1997; 2:300.
Hewitt H, Blake E, Walder A: A critique of the evidence for active host defense against cancer based on personal studies of 27 murine tumors of spontaneous origin. Br J Cancer 1976; 33:241.
Hoover HC Jr et al.: Adjuvant active specific immunotherapy for human colorectal cancer: 6.5-year median follow-up of a phase III prospectively randomized trial. J Clin Oncol 1993; 11:390.
Hsu FJ, Engleman EG, Levy R: Dendritic cells and their application in immunotherapeutic approaches to cancer therapy. PPO Updates 1997; 11:1.
International Germ Cell Cancer Collaborative Group: International germ cell consensus classification: A prognostic factor-based staging system for metastatic germ cell cancers. J Clin Oncol 1997; 15:594.
Lamm DL: Long-term results of intravesical therapy for superficial bladder cancer. Urol Clin North Am 1992; 19:573.
Morales A, Nickel JC: Immunotherapy for superficial bladder cancer. Urol Clin North Am 1992; 19:549.
Morton DL et al.: Prolongation of survival in metastatic after active specific immunotherapy with a new polyvalent melanoma vaccine. Ann Surg 1992; 216:463.
Osanto S: Vaccine trials for the clinician: Prospects for tumor antigens. Oncologist 1997; 2:284.
Rosenberg SA et al.: Observations on the systemic administration of autologous lymphokine-activated killer cells and recombinant interleukin-2 to patients with metastatic cancer. N EnglJ Med 1985; 313:1485.
Rosenberg SA et al.: Treatment of 283 consecutive patients with metastatic melanoma or renal cell cancer using high-dose bolus interleukin-2. JAMA 1994; 271:907.
Rosenberg SA et al.: Use of tumor-infiltrating lymphocytes and interleukin-2 in the immunotherapy of patients with metastatic melanoma. N EnglJ Med 1988; 319:1676.
Rosenberg SA: New opportunities for the development of cancer immunotherapies. Cancer J 1998; 4(Suppl 1):S1.
Schlag P et al.: Active specific immunotherapy with Newcastle-disease-virus-modified autologous tumor cells following resection of liver metastases in colorectal cancer. Cancer Immunol Immunother 1992; 35:325.
Shepard HM et al.: Monoclonal antibody therapy of human cancer: Taking the HER2 protooncogene to the clinic. J Clin Immunol 1991; 11:117.
Simons JW, Mikhak B: Ex vivo gene therapy using cytokine-transduced tumor vaccines: Molecular and clinical pharmacology. Semin Oncol 1998; 25:661.
Texter JH Jr, Neal CE: The role of monoclonal antibody in the management of prostate adenocarcinoma. J Urol 1998; 160:2393.
Vanky F, Klein E: Specificity of auto-tumor cytotoxicity exerted by fresh, activated and propagated human T lymphocytes. Int J Cancer 1982; 29:547.
Velders MP, Schreiber H, Kast WM: Active immunization against cancer cells: Impediments and advances. Semin Oncol 1998; 25:697.
21 П. Карролл
ОПУХОЛИ МОЧЕВОГО ПУЗЫРЯ, ПОЧЕЧНОЙ ЛОХАНКИ И МОЧЕТОЧНИКА
ОПУХОЛИ МОЧЕВОГО ПУЗЫРЯ Эпидемиология
У мужчин рак мочевого пузыря встречается в 2,3 раза чаще, чем у женщин: 70% впервые выявленных больных — мужчины, 30% — женщины. У белых заболевание встречается чаще, чем у негров. Рак мочевого пузыря — вторая по частоте злокачественная опухоль мочевых путей и мужских половых органов. Средний возраст больных на момент постановки диагноза составляет 65 лет. Среди впервые выявленных больных у 85% опухоль ограничена мочевым пузырем, у 15% имеются регионарные или отдаленные метастазы.
Этиология и патогенез
Известно несколько факторов риска рака мочевого пузыря. Один из них — курение. Курят 50% мужчин и 31% женщин, больных раком мочевого пузыря. Риск этой опухоли у курильщиков, живущих в разных странах, примерно одинаков. Он напрямую зависит от числа выкуриваемых сигарет и увеличивается при наличии профессиональных вредностей. Считается, что у курильщиков рак мочевого пузыря вызывают 1- и 2-нафтиламин, которые выводятся с мочой. У 15—35% мужчин и 1—6% женщин, больных раком мочевого пузыря, отягощен профессиональный анамнез. В группу риска рака мочевого пузыря входят работники полиграфической, химической, красильной, резиновой, нефтяной и кожевенной промышленности. К промышленным канцерогенам относят бензидин, 2-нафтиламин и 4-аминодифенил. Между первым контактом с канцерогеном и появлением опухоли обычно проходит долгое время. Риск рака мочевого пузыря повышает циклофосфамид. Раньше фактором риска этой опухоли считали употребление заменителей сахара, однако позже это было опровергнуто. Еще один фактор риска рака мочевого пузыря — повреждение эпителия при инфекциях, инструментальных вмешательствах и мочекаменной болезни.
Опухолевая трансформация эпителия мочевого пузыря — многостадийный процесс. Он начинается в одной эпителиальной клетке. На стадии инициации под действием канцерогенов накапливаются необратимые структурные изменения ДНК, которые реализуются в изменении фенотипа клетки. На второй стадии канцерогенеза — промоции — трансформированная клетка под-
вергается воздействию промотора, стимулирующего ее I пролиферацию. Какие именно генетические механизмы I участвуют в опухолевой трансформации, не известно. | Вероятно, их множество, но среди них, безусловно, -усиление экспрессии протоонкогенов и подавление экс- I прессии генов — супрессоров опухолевого роста. При низкодифференцированном раке мочевого пузыря, в частности, повышается экспрессия протоонкогенов се- I мейства RAS. Гены — супрессоры опухолевого роста J регулируют клеточный цикл, поэтому потеря или инактивация обоих аллелей того или иного гена ведет к бес-; контрольной пролиферации клеток. Делеции длинного | плеча 9-й хромосомы наблюдаются при раке мочевого I пузыря разной степени дифференцировки, поэтому эти I генетические изменения, вероятно, возникают на на-чальных стадиях опухолевой трансформации. Делеции 1 короткого плеча 11-й и 17-й хромосом характерны для I низкодифференцированных опухолей. По-видимому, I потеря генов — супрессоров опухолевого роста, распо- I ложенных на этих хромосомах, сопряжена с прогрес- I сированием опухоли. При раке мочевого пузыря часто I обнаруживают делеции и мутации гена ТР53, располо- I женного на 17-й хромосоме и кодирующего белок р53. I
Морфологические изменения эпителия мочевого пу- I зыря в процессе опухолевой трансформации довольно I хорошо изучены у животных. У грызунов рак мочевого I пузыря вызывают с помощью N-[(4-(5-HHTpo-2-tpy- | рил)-2-тиазолил]-формамида. Сначала возникает гипер- I плазия эпителия мочевого пузыря, которая характери- I зуется тканевым атипизмом. Клеточного атипизма при I этом нет. У человека эти изменения соответствуют кис- I тозному циститу и гнездам Брунна. Затем у экспери- I ментальных животных происходит метаплазия переход- I ного эпителия в дифференцированный железистый или I многослойный плоский. На следующем этапе возника- I ют дисплазия и злокачественная опухоль. Возможно, I все эти последовательные морфологические изменения I наблюдаются и у человека, однако известно, что рак мо- I чевого пузыря может развиваться не только на фоне I дисплазии, но и на фоне гиперплазии и метаплазии, а I также из неизмененного эпителия мочевого пузыря.
Злокачественная опухоль мочевого пузыря может рас- Е ти поверхностно, в пределах слизистой, или переходить I к инвазивному росту. Как это происходит, точно не из- I вестно. Согласно одной из гипотез, этот процесс состо- | ит из трех этапов. Вначале опухолевые клетки должны I связаться с базальной мембраной. Для этого на их по- | верхности имеются рецепторы ламинина — гликопро- I теида, входящего в состав базальных мембран. При инва-1 зивных опухолях мочевого пузыря рецепторов ламинина I на поверхности клеток больше, чем при поверхностных, | После связывания с базальной мембраной опухолевые I клетки разрушают ее с помощью протеаз, например кол- I лагеназы типа IV. Затем активно прогрессируют только I опухоли, секретирующие факторы подвижности. Они I стимулируют движение клеток, способствуют инвазив- I ному росту и метастазированию. Как оказалось, содер- I
Глава 21. Опухоли мочевого пузыря, почечной лоханки и мочеточника
 жание аутокринного фактора подвижности в моче при инвазивных опухолях мочевого пузыря выше, чем при поверхностных.
жание аутокринного фактора подвижности в моче при инвазивных опухолях мочевого пузыря выше, чем при поверхностных.
Определение стадии
Чаще всего используют две классификации стадий рака мочевого пузыря. Одна из них предложена X. Джуэттом и Дж. Стронгом в 1946 г. и основана на данных о частоте регионарных и отдаленных метастазов в зависимости от глубины инвазии стенки мочевого пузыря. При прорастании подслизистого слоя (стадия А) и мышечной оболочки (стадия В) метастазы встречаются редко (0 и 13% случаев соответственно), при выходе опухоли за пределы мочевого пузыря — гораздо чаще, в 87% случаев. В
1952 г. В. Маршалл усовершенствовал эту классификацию, разделив поверхностные опухоли на ограниченные слизистой (стадия 0) и прорастающие собственную пластинку слизистой (стадия А). Кроме того, он выделил два этапа метастазирования. Метастазы в регионарные лимфоузлы теперь стали обозначаться как стадия Dl, a отдаленные метастазы — как стадия D2. Вторая широко используемая классификация стадий рака мочевого пузыря — это классификация по системе TNM, разработанная Международным противораковым союзом. В ней одновременно отражено состояние первичной опухоли (Т), регионарных лимфоузлов (N) и других органов (М). Сравнение этих классификаций приведено на рис. 21.1. И та, и другая позволяют довольно точно оценить распространенность опухоли и определить тактику лече-

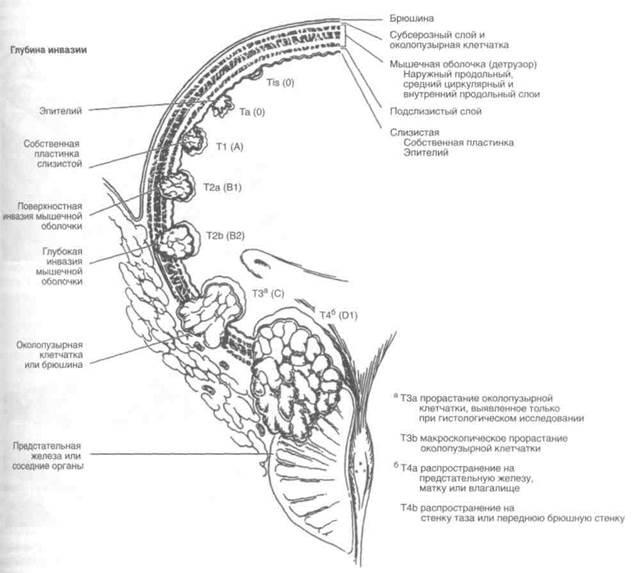
Рисунок 21.1. Стадии рака мочевого пузыря.
Глава 21. Опухоли мочевого пузыря, почечной лоханки и мочеточника
 ния. Однако клиническая стадия, диагностированная на основании результатов физикального исследования и лучевой диагностики, часто не совпадает с морфологической, которая определяется после гистологического исследования удаленных мочевого пузыря и регионарных лимфоузлов. Клиническая стадия редко бывает завышенной, чаще (до 53% случаев) она оказывается, напротив, заниженной.
ния. Однако клиническая стадия, диагностированная на основании результатов физикального исследования и лучевой диагностики, часто не совпадает с морфологической, которая определяется после гистологического исследования удаленных мочевого пузыря и регионарных лимфоузлов. Клиническая стадия редко бывает завышенной, чаще (до 53% случаев) она оказывается, напротив, заниженной.
Патоморфология
Эпителиальными являются 98% злокачественных опухолей мочевого пузыря, большинство из них представляют собой переходноклеточный рак.
Нормальный эпителий мочевого пузыря
Мочевой пузырь выстлан переходным эпителием, который состоит из 3—7 слоев клеток, расположенных на базальной мембране. В состав базальной мембраны входят коллаген, гликопротеиды и гликозаминогликаны (рис. 21.2, А). Клетки переходного эпителия различаются по внешнему виду. Ближе к базальной мембране расположены базальные клетки. Они делятся и дифференцируются в поверхностные клетки. Внешний вид поверхностных клеток, пожалуй, — наиболее важный признак нормального эпителия мочевого пузыря. Эти клетки крупнее базальных, имеют куполообразную форму и прочно связаны между собой. Под базальной мембраной находится собственная пластинка слизистой. Она образована рыхлой соединительной тканью, в которой могут встречаться пучки гладкомышечных клеток. Последние следует отличать от мышечной оболочки. Мышечная оболочка мочевого пузыря — детрузор — лежит глубже. Она состоит из разнонаправленных пучков гладких мышц. Вблизи шейки мочевого пузыря они образуют четко различимые три слоя: внутренний и наружный продольные и средний циркулярный.
Папиллома
По определению ВОЗ, папиллома мочевого пузыря — это папиллярная опухоль, имеющая тонкую содини-тельнотканную основу, содержащую кровеносные сосуды, и покрытая нормальным переходным эпителием. Папилломы мочевого пузыря встречаются нечасто и составляют примерно 2% всех опухолей, исходящих из переходного эпителия. Прогноз благоприятный, озлока-чествление наблюдается примерно у 16% больных.
Переходноклеточный рак
На долю переходноклеточного рака приходится около 90% злокачественных эпителиальных опухолей мочевого пузыря. Макроскопически переходноклеточный рак чаще всего представляет собой экзофитную папиллярную опухоль (рис. 21.2, Б), реже опухоль на широком основании или изъязвленный узел. Папиллярные опухоли часто поверхностные, опухоли на широком основании — инвазивные. Согласно ВОЗ, в зависимости от числа ми-



Рисунок 21.2. Гистологическое строение эпителия мочевого пузыря в норме и при злокачественных опухолях. А. Нормальный эпителий (х125). Б. Умереннодифференцированный переходноклеточный рак (х60). В. Рак in situ (x200).
Глава 21. Опухоли мочевого пузыря, почечной лоханки и мочеточника
 тозов, тканевого и клеточного атипизма выделяют высоко-, умеренно- и низкодифференцированный пере-ходноклеточный рак мочевого пузыря.
тозов, тканевого и клеточного атипизма выделяют высоко-, умеренно- и низкодифференцированный пере-ходноклеточный рак мочевого пузыря.
Рак in situ макроскопически представляет собой плоское объемное образование, лишенное ножки. Клетки крупные, с крупными ядрышками, отмечается тканевой иклеточныйатипизм, однако инвазии нет (рис. 21.2, В). Рак in situ может встречаться у больных с поверхностными или инвазивными опухолями, реже наблюдается изолированно. Поражение слизистой при раке in situ может быть как очаговым, так и диффузным. Клиническое течение рака in situ разное, нередко возникает инвазия. Сочетание рака in situ с поверхностными опухолями повышает риск прогрессирования последних.
Риск прогрессирования зависит от степени дифферен-цировки опухоли. При высокодифференцированном пе-реходноклеточном раке мочевого пузыря частота прогрессирования 10—20%, при умереннодифференциро-ванном — 19—37%, при низкодифференцированном — 33—67%. Такая же тенденция прослеживается и при анализе выживаемости. Так, 10-летняя выживаемость при высокодифференцированных опухолях 98%, а при низ-кодифференцированных — только 35%.
Другие эпителиальные опухоли
Аденокарцинома. На долю аденокарциномы приходится менее 2% злокачественных эпителиальных опухолей мочевого пузыря. Аденокарцинома мочевого пузыря обычно муцинозная, может развиваться на фоне цистита или метаплазии. Излюбленная локализация — дно мочевого пузыря. Аденокарцинома, локализующаяся в верхушке мочевого пузыря, как правило, исходит из мочевого протока. Независимо от локализации на момент постановки диагноза, как правило, имеется инвазия мышечной оболочки, однако регионарных и отдаленных метастазов обычно нет. Пятилетняя выживаемость не превышает 40%. Плоскоклеточный рак. В США плоскоклеточный рак диагностируется у 5—10% больных раком мочевого пузыря, особенно с хроническими инфекциями мочевых путей, камнями и постоянной катетеризацией мочевого пузыря в анамнезе. Фактором риска плоскоклеточного рака мочевого пузыря считают мочеполовой шистосо-моз (возбудитель — Schistosoma haematobium), поскольку в районах, где это заболевание распространено (Египет и другие африканские страны, Ближний Восток), около 60% всех злокачественных эпителиальных опухолей мочевого пузыря приходится на плоскоклеточный рак. Макроскопически плоскоклеточный рак обычно имеет вид узла. К моменту постановки диагноза, как правило, уже имеется инвазия мышечной оболочки. Это низкодифференцированная опухоль, состоящая из полигональных клеток с характерными межклеточными мостиками и небольшими участками ороговения (могут отсутствовать).
Недифференцированный рак встречается редко. Его частота менее 2%. Опухоль представлена недифференцированными эпителиальными клетками. Описаны зло-
качественные опухоли мочевого пузыря, напоминающие мелкоклеточный рак легкого. Смешанные опухоли встречаются у 4—6% больных раком мочевого пузыря. В опухоли одновременно присутствуют участки, имеющие строение переходноклеточного и плоскоклеточного рака, реже недифференцированного рака и аденокарциномы. На момент диагностики эти опухоли, как правило, крупные и инвазивные.
Редкие злокачественные опухоли мочевого пузыря
Описаны ворсинчатый полип, карциноид, меланома, карциносаркома, феохромоцитома, лимфомы, хорио-карцинома, гемангиосаркома, остеосаркома и лейомио-саркома мочевого пузыря. Кроме того, поражение мочевого пузыря за счет непосредственного распространения опухоли возможно при раке предстательной железы, шейки матки и прямой кишки. В мочевой пузырь мета-стазируют меланома, лимфомы, рак желудка, молочной железы, почки и легкого (перечислены в порядке убывания частоты).
Диагностика
Клиническая картина
В 85—90% случаев больные обращаются к врачу в связи с микро- или макрогематурией. Она может быть постоянной, но, как правило, носит преходящий характер. Гематурия может сочетаться с учащенным болезненным мочеиспусканием и императивными позывами. Нарушения мочеиспускания особенно характерны для диффузного поражения мочевого пузыря при раке in situ. При раке мочевого пузыря поздних стадий возможны боль в пояснице при метастазах в лимфоузлы или обструкции мочеточника и боль в костях.
Поскольку на момент постановки диагноза у большинства больных имеются поверхностные опухоли, каких-либо изменений при физикальном исследовании, как правило, нет. Однако при крупных или инвазивных опухолях во время ректального или обычного бимануального исследования под общей анестезией можно выявить утолщение стенки или объемное образование мочевого пузыря. Крупные поверхностные и инвазивные опухоли Т2—ТЗа после ТУР обычно не пальпируются. Опухоли, пальпируемые после ТУР, соответствуют индексу ТЗЬ—Т4 по системе TNM. Опухоль, смещаемая в переднезаднем направлении, соответствует индексу ТЗЬ, не смещаемая или прорастающая в соседние органы (прямую кишку, предстательную железу или влагалище) — индексу Т4. Увеличение печени и надключичных лимфоузлов свидетельствует о диссеминации. При метастазах в тазовые лимфоузлы возможен лимфатический отек ног.
Лабораторные исследования Общий анализ мочи и крови. Самая частая находка в общем анализе мочи — гематурия. При вторичной инфек-
Глава 21. Опухоли мочевого пузыря, почечной лоханки и мочеточника
ции мочевых путей она может сочетаться с леикоциту-рией. При обструкции мочеточника из-за прорастания опухолью или сдавления лимфоузлами возможна ХПН. Вследствие хронической кровопотери или метастазов в костный мозг может развиваться анемия. Цитологическое исследование мочевого осадка и проточная цитофлюориметрия. Нормальные и измененные клетки эпителия мочевого пузыря хорошо видны при микроскопии мочевого осадка. Когда клеток в препарате мало, мочевой пузырь осторожно промывают физиологическим раствором, который вводят через катетер или цистоскоп. Цитологическое исследование мочевого осадка или смыва из мочевого пузыря применяют при обследовании лиц с высоким риском рака мочевого пузыря, обследовании больных с подозрением на рак мочевого пузыря, наблюдении за больными и оценке эффективности лечения. Чувствительность цитологического исследования зависит от метода сбора мочи, числа клеток в препарате, а также степени дифференцировки и размеров опухоли.
Взвесь клеток наносят на предметное стекло, фиксируют и окрашивают. При цитологическом исследовании чаще всего выявляют низкодифференцированные и ин-вазивные опухоли. При высокодифференцированных и поверхностных опухолях информативность метода ниже. Поскольку при раке мочевого пузыря в большинстве случаев имеется хотя бы один клон анеугатоидных клеток, в ряде клиник для диагностики используют проточную цитофлюориметрию. Осадок центрифугируют в градиенте плотности, пропускают через фильтры и окрашивают специальными красителями, связывающимися с Д Н К. Затем образец исследуют в проточном ци-тофлюориметре, в котором по интенсивности флюоресценции определяют содержание ДНК в клетках. В зависимости от наличия анеуплоидии результат интерпретируют как отрицательный, сомнительный или положительный. Чувствительность проточной цитофлюори-метрии в диагностике рака мочевого пузыря составляет примерно 80%. Как и при цитологическом исследовании, она тем выше, чем ниже степень дифференцировки
и больше распространенность опухоли. Так, проточная цитофлюориметрия выявляет папилломы мочевого пузыря лишь в 50% случаев, опухоли Tis — в 89%, Та - в 82%, инвазивные — в 90% случаев. Специфичность проточной цитофлюориметрии можно повысить, используя моноклональные антитела к эпителию мочевых путей. Это позволяет не анализировать присутствующие в виде примеси лейкоциты и бактерии. И проточную цитофлюориметрию, и цитологическое исследование можно использовать для выявления рецидивов и оценки эффективности внутрипузырной или лучевой терапии. Другие исследования. Чувствительность цитологического исследования мочевого осадка зависит от ряда факторов: числа исследованных образцов мочи, стадии и степени дифференцировки опухоли, а также от опыта цитолога. В настоящее время разрабатывают новые, более объективные методы диагностики рака мочевого пузыря, основанные на исследовании мочи или мочевого осадка. Среди них определение антигена ВТА, качественная и количественная проба на комплементоподоб-ный белок, определение белка 22 ядерного матрикса, продуктов деградации фибрина в моче, экспрессии антигена Lex и активности теломеразы. Уже имеются работы, посвященные изучению информативности этих исследований в диагностике рака мочевого пузыря и их использованию при наблюдении за больными после лечения (табл. 21.1).
В большинстве проведенных исследований новые методы оценивали у больных с подтвержденной первичной или рецидивной опухолью мочевого пузыря и сравнивали полученные результаты с показателями у здоровых лиц. Пока эти методы можно использовать лишь какдо-полнение к традиционным. Для широкого применения их можно будет рекомендовать, когда накопится достаточно данных в пользу их надежности. Если новые методы окажутся достаточно чувствительными и специфичными, обследование и наблюдение за больными раком мочевого пузыря могут существенно измениться. Кроме того, эти методы позволят более тщательно изучить течение рака мочевого пузыря.
Таблица 21.1. Сравнение разных методов диагностики рака мочевого пузыря
| Число иссле- | Чувствитель- | Специфич- | Предсказательная ценность результата, % | ||
| Метод | дований | ность, % | ность, % | положительного | отрицательного |
| Определение антигена ВТА | 28-65 | 73-96 | 33-80 | 52-94 | |
| Определение белка 22 ядерного | 48-100 | 61-85 | 29-58 | 66-100 | |
| матрикса | |||||
| Качественная проба на ком- | 57-67 | 33-95 | 20-56 | 70-95 | |
| плементоподобный белок | |||||
| Количественная проба на компле- | Нет данных | Нет данных | |||
| ментоподобный белок | |||||
| Определение экспрессии антигена Lex | 80-97 | 73-86 | 72-81 | 83-98 | |
| Определение активности теломе- | 62-80 | 80-96 | |||
| разы |
Глава 21. Опухоли мочевого пузыря, почечной лоханки и мочеточника
 Предполагается, что существует зависимость между экспрессией определенных антигенов групп крови и стадией опухоли, а также риском прогрессирования. Аналогичные данные получены относительно некоторых опухолевых антигенов.
Предполагается, что существует зависимость между экспрессией определенных антигенов групп крови и стадией опухоли, а также риском прогрессирования. Аналогичные данные получены относительно некоторых опухолевых антигенов.
Лучевая диагностика
Хотя рак мочевого пузыря можно выявить с помощью разных методов лучевой диагностики, для подтверждения диагноза обязательно выполняют цистоскопию и биопсию. Лучевая диагностика применяется в основном для исследования верхних мочевых путей, для оценки глубины инвазии мышечной оболочки, выявления регионарных и отдаленных метастазов. Обследование больных с гематурией чаще всего начинают с экскреторной урографии. Папиллярная опухоль мочевого пузыря выглядит как дефект наполнения мочевого пузыря (рис. 21.3). При этом нередко видна ножка опухоли. Гидронефроз наблюдается, как правило, при глубокой инвазии стенки мочевого пузыря.
УЗИ абдоминальным или уретральным датчиком тоже выявляет опухоли мочевого пузыря и патологию верхних мочевых путей. Исследование проводят при максималь-
ном наполнении мочевого пузыря. Опухоль видна как эхогенное образование в просвете мочевого пузыря, инвазия — как гипоэхогенный участок в стенке. УЗИ уретральным датчиком информативнее УЗИ абдоминальным датчиком. Однако это инвазивное исследование не имеет особых преимуществ перед цистоскопией и ТУР опухоли, которые обязательно выполняются больным. При опухолях Tis—Та, когда диагноз подтвержден при ТУР и бимануальном исследовании под общей анестезией, дальнейшее обследование можно не проводить. При опухолях более поздних стадий клиническая стадия часто оказывается заниженной, что требует проведения дополнительных исследований. КТ и МРТ позволяют уточнить глубину инвазии и оценить состояние тазовых лимфоузлов (рис. 21.4). Точность определения стадии рака мочевого пузыря при КТ составляет 40—85%, при МРТ — 50—90%. МРТ имеет ряд преимуществ по сравнению с КТ. Она не требует в/в введения рентгенокон-трастных средств, точнее отличает опухоль от нормальных тканей, а лимфоузлы от сосудов. Кроме того, МРТ позволяет получить изображение в разных плоскостях. Среди недостатков МРТ — снижение качества изображения при движениях больного, невозможность проведе-
Date: 2016-11-17; view: 328; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |