
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Й. Турофф, К. Гилфрих
АНТЕГРАДНЫЕ ВМЕШАТЕЛЬСТВА НА МОЧЕВЫХ ПУТЯХ
В отличие от ретроградных вмешательств, проводимых через мочевые пути и требующих использования эндоскопов, для антеградных вмешательств необходимы чрес-кожная пункция и рентгенологический контроль. Залог успеха антеградных вмешательств, как и открытых операций на почке, — хорошее знание анатомии. Чтобы все манипуляции были удобными и по возможности бескровными, нужно правильно выбрать точку и направление пункции. Именно они во многом определяют успех всего вмешательства. Пункцию обычно проводят под контролем УЗИ, рентгеноскопии и реже КТ. При этом одновременно видны и пункционная игла, и пунктируемый орган. Пункцию чашечно-лоханочной системы, как правило, выполняют под контролем УЗИ, а дальнейшие манипуляции (бужирование пункционного канала, неф-ростомию) — под рентгенологическим контролем. Во время вмешательств на чашечно-лоханочной системе предпочтителен эндоскопический контроль.
Антеградные вмешательства противопоказаны при коагулопатиях и на фоне лечения антикоагулянтами. Операционное поле обрабатывают так же, как перед открытой операцией. Для пункции, минимального бужирования пункционного канала (до диаметра 6—12 Fr), нефростомии и установки мочеточникового стента достаточно местной анестезии. Кожу и подлежащие ткани вплоть до почечной капсулы инфильтрируют 10 мл 1% раствора лидокаина. Во время бужирования пункционного канала обязательно используют гель, содержащий местный анестетик (например, 2% гель с лидокаином). Помимо анестезирующего действия гель облегчает введение инструментов. Под местной анестезией удается бужировать пункционный канал до диаметра 30 Fr и извлекать мелкие камни. Однако сейчас вместо этого предпочитают проводить дистанционную литотрипсию.
Эндоскопическую нефролитотомию выполняют при коралловидных камнях и камнях, находящихся в дивертикулах почечных чашечек. Эта операция подразумевает пункцию чашечно-лоханочной системы, бужирование пункционного канала, дробление камней и эвакуацию их фрагментов. Учитывая серьезность и длительность этого вмешательства, его проводят под эпидуральной или общей анестезией.
ПУНКЦИЯ ЧАШЕЧНО-ЛОХАНОЧНОЙ
СИСТЕМЫ
Пункция чашечно-лоханочной системы может выполняться как с диагностической (например, во время ан-
теградной пиелографии или пробы Уитакера), так и с лечебной (например, во время нефростомии или установки мочеточникового стента) целью (табл. 8.1). Независимо от цели пункция чашечно-лоханочной системы выполняется одинаково. В целях безопасности вмешательство проводится под контролем УЗИ или рентгеноскопии. Пункция чашечно-лоханочной системы под контролем УЗИ имеет определенные преимущества.
1. В/в и в мочевые пути не вводятся рентгеноконтраст-ные средства.
2. Не используется ионизирующее излучение.
3. Контроль осуществляется в режиме реального времени.
4. УЗИ выявляет рентгенонегативные и не накапливающие рентгеноконтрастные средства объемные образования почек и забрюшинного пространства (например, кисты).
5. Легко визуализируются все структуры, расположенные вдоль предполагаемого пункционного канала (например, кишечные петли, легкое).
6. Изменение положения и наклона датчика позволяет получать изображение в разных плоскостях.
7. УЗИ в двумерном режиме позволяет точно контролировать положение иглы. Если во время пункции одновременно четко видны пунктируемый орган и игла, то игла не отклоняется от заданного направления.
Все манипуляции после пункции чашечно-лоханочной системы, например введение проводника, бужа или катетера, проводят под контролем рентгеноскопии. В отличие от иглы гибкие проводники или катетеры повторяют изгибы чашечно-лоханочной системы и легко исчезают из плоскости сканирования. Рентгеноскопия же позволяет точно контролировать продвижение рентгенопо-зитивных проводников и катетеров, не меняя положение больного и рентгеновской трубки. Изредка при расширении чашечно-лоханочной системы нефросто-мию можно выполнить под контролем УЗИ.
Перед пункцией чашечно-лоханочной системы больного укладывают на живот на стол рентгеновской установки. Чтобы зафиксировать почки и сгладить поясничный лордоз, под живот больного подкладывают
Таблица 8.1. Показания к пункции чашечно-лоханочной системы
Диагностические вмешательства
Антеградная пиелография Проба Уитакера
Лечебные вмешательства
Нефростомии
Антеградная установка мочеточникового стента
Антеградное бужирование мочеточника при стриктуре
Антеградная пиелотомия
Чрескожное растворение мочевых камней
Эндоскопическая нефролитотомия
Эндоскопические резекция и коагуляция опухолей верхних
мочевых путей
Глава 8. Антеградные вмешательства на мочевых путях
рентгенонегативные валики. Чаще всего иглу вводят по задней подмышечной линии на середине расстояния между XII ребром и гребнем подвздошной кости. Нефростома, установленная в этой области, не пережимается, когда больной ложится на спину. Чтобы плоскость сканирования прошла вдоль почки, ультразвуковой датчик устанавливают тотчас ниже XII ребра. Во время исследования используют стерильный гель. Положение и угол наклона датчика выбирают исходя из нормального расположения почки. Так, по данным экскреторной урографии продольная ось почки в норме расположена параллельно наружному краю большой поясничной мышцы, образуя со срединной плоскостью угол 30°, а по данным КТ поперечная ось почки в норме находится под углом 45° к фронтальной и сагиттальной плоскостям (рис. 8.1). Таким образом, ультразвуковой датчик располагают ниже XII ребра крани-ально от предполагаемого места пункции под углом 30° к срединной плоскости и наклоняют латерально под углом 45°. Затем положение датчика корректируют во время пункции с учетом индивидуальных особенностей больного.
Место пункции зависит от телосложения больного, топографии почки, ободочной кишки, селезенки, легкого, печени, патологии костей и цели пункции: верхние, средние или нижние почечные чашечки, дивертикул почечной чашечки. Например, иглу можно вводить даже над XI ребром, если по ходу предполагаемого пунк-ционного канала отсутствует легочная ткань. С другой стороны, стандартное место пункции приходится менять, если по ходу предполагаемого пункционного канала оказываются кишечные петли, печень или селезенка. УЗИ позволяет визуализировать все эти органы и выбрать самое безопасное место пункции.
Если пункция выполняется для отведения мочи или антеградной установки мочеточникового стента, то не столь важно, где именно игла войдет в чашечно-лоханоч-ную систему. Однако следует стремиться, чтобы пункци-онный канал проходил через почечную пирамиду в одну из задних почечных чашечек. Если игла проходит через шейку почечной чашечки, повышается риск повреждения сегментарных и междолевых сосудов. Если игла минует почечную паренхиму и напрямую попадает в чашечно-лоханочную систему, возникают трудности с бужированием пункционного канала и введением катетера, повышается вероятность смещения нефросто-мы. Иная ситуация наблюдается при эндоскопической нефролитотомии по поводу коралловидного камня или камня дивертикула почечной чашечки и некоторых других вмешательствах. Целью эндоскопической нефролитотомии при крупных коралловидных камнях является в первую очередь их дробление. При этом следует пунктировать заднюю нижнюю почечную чашечку. Отсюда легко провести инструменты в лоханку, а также в нижние, средние и частично верхние почечные чашечки. Фрагменты коралловидного камня, которые можно извлечь, удаляют сразу, оставшиеся дробят позже с помо-
щью дистанционной литотрипсии. Если коралловидный камень можно удалить целиком, обычно пунктируют средние или верхние почечные чашечки. Для удаления камней из дивертикулов почечных чашечек лучше всего пунктировать сам дивертикул. В любом случае следует проводить иглу через почечный сосочек. Это позволяет максимально свободно манипулировать инструментами.
Пунктируемую часть чашечно-лоханочной системы визуализируют с помощью УЗИ. Место пункции должно находиться на линии, проведенной вдоль ширины плоскости сканирования, каудально от ультразвукового датчика. На большинстве датчиков имеется метка, показывающая положение плоскости сканирования относительно датчика, или адаптер — приспособление для

Рисунок 8.1. УЗИ почек. А. Продольная ось почки образует угол 30° со срединной плоскостью. Б. Поперечная ось почки находится под углом 45° к фронтальной и сагиттальной плоскостям.
Глава 8. Антеградные вмешательства на мочевых путях
фиксации иглы и ориентации ее в плоскости сканирования. Кожу рассекают скальпелем (лезвие № 11). Затем ультразвуковой датчик устанавливают над разрезом. Это позволяет измерить расстояние до пунктируемого объекта. Через кожный разрез вводят пункционную иглу 16—18 G (рис. 8.2). До поверхностной фасции иглу можно продвигать вслепую, глубже — только под контролем УЗИ.
Основное правило пункции под контролем УЗИ — одновременная визуализация иглы и пунктируемого объекта. Иглу ориентируют так, чтобы четко видеть ее кончик. Выбор оптимального положения датчика может потребовать некоторого времени. Чтобы легче увидеть кончик иглы, ее слегка покачивают. Если угол между иглой и пунктируемым объектом слишком острый или слишком тупой, ее извлекают до подкожной клетчатки и вводят снова. Менять положение иглы таким образом можно многократно, но пунктировать почку лучше один раз. Точно направлять иглу вдоль плоскости сканирования помогает адаптер, на котором есть бороздка или канал для иглы. Адаптер стерилизуют и фиксируют на ультразвуковом датчике. В некоторых адаптерах заранее задано направление пункции (угол наклона к глубине плоскости сканирования), при этом оно обычно отражается на мониторе. Существуют случаи, когда адаптером лучше не пользоваться. Это объясняется его жесткой фиксацией на ультразвуковом датчике. Так, если необходимо изменить угол пункции, приходится менять положение датчика, а это уменьшает число возможных точек для пункции. Кроме того, жесткая фиксация адаптера не позволяет менять положение ультразвукового датчика и иглы независимо, если кончик иглы исчезает из плоскости сканирования. Чаще всего это происходит, когда игла наталкивается на препятствие (например, послеоперационный рубец), и чем глубже расположен пунктируемый объект, тем больше отклонение иглы.
Если пунктируемое образование небольшое и видно при УЗИ только на вдохе или выдохе, то смещение почки при дыхании затрудняет пункцию. В этом случае почечную капсулу прокалывают в той фазе дыхания, в которой на мониторе одновременно четко видны игла и пунктируемый объект (рис. 8.3). Следует помнить, что в момент пункции почечной капсулы игла чуть отталкивает почку и на мгновение качество изображения на мониторе ухудшается. Однако после того как кончик иглы оказывается в почечной паренхиме, он становится виден особенно четко, поскольку эхогенность почечной паренхимы ниже эхогенности окружающих тканей, а киста почки, расширенные почечные чашечки или лоханка анэхогенны. Четкая одновременная визуализация кончика иглы, находящегося в пунктируемом объекте, и собственно пунктируемого объекта подтверждает правильное выполнение пункции. Если игла упирается в камень, появляется ощущение соприкосновения с твердым предметом. При этом на мониторе видно, как камень смещается.
После пункции вводят небольшое количество рентге-ноконтрастного средства. Если положение иглы пра- вильное, контрастируется чашечно-лоханочная система. Если пункция не удалась, рентгеноконтрастное средство попадает в околопочечную клетчатку, междолевые вены или оказывается между почечными чашечками и парен- химой. В первом случае рядом с пунктируемой почечной чашечкой появляется бесформенный затек, во втором - она оказывается погруженной в сеть из контрастирован- ных сосудов, в третьем — на рентгенограмме появляются контуры чашечно-лоханочной системы, что иногда оши- бочно считают признаком успешной пункции. Чтобы не затруднять контроль дальнейших манипуляций, нужно вводить как можно меньше рентгеноконтрастного сред- ства. Следует помнить, что большие затеки могут сдав- ливать пунктируемую почечную чашечку и затруднять пункцию. В сомнительных случаях положение иглы уточняют с помощью УЗИ и сравнивают его данные с ре- зультатами рентгеноскопии. Если кончик иглы находит- ся рядом с пунктируемым объектом (чтобы легче увидеть кончик иглы, ее слегка покачивают), иглу извлекают на несколько миллиметров, а затем вновь продвигают в вы- бранном направлении. Все манипуляции после пункции чашечно-лоханочной системы проводят под контролем рентгеноскопии.
Для пункции используют тонкую иглу (20—22 G). Предварительно выполняют экскреторную урографию или ретроградную пиелографию. В последнем случае, если чашечно-лоханочная система не расширена, для облегчения пункции в лоханочно-мочеточниковый сегмент можно ввести баллонный мочеточниковый кате- тер и слегка раздуть баллон. Мягкие ткани прокалывают

Рисунок 8.2.Набор для нефростомии (Bard-Angiomed, США). 1. Вводимые один в другой игла 17,5 G и катетер 6 F с мандре-ном. 2. Игла 22 G. 3. Полужесткий проводник диаметром 0,9 мм с J-образным кончиком. 4. Вводимые один в другой буж 10 F и проводниковый катетер 12 F. 5. Катетер для нефростомии 10 Fc крючковидным кончиком.
Глава 8. Антеградные вмешательства на мочевых путях

|

|
Рисунок 8.3. Пункция задней нижней почечной чашечки под контролем УЗИ. Игла должна находиться в плоскости сканирования.
иглой 16—18 G, затем через ее просвет вводят тонкую иглу (рис. 8.4). При этом толстая игла удерживает тонкую. После пункции чашечно-лоханочной системы по тонкой игле как по проводнику продвигают толстую иглу. Затем тонкую иглу извлекают, а через просвет толстой иглы вводят проводник. Мочу, полученную при пункции чашечно-лоханочной системы, особенно при подозрении на инфекцию мочевых путей, направляют на посев.
АНТЕГРАДНАЯ ПИЕЛОГРАФИЯ И
ПРОБА УИТАКЕРА
Диагностическая антеградная пиелография проводится редко, поскольку существуют менее инвазивные исследования: экскреторная урография с томографией, ретроградная пиелография, УЗИ, КТ и МРТ. Однако антеградная пиелография является неотъемлемой частью пункции чашечно-лоханочной системы. Перед введением рентгеноконтрастного средства для декомпрессии блокированной чашечно-лоханочной системы из нее удаляют мочу. Чтобы получить детальное изображение чашечно-лоханочной системы, рентгеноконтраст-ное средство разводят до концентрации 20—30%. В этом случае антеградная пиелография по чувствительности приближается к ретроградной.
Антеградную пиелографию выполняют также перед пробой Уитакера — функциональным исследованием лоханочно-мочеточникового сегмента. Эта проба показана 10—30% больных с расширением верхних мочевых путей, когда сцинтиграфия почек после введения диуретика не позволяет судить о наличии обструкции (гл. 10). Чаще всего это наблюдается при обструкции пузырно-мо-четочникового сегмента, поскольку при обструкции лоханочно-мочеточникового сегмента сцинтиграфия почек после введения диуретика более информативна.
Проба Уитакера подразумевает одновременное измерение внутрилоханочного и внутрипузырного давления
и определение лоханочно-пузырного градиента — разности внутрилоханочного и внутрипузырного давления. Во время пробы проводят антеградную перфузию лоханки со скоростью 5, 10, 15 и 20 мл/мин. Пункцию чашечно-лоханочной системы выполняют толстой иглой с надетым на нее катетером 6 F, затем иглу извлекают. Перфузию начинают со скоростью 5—10 мл/мин до тех пор, пока не стабилизируется внутрилоханочное давление и не контрастируются верхние мочевые пути (рис. 8.5). Внутрилоханочное давление измеряют периодически

Рисунок 8.4. Варианты пункции чашечно-лоханочной системы. А. Пункция толстой иглой 16—18 G (игла введена в катетер) под контролем УЗИ. Б. Пункция тонкой иглой под контролем рентгеноскопии (тонкая игла проведена через толстую, на которую, в свою очередь, надет катетер).
Глава 8. Антеградные вмешательства на мочевых путях
(для этого используют одноканальный катетер, соединенный с манометром через трехходовой кран) или постоянно (для этого используют двухканальный или два одноканальных катетера). Если предварительно не от-калибровать манометр для разных скоростей перфузии, то постоянное измерение давления с помощью од-ноканального катетера с трехходовым краном часто дает ошибки. При этом чем меньше диаметр катетера и выше скорость перфузии, тем больше оказывается давление. Манометр; измеряющий внутрилоханочное давление, должен быть расположен на уровне почечной лоханки, измеряющий внутрипузырное давление — на уровне мочевого пузыря. В норме при скорости перфузии 10 мл/мин лоханочно-пузырный градиент составляет 13 см вод. ст., при легкой обструкции — 14—22 см вод. ст., при умеренной и тяжелой обструкции — более 22 см вод. ст. При скорости перфузии 15 мл/мин лоханочно-пузырный градиент в норме не должен превышать 18 см вод. ст., при скорости перфузии 20 мл/мин — 21 см вод. ст.
НЕФРОСТОМИЯ
Нефростомия показана в тех случаях, когда катетеризация мочеточников опасна (например, при инфекции, обусловленной обструкцией или сдавлением мочеточника) или невозможна (например, когда катетер не проходит выше камня, опухоли или стриктуры). Нефростому устанавливают для растворения мочевых камней и проведения пробы Уитакера, а также оставляют на несколько суток после антеградных вмешательств на мочевых путях. При необходимости через нефростому можно установить мочеточниковый стент. Это вмешательство можно планировать даже после неудачной ретроградной установки стента, особенно в тех случаях, когда она не удалась из-за выраженной извитости мочеточника, наличия мочеточниково-влагалищного свища или мочевого затека, а также из-за трудностей при обнаружении устья мочеточника после его имплантации в подвздошную кишку.
Диаметр пункционного канала зависит от того, какой катетер будет использоваться для нефростомии. Для пробы Уитакера достаточно тонкого катетера 6 F. Его вводят в чашечно-лоханочную систему одномоментно с иглой, которой проводят пункцию (рис. 8.2). Если нефростомия выполняется для отведения мочи или планируется антеградная установка мочеточникового стента, необходимы катетеры большего диаметра и бужирование пункционного канала. Для этого через иглу или введенный с ее помощью тонкий катетер в чашечно-лоханочную систему сначала вводят проводник диаметром 0,9—1 мм. Лучше использовать проводники с J-образными кончиками, которые меньше травмируют почечную лоханку, чем прямые. Основной недостаток гибких проводников — скручивание при введении бужей. Этого недостатка лишены полужесткие проводники с гибким кончиком, вводимым в почечную лоханку, например проводник Лундерквиста. Если провод-
ник застревает в узкой шейке расширенной почечной чашечки или упирается в камень, то его положение исправляют, манипулируя тонким катетером, через который вводился проводник. С этой же целью можно использовать ангиографический катетер с изогнутым кончиком (рис. 8.6, А). После того как проводник оказывается в нужном месте (одна из верхних почечных чашечек, почечная лоханка, проксимальный отдел мочеточника), по нему под контролем рентгеноскопии вращательными движениями вводят рентгеноконтра-стные бужи. Гибкие пластмассовые бужи вводят, увеличивая диаметр на 2 F. При использовании жестких металлических или кевларовых инструментов сначала вводят буж 6 F, а затем сразу буж 10—12 F.

Рисунок 8.5. Проба Уитакера при гидроуретере и гидронефрозе после уретероцистонеостомии (синдром Игла— Баррет-та). При скорости перфузии 10 мл/мин лоханочно-пузырный градиент составляет 10 см вод. ст., что подтверждает отсутствие обструкции.
Глава 8. Антеградные вмешательства на мочевых путях
После бужирования пункционного канала по проводнику легко вводится относительно жесткий полиэтиленовый катетер. Для введения мягких силиконовых или полиуретановых катетеров необходим проводниковый катетер. Он существенно облегчает антеградную установку мочеточниковых стентов, а также введение катетеров с изогнутыми кончиками (например, свернутыми кольцом). Эти катетеры сразу после удаления проводника и проводникового катетера приобретают заданную форму и удерживаются в чашечно-лоханочной системе. Проводниковый катетер вводят вместе с бужом наибольшего диаметра (рис. 8.6, Б и В). Он создает универсальный доступ к чашечно-лоханочной системе. Через него можно вводить катетеры, мочеточниковые стенты, баллонные дилататоры, а также страховочные и рабочие проводники, используемые для бужирования пункционного канала до большого диаметра, необходимого для эндоскопических вмешательств (рис. 8.6, Г). Катетеры для нефростомии не должны быть слишком жесткими, чтобы не травмировать почечную лоханку и не вызывать
боль. Лучше использовать самоудерживающиеся катетеры. Обычный, не самоудерживающийся, катетер следует вводить достаточно глубоко, чтобы он не выпадал из чашечно-лоханочной системы при смещении почки. Чаще всего для нефростомии используют катетеры Ма-леко и катетеры с крючковидным или петлевидным кончиком. Последние особенно надежно удерживаются в почечной лоханке. Однако если больной случайно вытащит такой катетер, возможна серьезная травма почки.
Проводниковый катетер позволяет выполнить антеградную установку мочеточникового катетера или стента. Катетеры с открытыми кончиками проталкивают интубатором по предварительно введенному в мочевой пузырь проводнику. Катетеры и стенты с закрытыми кончиками вводят с мандреном. Независимо от типа катетера или стента перед введением через отверстия на его проксимальном конце продевают лигатуру. С ее помощью катетер или стент можно подтянуть назад, если он установлен слишком низко. После установки стента или катетера сначала вытягивают лигатуру, а затем уда-

Рисунок 8.6. Нефростомии. А. Полужесткий проводник с J-образным кончиком введен в просвет иглы, на которую надет тонкий катетер. С помощью катетера проводник проведен в почечную лоханку. Б. По проводнику введен буж, на который надет проводниковый катетер. Жесткая проксимальная часть проводника не позволяет ему скручиваться за пределами почечной лоханки. В. Буж введен в чашечно-лоханочную систему. По нему вводится проводниковый катетер. Г. Через проводниковый катетер по проводнику вводят катетер для нефростомии с крючковидным кончиком.
Глава 8. Антеградные вмешательства на мочевых путях
ляют интубатор или мандрен. Проводниковый катетер используют также во время баллонной дилатации стриктур мочеточника. Баллонный дилататор имеет диаметр 7 F и вводится по проводнику. Максимальное давление в баллоне — 15 атм. С помощью этого инструмента удается расширить просвет мочеточника до 12—18 F. После дилатации в мочеточнике на несколько недель оставляют стент 8— 10 F. Баллонная дилатация мочеточника особенно эффективна при свежих послеоперационных стриктурах. Исключение составляет обструкция лоха-ночно-мочеточникового сегмента. При длительно существующих стриктурах, стриктурах, возникших после расширенных операций на органах малого таза (вследствие ишемии мочеточника) или лучевой терапии, а также при сдавлении мочеточника опухолью баллонная дилатация неэффективна. Отдаленные результаты этого вмешательства не известны, потому что оно появилось недавно. Кроме того, многие авторы проводят больным по нескольку сеансов баллонной дилатации.
ЧРЕСКОЖНОЕ РАСТВОРЕНИЕ
МОЧЕВЫХ КАМНЕЙ
Через нефростому можно вводить средства для растворения почечных камней. Это возможно при камнях из цис-тина, мочевой кислоты, трипельфосфатов и фосфата кальция. После внедрения в практику дистанционной литотрипсии и средств для растворения мочевых камней для приема внутрь (эффективны при уратных камнях) чрескожное растворение мочевых камней используется лишь как дополнительный метод лечения после эндоскопической или открытой нефролитотомии и дистанционной литотрипсии. Как самостоятельный метод лечения чрескожное растворение мочевых камней применяют при высоком анестезиологическом риске. Среди недостатков чрескожного растворения почечных камней следует отметить длительную госпитализацию при крупных камнях из цистина, трипельфосфатов или фосфата кальция, а также высокий риск гипермагниемии и инфекционных осложнений вплоть до сепсиса при растворении инфицированных камней.
Чтобы снизить риск осложнений, при чрескожном растворении мочевых камней нужно использовать два катетера: один для введения лекарственных средств, второй — для эвакуации жидкости. Для этого устанавливают две нефростомы (отдельно или вместе, рис. 8.7, А). Можно также вводить лекарственные средства через нефростому, а эвакуировать жидкость через мочеточниковый катетер (рис. 8.7, Б). Чтобы создать высокую концентрацию препарата вблизи камня, нужно как можно ближе подвести к нему катетер. Очень важна полная эвакуация жидкости из чашечно-лоханочной системы. Повышение внутрилоханочного давления более 30 см вод. ст. приводит к пиелотубулярному и пиеловенозному рефлюксу, попаданию в кровь средств для растворения мочевых камней и реже инфицированной мочи, то есть к гипермагниемии (хемиацидрин и растворы Сьюби G и Сью-
би М содержат соли магния) и инфекционным осложнениям. Чрескожное растворение мочевых камней возможно только в отсутствие инфекции мочевых путей или на фоне антимикробной терапии. Процедуру начинают
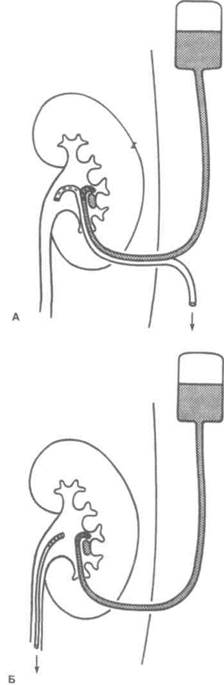
Рисунок 8.7. Чрескожное растворение мочевых камней. А. Введение препарата и эвакуация жидкости через две нефростомы. Б. Введение препарата через нефростому, эвакуация жидкости через мочеточниковый катетер.
Глава 8. Антеградные вмешательства на мочевых путях
с введения физиологического раствора. Следует подобрать минимальную высоту, на которой расположен флакон, чтобы обеспечить скорость введения 100—120 мл/ч. Неприятные ощущения, боль и подтекание раствора мимо нефростомы свидетельствуют о неполной эвакуации жидкости из чашечно-лоханочной системы. Больных предупреждают, что при появлении этих симптомов введение препарата следует сразу же прекратить.
Для растворения уратных камней используют натрия или калия бикарбонат, цистиновых — пеницилламин, ацетилцистеин или трометамол, камней из трипельфос-фатов или фосфата кальция — растворы Сьюби G и Сьюби М или хемиацидрин (последний не одобрен FDA для этой цели). Больного тщательно наблюдают, регулярно измеряют температуру тела, через день определяют уровни креатинина, фосфата (при введении хемиацидрина) и магния (при введении хемиацидрина, растворов Сьюби G и Сьюби М) в сыворотке. Время, необходимое для растворения камня, зависит от его состава и размера и колеблется от нескольких суток (при уратных камнях) до нескольких недель (при цистиновых и трипельфос-фатных камнях).
ЭНДОСКОПИЧЕСКИЕ
ВМЕШАТЕЛЬСТВА НА ПОЧКЕ
Для нефроскопии используются эндоскопы со стволами 15—26 F. Их вводят чрескожно. Стандартные жесткие нефроскопы имеют диаметр 24—26 F и снабжены боковым окуляром (рис. 8.8, А). Центральный манипуляци-онный канал нефроскопа предназначен для введения различных жестких инструментов: литоэкстракторов,
механических литотрипторов, зондов для ультразвуковой контактной литотрипсии (рис. 8.8, Б). Существуют и гибкие нефроскопы. Они снабжены механизмом, обеспечивающим сгибание кончика прибора. Это облегчает осмотр труднодоступных участков чашечно-лоханочной системы. Диаметр манипуляционного канала в гибких нефроскопах меньше. В связи с этим использовать инструменты большого диаметра при работе с ними нельзя. Через манипуляционный канал гибкого нефроскопа вводят корзинки, гибкие литоэкстракторы, источники для электрогидравлической и лазерной контактной литотрипсии. Гибкие нефроскопы уступают жестким по качеству изображения и прочности.
С диагностической целью нефроскопию проводят редко. Как правило, ее выполняют во время эндоскопической нефролитотомии. Следует сказать, что сегодня в 90% случаев при камнях чашечно-лоханочной системы проводят дистанционную литотрипсию. Эндоскопическая нефролитотомия показана при крупных камнях, невозможности сфокусировать ударные волны на камне, а также в тех случаях, когда обструкция обусловлена различной патологией мочевых путей, осложненной мочекаменной болезнью. Кроме того, эндоскопически можно выполнить антеградную пиелотомию при обструкции лоханочно-мочеточникового сегмента, а также паллиативную операцию при опухолях почечной лоханки и мочеточника.
Для введения нефроскопа в чашечно-лоханочную систему пункционный канал бужируют до 24—30 F. Существуют разные методики бужирования. Все бужи вводят по рабочему проводнику. Одновременно с ним вводят страховочный проводник. Его устанавливают в одной из

|

|
Рисунок 8.8. Жесткий нефроскоп. А. Ствол с системой постоянной подачи жидкости, эндоскоп с боковым окуляром и центральным манипуляционным каналом, жесткие литоэкстракторы и механические литотрипторы. Б. Литоэкстракторы и механические литотрипторы для эндоскопической нефролитотомии.
Глава 8. Антеградные вмешательства на мочевых путях
верхних почечных чашечек или в проксимальном отделе мочеточника на тот случай, если буж и рабочий проводник случайно сместятся из пункционного канала. Установку рабочего и страховочного проводников облегчает введение проводникового катетера. По рабочему проводнику вводят телескопические бужи Алкена, пластмассовый буж наименьшего диаметра или баллонный дилататор (рис. 8.9, А). Баллонный дилататор имеет диаметр 9 F. С его помощью можно расширить пункционныи канал до 30 F, при этом в баллоне создается давление до 15 атм. Баллонная дилатация пункционного канала невозможна при наличии рубцов вокруг почки после предыдущих операций. Пластмассовые бужи позволяют расширять пункционныи канал под контролем рентгеноскопии. Бужи вводят один за другим, постепенно увеличивая диаметр. Недостатком этого варианта бужирования является то, что каждый раз при извлечении бужа в чашечно-лоханочную систему попадает кровь, которая затрудняет дальнейшие манипуляции. Телескопические бужи Алкена, изготовленные из металла, позволяют расширять пункционныи канал даже при наличии рубцов вокруг почки и предупреждают кровотечение (рис. 8.9, Б).
После бужирования вводят металлический (24—26 F) или пластмассовый (28—30 F) ствол нефроскопа. Если проводилась баллонная дилатация пункционного канала, ствол вводят по баллонному дилататору, если использовались бужи — по бужу наибольшего диаметра. Пластмассовый ствол предпочтительнее, если предполагаются длительные манипуляции на чашечно-лоха-ночной системе, например при удалении коралловидного камня. Через широкий пластмассовый ствол легче промывать чашечно-лоханочную систему, не повышая внутрилоханочное давление, и извлекать крупные фрагменты камней.
Камни почечных чашечек и лоханки
Появление дистанционной литотрипсии сильно ограничило показания к эндоскопической нефролитото-мии. Сегодня ее проводят в следующих случаях.
1. Обструкция мочевых путей, вызванная дивертикулом почечной чашечки, стенозом лоханочно-мочеточни-кового сегмента или другой патологией, осложненной мочекаменной болезнью (рис. 8.10). Во всех этих случаях дистанционная литотрипсия позволяет раздробить камни, однако имеющаяся обструкция препятствует самопроизвольному отхождению их фрагментов.
2. Крупные камни диаметром более 3 см или площадью поверхности более 500 мм2, например коралловидные (рис. 8.11). Такие камни можно раздробить только за несколько сеансов дистанционной литотрипсии. Однако отхождение большого количества песка и мелких фрагментов вызывает обструкцию мочевых путей, боль, повышает риск инфекционных осложнений. В связи с этим при коралловидных камнях на
первом этапе выполняют эндоскопическую нефроли-тотомию, а фрагменты, которые не удалось извлечь, дробят с помощью дистанционной литотрипсии.
3. Невозможность сфокусировать ударные волны на камне. Обычно это наблюдается при аномалиях положения почки, обусловленных патологией мочевых путей или опорно-двигательного аппарата, а также при камне пересаженной почки.
4. Камни, даже небольшие, расположенные в нижних почечных чашечках. Эффективность дистанционной литотрипсии в этом случае не превышает 60%.
Эндоскопическую нефролитотомию гораздо чаще выполняют при крупных коралловидных камнях, чем при мелких, которые можно удалить целиком. Для последних существует множество разнообразных жестких литоэкс-тракторов и механических литотрипторов (рис. 8.8, Б). Для удаления камней из труднодоступных почечных чашечек используют корзинки и гибкие литоэкстрак-торы, вводимые через гибкие нефроскопы. Крупные камни перед извлечением дробят с помощью механического, ультразвукового или электрогидравлического воздействия. Браншевый литотриптор (сконструирован на основе механического литотриптора, используемого для дробления камней мочевого пузыря) применим только при широкой почечной лоханке. Полые зонды для ультразвуковой контактной литотрипсии по-

Рисунок 8.9. Бужирование пункционного канала перед нефро-скопией. А. По рабочему проводнику через проводниковый катетер вводят телескопические бужи Алкена. По проводниковому катетеру предварительно введен страховочный проводник. После бужирования вводят пластмассовый или металлический ствол нефроскопа. Б. Телескопические бужи Алкена для бужирования пункционного канала.
Глава 8. Антеградные вмешательства на мочевых путях
зволяют дробить камень, непрерывно удаляя песок и мелкие фрагменты. Электрогидравлическое воздействие мощнее ультразвукового, поэтому электрогидравлическая контактная литотрипсия позволяет быстро разрушать крупные и прочные камни. Кроме того, ее можно проводить с помощью гибкого нефроскопа. Среди недостатков этого метода следует отметить невозможность постоянного удаления песка и фрагментов камней, высокий риск их попадания в труднодоступные почечные чашечки и травмы почечной лоханки. При мягких мочевых камнях предпочтительна ультразвуковая контактная литотрипсия. Твердые мочевые камни дробят до диаметра, позволяющего извлечь их по стволу нефроскопа. Фрагмент коралловидного камня, расположенный в лоханочно-мочеточниковом сегменте, удаляют в последнюю очередь, так как он препятствует смещению других фрагментов в мочеточник. С той же целью можно использовать вводимые антеградно или ретроградно баллонные катетеры. Однако в большинстве случаев удается обойтись без дополнительного ретроградного вмешательства.
Во время эндоскопической нефролитотомии в чашеч-но-лоханочную систему вводят физиологический раствор. При проведении электрогидравлической контактной литотрипсии физиологический раствор в 6—7 раз разводят дистиллированной водой. Следует помнить, что даже при использовании широких пластмассовых стволов, обеспечивающих низкое внутрилоханочное давление, травма мелких вен и длительные внутрипо-чечные манипуляции могут приводить к всасыванию большого количества вводимой жидкости. Если она ги-потонична, возникает состояние, аналогичное ТУР-син-дрому. Для профилактики пиеловенозного рефлюкса во время операции вводят диуретики, например маннитол, 12,5 г в/в. При подозрении на травму мочевых путей проводят антеградную пиелографию. По окончании эн-
доскопической нефролитотомии выполняют рентгенографию живота и устанавливают нефростому. С этой целью можно использовать катетер Фоли, раздувая баллон 5 мл жидкости. Катетер Фоли устанавливают через окончатый троакар или пластмассовый ствол нефроскопа. Последний перед извлечением разрезают вдоль. В почечную лоханку можно установить также катетер Малеко или любой прямой полиэтиленовый катетер, например катетер, используемый для дренирования плевральной полости. Эти катетеры обязательно подшивают к коже. Чтобы удостовериться в правильном положении катетера, проводят антеградную пиелографию.
Нефростому оставляют на 1—4 сут в зависимости от сложности вмешательства и выраженности гематурии. Если показана дистанционная литотрипсия, то ее выполняют через 1—4 сут после эндоскопической нефролитотомии. В этом случае нефростому не удаляют. Это облегчает отхождение песка и фрагментов камней после дистанционной литотрипсии и позволяет выполнить повторное эндоскопическое вмешательство для удаления фрагментов, не отошедших самостоятельно.
Обструкция лоханочно-мочеточникового сегмента
Вместе с эндоскопической нефролитотомией появились и другие эндоскопические вмешательства на верхних мочевых путях. Одно из них — антеградная пиелотомия при обструкции лоханочно-мочеточникового сегмента. Если при баллонной дилатации лоханочно-мочеточникового сегмента суженный участок расширяется во всех направлениях, то при антеградной пиелотомии лоханоч-но-мочеточниковый сегмент рассекают только в одном месте на определенную длину до околопочечной клетчатки. После операции в лоханочно-мочеточниковый сегмент на 4—6 нед устанавливают стент. Это предупре-

|

|
Рисунок8.10. Камень дивертикула верхней почечной чашечки. В этом случае показана эндоскопическая нефролитотомия. А. Рентгенограмма живота. Б. Экскреторная урограмма.
Рисунок 8.11. Коралловидный камень. В этом случае показаны эндоскопическая нефролитотомия и дистанционная литотрипсия. А. Рентгенограмма живота. Б. Экскреторная урограмма.
Глава 8. Антеградные вмешательства на мочевых путях
ждает рецидив обструкции после заживления раны, как при интубационной уретеротомии по Дейвису.
Эффективность антеградной пиелотомии у больных, не получавших лечение, составляет 65—95%, у больных с рецидивом обструкции после открытой пиелопласти-ки — 89%. Для сравнения эффективность ретроградной пиелотомии составляет 79—94%, ретроградной пиелотомии с помощью катетерного электроножа (Акью-сайз) — 73—81 %. Следует отметить, что число больных, которым были выполнены ретроградные вмешательства, и продолжительность наблюдения за ними меньше, чем соответствующие показатели для антеградной пиелотомии. Результаты антеградной и ретроградной пиелотомии лучше при легком гидронефрозе в отсутствие ХПН. В большинстве публикаций эффективность антеградной пиелотомии определяют не по объективным критериям — уменьшению размеров чашечно-лоханоч-ной системы по данным экскреторной урографии или УЗ И (как это делают для открытой пиелопластики), а по улучшению самочувствия больных. Неудачные исходы, как правило, объясняют наличием аномальных сосудов, сдавливающих почечную лоханку, а также ее перерастяжением и функциональной неполноценностью (во время открытой операции избыток стенки можно иссечь). Последнее объясняется законом Лапласа: при одинаковом внутрилоханочном давлении напряжение в стенке почечной лоханки тем больше, чем больше она расширена. Вероятно, именно повышение напряжения в стенке почечной лоханки, а не повышение внутрилоханоч-ного давления в результате обструкции мочевых путей является основной причиной прогрессирующего расширения чашечно-лоханочной системы. Выполнять открытую пиелопластику больным с рецидивом обструкции лоханочно-мочеточникового сегмента после антеградной или ретроградной пиелотомии гораздо труднее, чем больным, не получавшим лечение. Это связано с массивным фиброзом клетчатки вокруг мочеточника после мочевых затеков.
Опухоли почечной лоханки
Еще один вид эндоскопических операций на почечной лоханке — электрорезекция, электрокоагуляция и лазерная коагуляция опухолей. В последнем случае используется ИАГ-неодимовый лазер. Эффективность эндоскопических операций сравнима с таковой открытых вмешательств, однако исследования, посвященные изучению эндоскопических операций при опухолях почечной лоханки, пока немногочисленны. В перспективе эндоскопические операции могут заменить нефрэкто-мию при раке почечной лоханки I стадии, а также выполняться с паллиативной целью.
ПУНКЦИЯ И БИОПСИЯ
Пункцию кистозных и солидных образований почки и забрюшинного пространства обычно проводят с диаг-
Таблица 8.2. Показания к пункции объемных образований почки и забрюшинного пространства
Диагностические вмешательства
Получение жидкости
Биохимическое исследование
Посев и определение чувствительности к антимикробным средствам
Цитологическое исследование Кистография
Пункционная биопсия Лечебные вмешательства Дренирование
Абсцесс
Гематома
Лимфатическая киста
Мочевой затек Склеротерапия
Простая киста почки
ностической целью, реже пункция носит лечебный характер и проводится для дренирования или склероте-рапии (табл. 8.2 и 8.3). Большинство этих образований рентгенонегативны и не визуализируются после в/в введения рентгеноконтрастного средства, поэтому их пункцию проводят под контролем УЗИ или КТ. Техника пункции объемного образования под контролем УЗИ не отличается от таковой при пункции чашечно-лоханочной системы. Размер и форма иглы зависят от цели пункции. Если необходимо получить материал для цитологического исследования, берут тонкие иглы 20—22 G (такие же иглы используются для пункции предстательной железы). Каких-либо преимуществ одного типа игл перед другими при этом не показано. Для пункционного дренирования кист почки и скоплений жидкости в забрюшинном пространстве (мочевой затек, лимфатическая киста) используется набор для неф-ростомии. В полость на несколько суток устанавливают
Таблица 8.3. Дифференциальная диагностика объемных образований почки и забрюшинного пространства
Кистозное образование почки
Простая киста почки
Расширение почечной чашечки
Абсцесс
Гематома
Кистозная доброкачественная или злокачественная опухоль
Озлокачествленная киста
Скопление жидкости в забрюшинном пространстве
Мочевой затек
Лимфатическая киста
Гематома
Абсцесс
Кистозная доброкачественная или злокачественная опухоль
Солидное образование почки и забрюшинного пространства
Доброкачественная опухоль
Злокачественная опухоль, в том числе метастатическая
Глава 8. Антеградные вмешательства на мочевых путях
тонкий катетер 6—10 F. Для дренирования густого содержимого при гематоме или абсцессе нужен толстый катетер 14—20 F, а его установка требует бужирования пункционного канала. Пункционную биопсию почки выполняют иглами 14—16 G, например иглой Франклина— Силвермена или иглой Тру-Кат. Пункцию безопаснее проводить через нижний полюс почки.
Кистозные образования почки
Кистозные образования почки часто оказываются случайной находкой при УЗИ или КТ. По данным аутопсий эту патологию обнаруживают у 50% умерших в возрасте старше 50 лет. При УЗИ простая киста почки выглядит как гладкостенное анэхогенное округлое образование. Локализация простых кист разнообразна: они могут выбухать наружу, располагаться в почечной паренхиме или почечной пазухе, сдавливая чашечно-ло-ханочную систему. Дифференцировать кисты с перегородками, многокамерные кисты и опухоли при УЗИ невозможно. В этих случаях показана КТ, реже пункция. Последнее вмешательство проводят при кистах с толстой неравномерной стенкой и эхогенными включениями в полости, при гематурии, а также если плотность содержимого кисты по данным КТ выше, чем плотность серозного экссудата. Лечение (удаление содержимого и введение склерозирующих средств) показано только в том случае, если киста сдавливает мочевые пути или вызывает боль.
Исследования, которым подвергают содержимое кис-тозных образований почки, зависят от предположительного диагноза. При подозрении на злокачественную опухоль показано цитологическое исследование. Следует отметить, что озлокачествление кист почки происходит очень редко, а злокачественные опухоли почки с кистозной дегенерацией обычно выявляют при УЗИ и КТ. Простые кисты почки обычно содержат прозрачную жидкость соломенного цвета с низким содержанием белка и жиров, а также с низкой активностью ЛДГ (менее 250 МЕ/л). Для злокачественных опухолей характерно геморрагическое или темное содержимое с высоким содержанием белка, жиров и высокой активностью ЛДГ. После аспирации 20—30% содержимого кисты в ее полость вводят такой же объем рентге-ноконтрастного средства (разведенного до концентрации 60%) и проводят рентгенографию в положениях стоя, лежа на животе, на спине и на боку, а также в положении Тренделенбурга. При необходимости эвакуируют еще 20—30% содержимого кисты и вводят такой же объем воздуха, выполняя рентгенографию с двойным контрастированием. Если планируется склеротерапия, то после удаления содержимого кисты в ее полость вводят йофендилат или 95% этанол. Объем скле-розирующего средства должен составлять примерно 10—20% объема содержимого кисты. Обычно он равен 10—100 мл. Через 30 мин склерозирующее средство удаляют.
Скопление жидкости в забрюшинном пространстве
Скопление жидкости в забрюшинном пространстве (мочевой затек, лимфатическая киста) обычно является осложнением различных операций. Мочевой затек может возникать также в результате травмы почки или острой обструкции мочевых путей. Пункционное дренирование забрюшинного пространства в большинстве случаев позволяет обойтись без открытой операции. Как правило, для дренирования мочевого затека или лимфатической кисты достаточно тонкого катетера 6—10 F со множеством боковых отверстий. Чтобы прекратить накопление жидкости и устранить полость, требуются дополнительные манипуляции. При мочевом затеке показана установка мочеточникового катетера или нефросто-мы, которые оставляют до тех пор, пока не прекратится выделение мочи по дренажу. Лимфатические кисты, ко-

Рисунок8.12. Пункционное дренирование лимфатической кисты, которая смещает и сдавливает мочеточник.
Глава 8. Антеградные вмешательства на мочевых путях
торые чаще всего возникают после тазовой или поясничной лимфаденэктомии и трансплантации почки, в большинстве случаев исчезают самостоятельно. Однако крупная лимфатическая киста (обычно после поясничной лимфаденэктомии) может вызывать боль и даже обструкцию мочевых путей (рис. 8.12). В этом случае показаны пункция, парентеральное питание и давящая повязка на живот. Если через неделю истечение лимфы продолжается, проводят операцию. Выполняют лапа-ротомию, кисту вскрывают, перевязывают или коагулируют лимфатические сосуды, подшивают стенки кисты к брюшине.
Для дренирования густого содержимого (кровь, гной) необходимы толстые катетеры 14—20 F. Околопочечная гематома обычно возникает после травмы почки или операций и гораздо реже при нарушениях гемостаза или разрыве опухоли почки. Небольшие гематомы
обычно рассасываются самостоятельно, поэтому больные нуждаются лишь в периодическом проведении УЗИ или КТ. Если гематома нарастает, показана открытая операция. Пункционное дренирование обычно проводят при нагноении гематомы. Паранефрит чаще всего представляет собой осложнение открытых операций на почке. Реже заболевание обусловлено гематогенным распространением инфекции. Пункционное дренирование под контролем КТ показано только при одиночных абсцессах.
Опухоли почки и забрюшинного пространства
Пункция опухолей почки или забрюшинного пространства показана, когда неинвазивные исследования не позволяют поставить диагноз, а результат цитологическо-
|
|
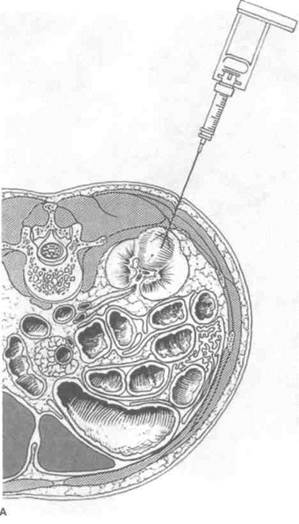
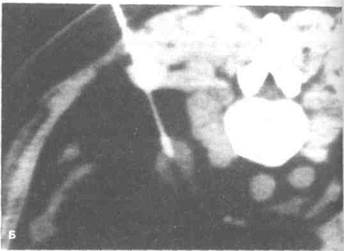
Рисунок 8.13. Пункция опухоли почки. А. Схема пункции. Б. Пункция опухоли (рак почки) под контролем КТ.
Глава 8. Антеградные вмешательства на мочевых путях
го исследования может повлиять на тактику лечения (рис. 8.13). Если диагноз не представляет сомнений и планируется хирургическое лечение, пункцию не выполняют. Когда характер опухоли не ясен и возможно органосохраняющее лечение, лучше провести срочное гистологическое исследование во время операции. Если есть малейшие сомнения в злокачественности опухоли, лучше выполнить пункцию и избежать нефрэктомии. Пункция показана также при множественных опухолях почки, особенно при подозрении на метастазы в почку. В 10—25% случаев цитологическое исследование дает ложноотрицательные результаты. Кроме того, нормальные клетки почечного эпителия достаточно трудно отличить от высокодифференцированных опухолевых. Изредка после пункции опухоли наблюдаются метастазы по ходу пункционного канала. Аспират сразу же наносят на предметное стекло и фиксируют этиловым спиртом (если планируется стандартная окраска по Папани-колау).
Биопсия почки
Биопсию почки выполняют для дифференциальной диагностики болезней почек. Ее проводят открытым или пункционным способом. Чтобы получить кусочек ткани, пункционную биопсию выполняют с помощью толстых игл 14—16 F, например иглы Франклина—Силвер-мена или иглы Тру-Кат. Пункционную биопсию следует проводить под контролем УЗИ или рентгеноскопии. Основное осложнение этой процедуры — кровотечение. Оно развивается в 5% случаев. Летальность биопсии почки — 0,1%. Кровотечение возможно даже в том случае, когда пунктируется нижний полюс почки и ранение крупных сосудов маловероятно. Гематомы после биопсии почки обычно рассасываются самостоятельно. Больным регулярно проводят УЗИ или КТ. В отдельных случаях для остановки кровотечения после биопсии почки требуются эмболизация кровоточащего сосуда, ревизия и ушивание почки и даже нефрэктомия. В связи с этим у больных с единственной почкой или тяжелой артериальной гипертонией лучше выполнять открытую биопсию почки.
ЛИТЕРАТУРА
Ahlawat R, Basarge N: Objective evaluation of the outcome of endo-pyelotomy using Whitaker's test and diuretic renography. BrJ Urol 1995; 76:686.
Aiken P et al.: Extracorporeal shock wave lithotripsy (ESWL): Alternatives and adjuvant procedures. World J Urol 1985; 3:48.
Aiken P, Gunther R, Thuroff J: Percutaneous nephrolithotomy: A routine procedure? BrJ Urol [Suppl] 1983; 51:1.
Asian P, Preminger GM: Retrograde balloon cautery incision of ureteropelvic junction obstruction. Urol Clin North Am 1998; 25:295.
Berkoff WB, Meijer F: Percutaneous antegrade fiberoptic uretero-renoscopic treatment of ureteral calculi. J Urol 1990; 144:628.
Bierkens AF et al.: Anterograde percutaneous treatment of urete-rointestinal strictures following urinary diversion. Eur Urol 1996; 30:363.
Bodner L et al.: The role of interventional radiology in the management of intra- and extra-peritoneal leakage in patients who have undergone continent urinary diversion. Cardiovasc Intervent Radiol 1997; 20:274.
Bolton WK, Vaughan ED: A comparative study of open surgical and percutaneous renal biopsies. J Urol 1977; 117:696.
Bush WH Jr, Burnett LL, Gibbons RP: Needle tract seeding of renal cell carcinoma. AJR 1977; 129:725.
Callaway TWet al.: Percutaneous nephrolithotomy in children. J Urol 1992; 148:1067.
Carr LK et al.: New stone formation: A comparison of extracorporeal shock wave lithotripsy and percutaneous nephrolithotomy. J Urol 1996; 155:1565.
Cato AR, Tulloch AGS: Hypermagnesemia in a uremic patient during renal pelvis irrigation with renacidin. J Urol 1974; 111:313.
Clayman RVetal.: Ureteronephroscopicendopyelotomy. J Urol 1990; 144:246.
Coptcoat MJ, Ison KT, Wickham JE: Endoscopic tissue liquidization and surgical aspiration. J Endourol 1988; 2:321.
Danuser H et al.: Endopyelotomy for primary ureteropelvic junction obstruction: Risk factors determine the success rate. J Urol 1998; 159:56.
Davidofif R, Bellman GC: Influence of technique of percutaneous tract creation on incidence of renal hemorrhage. J Urol 1997; 157:1229.
Davis DM: Intubated ureterotomy: A new operation for ureteral and ureteropelvic strictures. Surg Gynecol Obstet 1943; 76:513.
Denstedt J, Clayman R: Electrohydraulic lithotripsy of renal and ureteral calculi. J Urol 1990; 143:13.
Diaz-Buxo JA, Donadio JV Jr: Complications of percutaneous renal biopsy: An analysis of 1,000 consecutive biopsies. Clin Nephrol 1975; 4:223.
Dretler SP: Clinical experience with electromechanical impactor. J Urol 1993; 150:1402.
Dyer RB, Assimos DG, Regan JD: Update on interventional urora-diology. Urol Clin North Am 1997; 24:623.
El-Damanhoury H, Burger R, Hohenfellner R: Surgical aspects of urolithiasis in children. Pediatr Nephrol 1991; 5:339.
Elliott DS et al.: Long-term follow-up of endoscopically treated upper urinary tract transitional cell carcinoma. Urology 1996; 47:819.
Esuvaranathan К et al.: Stones in horseshoe kidneys: Results of treatment by extracorporeal shock wave lithotripsy and endourology. J Urol 1991; 146:1213.
Evans CP, Stoller ML: The fate of the iatrogenic retroperitoneal stone. J Urol 1993; 150:827.
Fernstrum I, Johansson B: Percutaneous pyelolithotomy: A new extraction technique. ScandJ Urol Nephrol 1976; 10:257.
Ferrucci JT et al.: Malignant seeding of the tract aftet thin-needle aspiration biopsy. Radiology 1979; 130:345.
Figenshau RS, Clayman RV: Endourologic options for management of ureteropelvic junction obstruction in the pediatric patient. Urol Clin North Am 1998; 25:199.
Gautier JR et al.: Pulsed dye laser in the treatment of 325 calculi of the urinary tract. Eur Urol 1990; 18:6.
Gibbons RP, Bush WH Jr, Burnett LL: Needle tract seeding following aspiration of renal cell carcinoma. J Urol 1977; 118:865.
Gill HS, Liao JC: Pelvi-ureteric junction obstruction treated with Acucise retrograde endopyelotomy. BrJ Urol 1998; 82:8.
Goldfischer ER et al.: Techniques of endopyelotomy. Br J Urol 1998; 82:1.
Goldfischer ER, Gerber GS: Endoscopic management of ureteral strictures. J Urol 1997; 157:770.
Goldfischer ER, Smith AD: Endopyelotomy revisited. Urology 1998; 51:855.
Goodwin WE, Casey WC, Woolf W: Percutaneous trocar (needle) nephrostomy in hydronephrosis. JAMA 1955; 157:891.
Gould DL: Holmium:YAG laser and its use in the treatment of urolithiasis: Our first 160 cases. J Endourol 1998; 12:23.
Grasso M et al.: Techniques in endoscopic lithotripsy using pulsed dye laser. Urology 1991; 37:138.
Глава 8. Антеградные вмешательства на мочевых путях
Grocela AJ, Dretler SP: Intracorporeal lithotripsy. Urol Clin North Am 1997; 24:13.
Gupta M etal.: Open surgical exploration after failed endopyelotomy: A 12-year perspective. J Urol 1997; 157:1613.
Herts BR, Baker ME: The current role of percutaneous biopsy in the evaluation of renal masses. Semin Urol Oncol 1995; 13:254.
Hoenig DM et al.: Impact of etiology of secondary ureteropelvic junction obstruction on outcome of endopyelotomy. J Endourol 1998; 12:131.
Hulbert JC et al.: Percutaneous intrarenal marsupialization of a perirenal cystic collection: Endocystolysis. J Urol 1988; 139:1039.
Hulbert J, Hunter D, Castaneda-Zuniga W: Classification of and techniques for the reconstitution of acquired strictures in the region of the ureteropelvic junction. J Urol 1989; 140:468.
Jabbour ME et al.: Endopyelotomy after failed pyeloplasty: The long-term results. J Urol 1998; 160:690.
Jarrett TWet al.: Percutaneous management of transitional cell carcinoma of the renal collecting system: 9-year experience. J Urol 1995; 154:1629.
Jones A et al.: Compliance studies, pressure flow measurements and renal function assessment in patients with upper urinary tract dilatation. J Urol 1987; 138:571.
Jones DJ et al.: The changing practice of percutaneous stone surgery. Review of 1000 cases 1981-1988. Br J Urol 1990; 66:1.
Jones DJ, Wickham JE, Kellet MJ: Percutaneous nephrolithotomy for calculi in horseshoe kidneys. J Urol 1991; 145:481.
Kamihira О et al.: Long-term stone recurrence rate after extracorporeal Shockwave lithotripsy. J Urol 1996; 156:1267.
Kashi SH, Irving HC, Sadek SA: Does the Whitaker test add to antegrade pyelography in the investigation of collecting system dilatation in renal allografts? Br J Radiol 1993; 66:877.
Kaye KW, Goldberg ME: Applied anatomy of the kidney and ureter. Urol Clin North Am 1982; 9:3.
Kovalik EC et al.: No change in complication rate using spring-loaded gun compared to traditional percutaneous renal allograft biopsy techniques. Clin Nephrol 1996; 45:383.
Kramolowski EV, Tucker RD, Nelson CMK: Management of benign ureteral strictures: Open surgical repair or endoscopic dilatation? J Urol 1989; 141:285.
Kurzrock EA et al.: Endoscopic management of pediatric urolithiasis. J PediatrSurg 1996; 31:1413.
Lau MWM et al.: Urinary tract obstruction and nephrostomy drainage in pelvic malignant disease. Br J Urol 1995; 76:565.
Lingemann J et al.: Comparison of results and morbidity of percutaneous nephrostolithotomy and extracorporeal Shockwave lithotripsy. J Urol 1987; 138:485.
Martinez-Pineiro JA et al.: Endourological treatment of upper tract urothelial carcinomas: Analysis of a series of 59 tumors. J Urol 1996; 156:377.
Marwah DS, Korbet SM: Timing of complications in percutaneous renal biopsy: What is the optimal period of observation? Am J Kidney Dis 1996; 28:47.
McDougall E et al.: Comparison of extracorporeal shock-wave lithotripsy and percutaneous nephrolithotomy for the treatment of renal calculi in lower pole calices. J Endourol 1989; 3:265.
Meretyk I, Meretyk S, Clayman RV: Endopyelotomy: Comparison of ureteroscopic retrograde and antegrade percutaneous techniques. J Urol 1992; 148:775.
Meretyk S et al.: Complete staghorn calculi: Random prospective comparison between extracorporeal shock wave lithotripsy monotherapy and combined with percutaneous nephrolithotomy. J Urol 1997; 157:780.
Minon Cifuentes J et al.: Percutaneous nephrolithotomy in transplanted kidney. Urology 1991; 38:232.
Morgentaler A, Bridge S, Dretler S: Management of the impacted ureteral calculus. J Urol 1990; 143:263.
Morse RM, Resnick MI: Ureteral calculi: Natural history and treatment in an era of advanced technology. J Urol 1991; 145:263.
MotolaJA, BadlaniGH, Smith AD: Results of 212 consecutive endo-pyelotomies: An 8-year follow-up. J Urol 1993; 149:453.
Motola JA, Smith AD: Therapeutic options for the management of j upper tract calculi. Urol Clin North Am 1990; 17:191.
Nadler RB et al.: Acucise endopyelotomy: Assessment of long-term I durability. J Urol 1996; 156:1094.
Nakada SY, Clayman RV: Percutaneous electrovaporization of upper | tract transitional cell carcinoma in patients with functionally solitary I kidneys. Urology 1995; 46:751.
Nakada SYet al.: Retrospective analysis of the effect of crossing vessels I on successful retrograde endopylelotomy outcomes using spiral compu- I terized tomography angiography. J Urol 1998; 159:62.
Narasimham DL et al.: Percutaneous nephrolithotomy through an I intercostal approach. Acta Radiol 1991; 32:162.
Netto NRetal.: Endourological management of ureteral strictures. I J Urol 1990; 144:631.
Netto NR et al.: Ureteroscopic stone removal in the distal ureter. Why I change? J Urol 1997; 157:2081.
Ozgok IY et al.: Intrarenal pressure following pyeloplasty or percu- I taneous surgery. Br J Urol 1991; 67:251.
Pagne S, Ramsay J: The effect of double-J-stents on renal pelvic I dynamics in the pig. J Urol 1988; 140:637.
Patel A et al.: Long-term outcome after percutaneous treatment of I transitional cell carcinoma of the renal pelvis. J Urol 1996; 155:868.
Pedersen JF: Percutaneous nephrostomy guided by ultrasound. J Urol I 1974; 112:157.
Puppo P et al.: Flexible antegrade and retrograde nephroscopy: Review of 50 cases. Eur Urol 1990; 17:193.
Rao PN et al.: Prediction of septicemia following endourological I manipulation for stones in the upper urinary tract. J Urol 1991; 146:955. 1
Razvi HA et al.: Intracorporeal lithotripsy with the holmium: YAG I laser. J Urol 1996; 156:912.
Saad F et al.: Staghorn calculi treated by percutaneous nephrolithotomy: Risk factors for recurrence. Urology 1993; 41:141.
Sadi MV, Nardozza A, Gianotti J: Percutaneous drainage of retroperitoneal abscesses. J Endourol 1988; 2:293.
Saxby MF et al.: A case-control study of percutaneous nephrolithotomy versus extracorporeal shock wave lithotripsy. Br J Urol 1997; 79:317.
Schmidt A, Baker R: Renal biopsy in children: Analysis of 61 cases of open wedge biopsy and comparison with percutaneous biopsy. J Urol 1976;116:79.
Segura JW: Antegrade endopyelotomy. Urol Clin North Am 1998; 25:311.
Segura JW: Role of percutaneous procedures in the management of renal calculi. Urol Clin North Am 1990; 17:207.
Segura JW et al.: Percutaneous removal of kidney stones: Review of 1000 cases. J Urol 1985; 134:1077.
Seldinger SI: Catheter: Catheter replacement of the needle in percutaneous arteriography. Acta Radiol 1953; 39:368.
Shalhav AL et al.: Adult endopyelotomy: Impact of etiology and antegrade versus retrograde approach on outcome. J Urol 1998; 160:685.
Shalhav AL et al.: Endopyelotomy for high-insertion ureteropelvic junction obstruction. J Endourol 1998; 12:127.
Shroff S: The holmium:YAG laser for ureteric stones. Br J Urol 1996; 78:836.
Singal RK, Denstedt JD: Contemporary management of ureteral stones. Urol Clin North Am 1997; 24:59.
Singal RKetal.: Holmium:YAG laser endoureterotomy for treatment of ureteral stricture. Urology 1997; 50:875.
Smith AD, Badlani GH: Special use of retrograde percutaneous nephrostomy in endourology. J Endourol 1987; 1:23.
Smith JJ III, Hollowell JG, Roth RA Multimodality treatment of complex renal calculi. J Urol 1990; 143:891.
Suby HI, Albright F: Dissolution of phosphatic urinary calculi by the retrograde introduction ofcitrate solution containing magnesium. N Engl J Med 1943; 228:81.
Teichmann JM et al.: Holmium:YAG percutaneous nephrolithotomy: The laser incident
Date: 2016-11-17; view: 562; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |