
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

По теме лабораторной работы
Лабораторная работа № 1
Тема: Получение метана и изучение его свойств.
Цель: изучить свойства метана; опытным путем исследовать их.
Реактивы и оборудование: прибор для получения газа, заправленный смесью ацетата натрия и натронной извести, металлический штатив, держалка, кристаллизатор, штатив с пробирками, раствор перманганата калия, раствор йодной воды, стакан, спиртовка, спички.
Краткие теоретические и учебно-методические материалы
по теме лабораторной работы
Предельными или насыщенными углеводородами называют ациклические углеводороды, в которых все валентности атомов углерода, не затраченные на образование углерод – углеродных (С - С) связей, насыщены атомами водорода. Ациклические соединения – вещества, имеющие прямую или разветвленную, но обязательно открытую (незамкнутую) цепь углеродных атомов. Первым членом класса предельных углеводородов является метан – СН4. Предельные углеводороды образуют гомологический ряд. Гомологическим рядом называют ряд органических соединений, сходных по своему химическому строению, имеющих общие методы получения, обладающих близкими химическими и закономерно изменяющимися физическими свойствами.
Общая формула предельных углеводородов CnH2n +2. Метан представляет собой газ (tкип. = -111оС, tпл. = -192оС), легче воздуха.
Молекулы предельных углеводородов содержат ковалентные связи. Вследствие малой химической активности предельные углеводороды получили название парафинов (от латинского выражения: лишенные сродства, с трудом вступающие в реакции). Парафины настолько малоактивны, что даже с очень активными химическими реагентами (О2, галогены) вступают во взаимодействие только после предварительного возбуждения реагирующих веществ – нагревания или под действием яркого (или ультрафиолетового) света.
В молекулах предельных углеводородов атомы углерода либо связаны между собой простыми связями (С – С связи) либо с атомами водорода
(С – Н связи). Поэтому при химических реакциях могут разрываться или
С – С или С – Н связи. Наиболее важными реакциями, характеризующими химические свойства предельных углеводородов, являются реакции замещения атомов водорода на
атомы галогенов. Образуются моно-, ди-, три- и полигалогензамещенные предельных углеводородов.

Гомологи метана могут расщепляться не только с разрывом С – Н связей и отщеплением водорода (дегидрогенизация), но и с разрывом С – С связей (крекинг). При этом образуется смесь предельных и непредельных соединений, например:
С4Н8 + Н2
С4Н10
С2Н6 + С2Н4.
В лаборатории для получения метана и его гомологов пользуются разложением солей органических кислот при прокаливании их со щелочами:
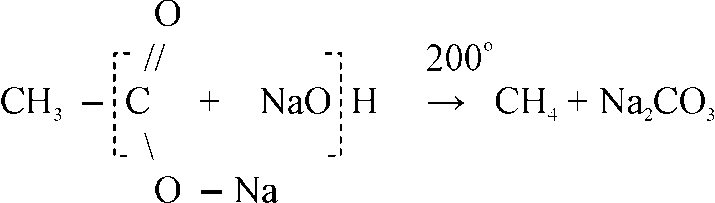
Другим лабораторным способом получения предельных углеводородов служит реакция Вюрца – нагревание моногалогенпроизводных предельных углеводородов с металлическим натрием:

образует
бромэтан или CH3 – CH2 – Br бутан или С4Н10.
В этой реакции происходит "удвоение" радикалов, входящих в состав галогенпроизводного, т.е. из С3Н7Cl можно получить С6Н14 и т.д.
ХОД РАБОТЫ
Опыт №1. Получение метана
Метан в лаборатории получают прокаливанием безводного ацетата натрия с натронной известью. Натронная известь представляет собой смесь гидроксида натрия с гидроксидом кальция. Возьмем натронную известь и ацетат натрия, тщательно перемешаем и поместим в пробирку. Закроем пробирку пробкой с газоотводной трубкой. Нагреем смесь. Через некоторое время начинает выделяться метан
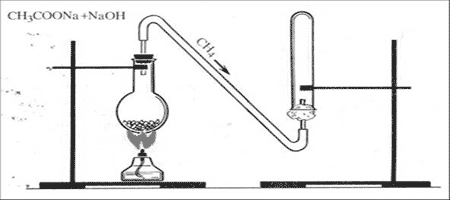 CH3COONa + NaOH = CH4 + Na2CO3
CH3COONa + NaOH = CH4 + Na2CO3
Поджигаем метан. Он горит почти бесцветным пламенем. При горении метана образуется углекислый газ и вода.
CH4 + 2О2 = СО2 + 2 Н2О
Опыт №2. Горение метана и изучение его физических свойств
Заполним метаном цилиндр. Метан представляет собой бесцветный газ, мало растворимый в воде. Он легче воздуха, поэтому легко улетучивается из открытого цилиндра. При поджигании метан загорается. При сгорании метана образуются углекислый газ и водяные пары.
CH4 + 2О2 = СО2 + 2 Н2О
Date: 2016-06-06; view: 11944; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |