
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Определение энтальпий фазовых превращений
Для эвтектических составов, выявленных в процессе исследования секущих треугольников LiF-KCl-LiKCrO4 и LiF-KCl-K2CrO4, измерили удельную энтальпию плавления. Для этого снимали не менее трех кривых охлаждения исследуемого эвтектического состава и эталонного вещества.
Расчет удельной энтальпии плавления состава проводили по формуле [17]:
 , кДж/кг, (3.1)
, кДж/кг, (3.1)
где  – удельная энтальпия фазового перехода эталонного вещества, с известной величиной фазового перехода и с близким значением температуры плавления к исследуемому составу, кДж/кг; SE, S эт – площади пиков дифференциальных кривых, отвечающие плавлению эвтектического состава и фазовому переходу эталонного вещества соответственно; ТE, Т эт – температуры плавления эвтектического состава и фазового перехода эталонного вещества, соответственно, К. Окончательное значение энтальпии усредняли по результатам нескольких измерений. Точность определения удельных энтальпий плавления составила ±5%.
– удельная энтальпия фазового перехода эталонного вещества, с известной величиной фазового перехода и с близким значением температуры плавления к исследуемому составу, кДж/кг; SE, S эт – площади пиков дифференциальных кривых, отвечающие плавлению эвтектического состава и фазовому переходу эталонного вещества соответственно; ТE, Т эт – температуры плавления эвтектического состава и фазового перехода эталонного вещества, соответственно, К. Окончательное значение энтальпии усредняли по результатам нескольких измерений. Точность определения удельных энтальпий плавления составила ±5%.
Исходные вещества
Использованные в работе реактивы имели следующие квалификации (табл. 3.1): "хч" (LiCl, K2CrO4), "чда" (LiF, KF, KCl),"ч" (Li2CrO4).
Соответствие температур плавления и фазовых переходов справочным данным [18, 19] определяли по температуре и числу термоэффектов на кривых ДТА охлаждения расплавов. Характеристики исходных веществ приведены в табл. 3.2. Использованные реактивы были предварительно обезвожены.
Таблица 3. 1
Квалификации используемых реактивов
| Исходный реактив | Квалификация | Содержание основного вещества по квалификации, % |
| LiF | чда | не менее 99.0 |
| LiCl | хч | более 99.0 |
| Li2CrO4 | ч | 98.0 и выше |
| KF | чда | не менее 99.0 |
| KCl | чда | не менее 99.0 |
| K2CrO4 | хч | более 99.0 |
Таблица 3. 2
Характеристики исходных компонентов
| Вещество | ∆fHº298, кДж/моль | ∆fGº298, кДж/моль | Плавление t, ºС | Полиморфный переход t, ºС |
| LiF | -615.0 | -586.1 | - | |
| LiCl | -408.4 | -384.1 | 610 | - |
| Li2CrO4 | -1390.6 | -1277.2 | - | |
| KF | -566.1 | -536.4 | - | |
| KCl | -436.8 | -408.8 | - | |
| K2CrO4 | -1406.6 | -1298.5 | β/α – 666 |
3.4. Секущий треугольник LiF-KCl-K2CrO4 [ ]
Треугольник составов исследованной трехкомпонентной системы LiF-KCl-K2CrO4 представлен на рис. 3.5. Треугольник образован двумя стабильными диагоналями LiF-KCl и LiF-K2CrO4 трехкомпонентных взаимных систем Li,K||F,Cl и Li,K||F,CrO4, соответственно, и двухкомпонентной системой KCl-K2CrO4. Элементами огранения квазитройной системы LiF-KCl-K2CrO4 являются системы эвтектического типа, поэтому в исследуемой системе прогнозируется образование трехкомпонентной эвтектики. Исследован экспериментально политермический разрез BF (B[50% LiF + 50% K2CrO4], F[50% LiF + 50% KCl]), выбранный в поле кристаллизации фторида лития. Т-х диаграмма разреза приведена на рис. 3.6. Первоначально из расплава кристаллизуется фторид лития, т.к. разрез выбран в поле кристаллизации данного компонента. Этому процессу соответствует кривая ликвидуса.

Рис. 3.5. Проекция фазового комплекса трехкомпонентной системы LiF-KCl-K2CrO4 на треугольник составов
Линии вторичной кристаллизации LiF+ b -K2CrO4, LiF+ a -K2CrO4 и LiF-KCl пересекаются с эвтектической прямой в точке 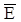 13 при температуре 614ºС, которая является центральной проекцией на тройную эвтектику Е13 из полюса кристаллизации фторида лития. Исследованием разреза LiF-
13 при температуре 614ºС, которая является центральной проекцией на тройную эвтектику Е13 из полюса кристаллизации фторида лития. Исследованием разреза LiF-  13-E13(рис. 3.7) определены характеристики сплава, отвечающего составу тройной эвтектикиЕ13: 12% LiF 44% KCl, 44% K2CrO4, температура плавления 614ºС. В табл. 3.4 приведены фазовые равновесия элементов системы LiF-KCl-K2CrO4.
13-E13(рис. 3.7) определены характеристики сплава, отвечающего составу тройной эвтектикиЕ13: 12% LiF 44% KCl, 44% K2CrO4, температура плавления 614ºС. В табл. 3.4 приведены фазовые равновесия элементов системы LiF-KCl-K2CrO4.
Удельная энтальпия плавления эвтектического состава, определенная методом сравнения с удельной энтальпией плавления эталонного вещества хлорида лития (плавление при 610ºС, энтальпия плавления 465.9 КДж/кг) по формуле (3.1) и по результатам трех опытов составила 302 кДж/кг.

Рис. 3. 6. Т-х диаграмма разреза BF системы LiF-KCl-K2CrO4

Рис. 3. 7. Т-х диаграмма разреза LiF- 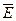 13-E13 системы LiF-KCl-K2CrO4
13-E13 системы LiF-KCl-K2CrO4
Date: 2016-06-06; view: 623; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |