
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

H0298 некоторых веществ
Стандартные теплоты (энтальпии) образования
Таблица 4
| Вещество | Состояние | Н0298, кДж/моль | Вещество | Состояние | Н0298, кДж/моль | |
| CS2 | г | +115,28 | CH3OH | г | -201,17 | |
| NO | г | +90,37 | C2H5OH | г | -235,31 | |
| C6H6 | г | +82,93 | H2O | г | -241,83 | |
| C2H4 | г | +52,28 | H2O | ж | -285,84 | |
| H2S | г | -20,15 | NH4C l | к | -315,39 | |
| NH3 | г | -46,19 | CO2 | г | -393,51 | |
| CH4 | г | -74,85 | Fe2O3 | к | -822,10 | |
| C2H6 | г | -84,67 | Ca(OH)2 | к | -986,50 | |
| HC l | г | -92,31 | A l2 O3 | к | -1669,80 | |
| CO | г | -110,52 |
Решение: Теплотой образования (энтальпией) данного соединения называют тепловой эффект реакции образования одного моля этого соединения из простых веществ, взятых в их устойчивом состоянии при данных условиях. Обычно теплоты образования относят к стандартному состоянию, т.е.
к 25°С (298 K), и I атм и обозначают через H0298. Так как тепловой эффект с температурой изменяется незначительно, то здесь и в дальнейшем индексы опускаются и тепловой эффект обозначается через Н. Следовательно, нужно вычислить тепловой эффект реакции, термохимическое уравнение которой имеет вид


Исходя из следующих данных:
а) 

б) С(граф.) + 02(г) = CO2(Г); Н = - 393,51 кДж;
в) Н 2(Г) + 1/2 О2(Г) =Н2О(Ж); Н = - 285,84 кДж.
Ha основании закона Гесса с термохимическими уравнениями можно оперировать так же, как и с алгебраическими. Для получения искомого результата следует уравнение (б) умножить на 2, уравнение (в) - на 3, а затем сумму этих уравнений вычесть из уравнения (а):
C2H6 + 31/2 O2 – 2C – 2O2 – 3H2 – 3/2 O2 = 2CO + 3H2O – 2CO2 – 3H2O;
 H = –1559,87 + 787,02 + 857,52;
H = –1559,87 + 787,02 + 857,52;
C2H6 = 2C + 3H2;  H = + 84,67 кДж
H = + 84,67 кДж
Так как теплота образования равна теплоте разложения с обратным знаком, то
обр.

K тому же результату придем, если для решения задачи применить вывод из закона Гесса:

Учитывая, что теплоты образования простых веществ условно приняты равными нулю

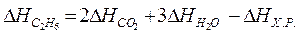 ;
;


обр.
 .
.
Пример 3. Реакция горения этилового спирта выражается термохимическим
уравнением:

Вычислить тепловой эффект реакции, если известно, что мольная теплота парообразования  равна + 42,36 кДж и известны теплоты образования:
равна + 42,36 кДж и известны теплоты образования:
 (табл.4).
(табл.4).
Решение: Для определения H реакции необходимо знать теплоту образования.  . Последнюю находим из данных задачи:
. Последнюю находим из данных задачи:



Вычисляем  Н реакции, применяя следствие из закона Гесса:
Н реакции, применяя следствие из закона Гесса:

= - 1366,87 кДж.
КОНТРОЛЬНЫЕ ВОПРОСЫ
81. Вычислите тепловой эффект реакции восстановления одного моля Fе2,03, металлическим алюминием. Ответ: - 847,7 кДж.
82. Газообразный этиловый спирт C2H5OH можно получить при взаимодействии этилена C2H4(Г) и водяных паров. Напишите термохимическое уравнение этой реакции, вычислив ее тепловой эффект.
Ответ: - 45,76 кДж,
83. Вычислите тепловой эффект реакции восстановления оксида железа (+2) водородом исходя из следующих термохимических уравнений:



Ответ: + 27,99кДж. 84.
84.При взаимодействии газообразных сероводорода и диоксида углерода образуются пары воды и сероуглерод CS 2(Г). Напишите термохимическое уравнение этой реакции, вычислив ее тепловой эффект.
Ответ: + 65,43 кДж.
85. Напишите термохимическое уравнение этой реакции между СО(Г) и водородом, в результате которой образуются CH4(Г) и H2O(Г). Сколько теплоты выделится при этой реакции?
Ответ: 206,16 кДж.
86. Тепловой эффект какой реакции равен теплоте образования NO? Вычислите теплоту образования NO, исходя из следующих термохимических уравнений:


Ответ: 90,37 кДж.
87. Кристаллический хлорид аммония образуется при взаимодействии газообразных аммиака и хлорида водорода. Напишите термохимическое уравнение этой реакции, вычислив ее тепловой эффект. Сколько теплоты выделится, если в реакции было израсходовано 10 л аммиака в пересчете на нормальные условия? Ответ: 78,97 кДж.
88. Вычислите теплоту образования метана исходя из следующих термохимических уравнений:



Ответ: - 74,88 кДж.
89. Вычислите теплоту образования гидроксида кальция исходя из следующих термохимических уравнений:
Са(к) + 1/2 О2(г) = СаО(к); 


Ответ: - 986,50 кДж.
90.Тепловой эффект реакции сгорания жидкого бензола с образованием паров воды и диоксида углерода равен - 3135,58 кДж. Составьте термохимическое уравнение этой реакции и вычислите теплоту образования С6Н6(Ж).
Ответ: + 49,03 кДж.
91. Вычислите, сколько теплоты выделится при сгорании 165 л (н.у.)
ацетилена C2H2, если продуктами сгорания являются диоксид угле-
рода и пары воды?
Ответ: 924,88 кДж.
92. При сгорании газообразного аммиака образуются пары воды и оксид
азота. Сколько теплоты выделится при этой реакции, если было
получено 44,8 л NO в пересчете на нормальные условия?
Ответ: 452,37 кДж.
93.Реакция горения метилового спирта выражается термохимическим
уравнением 
Вычислите тепловой эффект этой реакции, если известно, что мольная теплота парообразования СНзОН(ж) равна + 37,4 кДж.
Ответ: - 726,62 кДж.
94. При сгорании II,5 г жидкого этилового спирта выделилось 308,71
кДж теплоты. Напишите термохимическое уравнение реакции, в ре-
зультате которой образуются пары воды и диоксид углерода. Вы
числите теплоту образования C2,H5OH(Ж).
Ответ: - 277,67 кДж/моль.
95. Реакция горения бензола выражается термохимическим уравнением:

Вычислите тепловой эффект этой реакции, если известно, что мольная теплота парообразования бензола равна + 33,9 кДж.
Ответ: - 3135,58 кДж.
96. Вычислите тепловой эффект и напишите термохимическое уравнение
реакции горения одного моля этана C2H6(г), в результате которой
образуются пары воды и диоксид углерода. Сколько теплоты выделится при сгорании I м3 этана в пересчете на нормальные условия?
Ответ: 63742,86 кДж.
97. Реакция горения аммиака выражается термохимическим уравнением:

Вычислите теплоту образования NН3(Г).
Ответ: - 46,19 кДж.
98. При взаимодействии 6,3 г железа с серой выделилось II,3I кДж теп-
лоты. Вычислите теплоту образования сульфида железа FeS.
Ответ: - 100,26 кДж/моль.
99. Теплоты растворения сульфата меди CuSO4 и медного купороса CuSO4 . 5H2O соответственно равны - 66,11 кДж и + 11,72 кДж. Вычислите теплоту гидратации СuSО4.
Ответ: - 77,83 кДж.
100. При получении эквивалентной массы гидроксида кальция из СаО(к) и 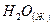 выделяется 32,53 кДж теплоты. Напишите термохимическое уравнение этой реакции и вычислите теплоту образования оксида кальция.
выделяется 32,53 кДж теплоты. Напишите термохимическое уравнение этой реакции и вычислите теплоту образования оксида кальция.
Ответ: - 635,6 кДж.
ХИМИЧЕСКОЕ СРОДСТВО
Самопроизвольно могут протекать реакции, сопровождающиеся не только выделением, но и поглощением теплоты.
Реакция, идущая при данной температуре с выделением теплоты, при другой температуре идет в обратном направлении, т.е. с поглощением теплоты. Здесь проявляется диалектический закон единства и борьбы противоположностей. C одной стороны система стремится к упорядочению (агрегации), уменьшению H, с другой стороны, система стремится к беспорядку (дезагрегации). Первая тенденция растет с понижением температуры, а вторая - растет с повышением температуры. Тенденцию к беспорядку характеризует величина, которую называют энтропией.
Энтропия (S),так же, как внутренняя энергия(U),энтальпия(Н),объем (V) и др., является свойством вещества, пропорциональным его количеству S,U,H,V обладает аддитивными свойствами, т.е. при соприкосновении систем суммируются. Энтропия отражает движение частиц вещества и является мерой неупорядоченности системы. Сна возрастает с увеличением движения частиц: при нагревании, испарении, плавлении, расширении газа, при ослаблении или разрыве связей между атомами и т.п. процессы, связанные с упорядоченностью системы: конденсация, кристаллизация, сжатие, упрочнение связей, полимеризация и т.п. - ведут к уменьшению энтропии.
Энтропия является функцией состояния, т.е. ее изменение ( ) зависит только от начального (S1) и конечного (S2) состояния и зависит от пути процесса:
) зависит только от начального (S1) и конечного (S2) состояния и зависит от пути процесса:
Если S2>S1, то  .
.
Если S2>S1, то  .
.
Так как энтропия растет с повышением температуры, то можно считать, что мера беспорядка  . Энтропия выражается в Дж/моль. град. Таким образом, движущая сила процесса складывается из двух сил: стремление к упорядочению (H) и стремление к беспорядку (TS).
. Энтропия выражается в Дж/моль. град. Таким образом, движущая сила процесса складывается из двух сил: стремление к упорядочению (H) и стремление к беспорядку (TS).
При P = const и T = const общую движущую силу процесса, которую
обозначают  , можно найти из соотношения:
, можно найти из соотношения:


Величина  называется изобарно-изотермическим потенциалом или энергией Гиббса. Итак, мерой химического сродства является убыль потенциала или
называется изобарно-изотермическим потенциалом или энергией Гиббса. Итак, мерой химического сродства является убыль потенциала или  которая зависит от природы вещества, его количества и от температуры. Энергия Гиббса является функцией состояния, поэтому
которая зависит от природы вещества, его количества и от температуры. Энергия Гиббса является функцией состояния, поэтому
 .
.
Самопроизвольно протекающие процессы идут в сторону уменьшения
любого потенциала и, в частности, в сторону уменьшения  . Если
. Если
 <0, процесс принципиально осуществим, если
<0, процесс принципиально осуществим, если  >O - процесс са-
>O - процесс са-
мопроизвольно проходить не может. Чем меньше  , тем сильнее стрем-
, тем сильнее стрем-
ление к протеканию данного процесса и тем дальше он от состояния
равновесия, при котором  = 0 и
= 0 и  =
=  . Из соотношения
. Из соотношения  =
=
=  -
-  видно, что самопроизвольно могут протекать и процессы,
видно, что самопроизвольно могут протекать и процессы,
для которых  > O (эндотермические). Это возможно, когда
> O (эндотермические). Это возможно, когда  >0,
>0,
но  , и тогда
, и тогда  < O. C другой стороны, экзотермические реакции (
< O. C другой стороны, экзотермические реакции ( < O) самопроизвольно не протекают, если при
< O) самопроизвольно не протекают, если при  <0 окажется, что
<0 окажется, что  > O.
> O.
B таблице 5 приведены стандартные энергии Гиббса образования ( ) некоторых веществ и стандартные абсолютные энтропии
) некоторых веществ и стандартные абсолютные энтропии  некоторых веществ.
некоторых веществ.
Стандартные энергии Г'иббса образования 
некоторых веществ и стандартные энтропии  этих соединений
этих соединений
Таблица 5
| Вещество |  ,
кДж/моль ,
кДж/моль
|  , кДж/моль·К , кДж/моль·К
|
| BaCO3(K) | -1138,80 | 172,0 |
| CaCO3(K) | -1128,75 | 92,0 |
| Fe3O4(K) | -1014,20 | 146,4 |
| BeCO3(K) | -944,75 | |
| CaO(K) | -604,20 | 39,7 |
| BeO(K) | -581,61 | 14,0 |
| BaO(K) | -528,40 | 70,0 |
| CO2(Г) | -394,38 | 213,7 |
| NaCl(K) | -384,03 | 72,0 |
| ZnO(K) | -318,20 | 43,6 |
| FeO | -244,30 | 54,0 |
| H2O(Ж) | -237,19 | 69,94 |
| H2O(Г) | -228,59 | 188,72 |
| PbO2(K) | -219,00 | 74,9 |
| CO(Г) | -137,27 | 197,5 |
| CH4(Г) | -50,79 | 186,68 |
| NO(Г) | +51,84 | 240,46 |
| NO(Г) | +86,69 | 210,20 |
| С2H2(Г) | +209,20 | 200,8 |
| С (АЛМАЗ) | +2,76 | 2,28 |
| С (ГРАФИТ) | 5,7 | |
| Fe(К) | 27,0 | |
| S(РОМБ) | 30,5 | |
| Ti(КР) | 28,96 | |
| TiO2(K) | -888,6 | 50,3 |
| Fe2O3(K) | -740,3 | 89,96 |
| NH4Cl(K) | -195,8 | 94,5 |
| CH3OH(Ж) | -158,8 | 126,8 |
| H2(Г) | 130,59 | |
| HCl(Г) | -95,2 | 186,63 |
| N2(Г) | 191,49 | |
| NH3(Г) | -16,7 | 197,91 |
| О2(Г) | 205,03 | |
| H2S(Г) | -33,8 | 205,64 |
| СО2(Г) | -394,4 | 213,65 |
| С2H4(Г) | 68,1 | 219,45 |
| Сl2 | 222,95 | |
| PCl3(Г) | -273,6 | 311,66 |
| PCl5(Г) | -310,4 | 352,71 |
Пример I. B каком состоянии энтропия I даль вещества больше: в кристаллическом или парообразном при той же температуре?
Решение: Энтропия есть мepa неупорядоченности состояния вещества. B кристалле частицы (атомы, ионы) расположены упорядоченно и могут находиться лишь в определенных точках пространства, а для газов таких ограничений нет. Объем I моль газа гораздо больше, чем I моль кристаллического вещества; возможность хаотического движения молекул больше. A так как энтропию можно рассматривать как количественную меру хаотичности атомно-молекулярной структуры вещества, то энтропия 1моля паров вещества, больше энтропии I моль его кристаллов при одинаковой температуре.
Пример 2. Прямая или обратная реакция будет протекать при стандартных условиях в системе

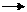
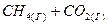

Решение:Для ответа на вопрос следует вычислить 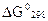 прямой реакции. Значения
прямой реакции. Значения 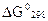 соответствующих веществ приведены в табл.5. Зная, что
соответствующих веществ приведены в табл.5. Зная, что  есть функция состояния и что
есть функция состояния и что  для простых веществ, находящихся в устойчивых при стандартных условиях агрегатных состояниях, равны нулю, находим
для простых веществ, находящихся в устойчивых при стандартных условиях агрегатных состояниях, равны нулю, находим 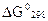 процесса:
процесса:
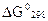 =2 (-137,27) + 2 (0) - (-50,79 - 394,38) = + 170,63 КдЖ
=2 (-137,27) + 2 (0) - (-50,79 - 394,38) = + 170,63 КдЖ
To, что 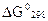 >0 указывает на невозможность самопроизвольного протекания прямой реакции при Т = 298 K и равенстве давлений взятых газов I,OI3 • 105 Па (760 мм рт. ст. = I атм.).
>0 указывает на невозможность самопроизвольного протекания прямой реакции при Т = 298 K и равенстве давлений взятых газов I,OI3 • 105 Па (760 мм рт. ст. = I атм.).
Пример 3.Ha основании стандартных теплот образований (табл.5) вычислите 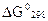 peaкции протекающей по уравнению
peaкции протекающей по уравнению


Решение:  - функции состояния, поэтому
- функции состояния, поэтому


Так как  , то реакция возможна, но скорость данной peaкции зависит от условий ее протекания.
, то реакция возможна, но скорость данной peaкции зависит от условий ее протекания.
КОНТРОЛЬНЫЕ ВОПРОСЫ
101. Вычислите 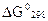 для следующих реакций:
для следующих реакций:
а) 2 
б) 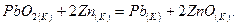

Можно ли получить фтор по реакции (а) и восстановить  цинком по реакции (б)?
цинком по реакции (б)?
Ответ: + 313,94 кДж; - 417,4 кДж.
102. При какой температуре наступит равновесие системы:




Хлор или кислород в этой системе является более сильным окислителем и при каких температурах? Ответ: 891 K.
103. Восстановление Fe3О4 оксидом углерода идет по уравнению

Вычислите 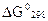 и сделайте вывод о возможности самопроизвольного протекания этой реакции при стандартных условиях. Чему равно
и сделайте вывод о возможности самопроизвольного протекания этой реакции при стандартных условиях. Чему равно 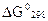 в этом процессе?
в этом процессе?
Ответ: + 24,19 кДж; + 31,34 Дж/моль • K.
104. Реакция горения ацетилена идет по уравнению

Вычислите 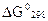 и
и  . Объясните уменьшение энтропии в результате этой реакции.
. Объясните уменьшение энтропии в результате этой реакции.
Ответ: - 1235,15 кДж; - 216,15 Дж/(моль · K).
105. Уменьшается или увеличивается энтропия при переходах: а) воды в пар;
б) графита в алмаз? Почему? Вычислите  для каждого превращения. Сделайте вывод о количественном изменении энтропии при фазовых и аллотропических превращениях.
для каждого превращения. Сделайте вывод о количественном изменении энтропии при фазовых и аллотропических превращениях.
Ответ: а) 118,98 Дж/моль·К); б) -3,25Дж/(моль·К).
106.Чем можно объяснить, что при стандартных условиях невозможна экзотермическая реакция:

Зная тепловой эффект реакции и абсолютные энтропии (табл.5) соответствующих веществ, определите 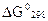 этой реакции.
этой реакции.
Ответ: + 19,91 кДж.
107. Прямая или обратная реакция будет протекать при стандартных условиях в системе
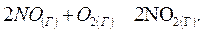
Ответ мотивируйте, вычислив 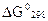 прямой реакции.
прямой реакции.
Ответ: -69,70 кДж.
108. Исходя из значений стандартных теплот образования и абсолютных энтропий (табл.5) соответствующих веществ, вычислите 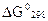 реакции, протекающей по уравнению
реакции, протекающей по уравнению

Может ли эта реакция при стандартных условиях идти самопроизвольно?
Ответ: - 92,08 кДж.
109. При какой температуре наступит равновесие системы

Ответ:  385,5 К.
385,5 К.
110. При какой температуре наступит равновесие системы

Ответ:  961,9 K.
961,9 K.
111. На основании стандартных теплот образования и абсолютных стандартных энтропий соответствующих веществ вычислите 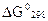 реакции, протекающей по уравнению
реакции, протекающей по уравнению

Возможна ли эта реакция при стандартных условиях?
Ответ: - I30,89 кДж:.
112. На основании стандартных теплот образования и абсолютных стандартных энтропий соответствующих веществ вычислите 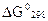 реакции, протекающей по уравнению
реакции, протекающей по уравнению
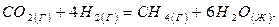
Возможна ли эта реакция при стандартных условиях?
Ответ: - I30,89 кДж.
113. Вычислите  реакции, протекающей по уравнению
реакции, протекающей по уравнению

Возможна ли реакция восстановления Fe2O5 водородом при температурах 500 и 2000 K?
Ответ: + 96,61 кДж;138,83 Дж/К; - 181,05 кДж.
114. Какие из карбонатов: BeCO3, CaCO3, BaCO3 - можно получить по peакции взаимодействия соответствующих оксидов с CO2? Какая реакция идет наиболее энергично? Вывод сделайте, вычислив 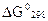 реакций.
реакций.
Ответ: + 31,24 кДж; -130,I7 кДж; -216,02гДж.
115. На основании стандартных теплот образования и абсолютных стан-
дартных энтропий соответствующих веществ вычислите 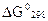 реакции, протекающей по уравнению
реакции, протекающей по уравнению

Возможна ли эта реакция при стандартных условиях?
Ответ: - 142,16 кДж.
116.Образование сероводорода из npocтых веществ протекает по
уравнению

Исходя из значений  соответствующих веществ, определите
соответствующих веществ, определите  и
и 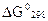 для этой реакции.
для этой реакции.
Ответ: + 43,15 Дж/моль·град; - 33,01 кДж.
117.Ha основании стандартных теплот образования и абсолютных
стандартных энтропий соответствующих веществ вычислите 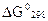
реакции, протекающей по уравнению:
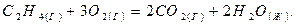
Возможна ли эта реакция при стандартных условиях?
Ответ: - I33I,2I кДж.
118.Определите, при какой температуре начнется реакция восстанов-
ления Fe3O4, протекающая по уравнению

Ответ: 1102,4 K.
119.Вычислите, при какой температуре начнется диссоциация пента-
хлорида фосфора, протекающая по уравнению

Ответ: 509 K.
120. Вычислите изменение энтропии для реакций, протекающих по
уравнениям:

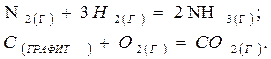
Почему в этих реакциях  > O; < O;
> O; < O;  O?
O?
Ответ: 220,21 Дж/К; - 198,26 Дж/К; 2,93.Дж/К.
СОДЕРЖАНИЕ
- Введение……………………………………………………………………………3
- Программа………………………………………………………………………....4
- Контрольные задания……………………………………………………………..7
- Основные законы и понятия в химии…………………………………………14
- Контрольное задание 1:Моль. Эквиваленты и эквивалентные массы простых и сложных веществ. Закон эквивалентов……………………………………..16
- Контрольные вопросы…………………………………………………………..18
- Строение атома…………………………………………………………………..20
- Контрольные вопросы…………………………………………………………...23
- Периодическая система элементов Д.И. Менделеева………………………..26
- Контрольные вопросы……………………………………………………………28
- Химическая связь и строение молекул. Конденсированное состояние вещества……………………………………………………………………………30
- Контрольные вопросы…………………………………………………………….34
- Энергетика химических процессов……………………………………………..36
- Контрольные вопросы…………………………………………………………….41
- Химическое сродство……………………………………………………………..44
- Контрольные вопросы…………………………………………………………….47
| <== предыдущая | | | следующая ==> |
| | | Теоретико-методологические положения статистического анализа производства и реализации продукции растениеводства |
Date: 2016-05-23; view: 710; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |