
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Термодинамикадағы жұмыс
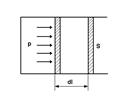
11.2-сурет 11.3-сурет


 (11.10)
(11.10)
Жұмыстың геометриялық мағынасы: газдың  көлемнен
көлемнен  (11.2-сурет) көлемге дейін ұлғаю кезінде атқаратын жұмысы
(11.2-сурет) көлемге дейін ұлғаю кезінде атқаратын жұмысы  өсі,
өсі,  қисығы (11.3-сурет) және
қисығы (11.3-сурет) және  ,
,  көлемдерге сәйкес келетін түзулермен шектелген аудан арқылы анықталады
көлемдерге сәйкес келетін түзулермен шектелген аудан арқылы анықталады
8. Термодинамиканың бірінші бастамасы және оны процесстерге қолдану.жылу сиымдылығы.
1) Изотермиялық процесс. 
Изотермиялық процесс кезінде жүйенің ішкі энергиясының өзгерісі нольге тең және жүйеге берілген жылу мөлшері жүйенің сыртқы денелермен жұмыс атқаруына жұмсалады.

Изотермиялық процесс кезіндегі атқарылатын жұмысты анықтайық.
 .
.
Менделеев-Клапейрон теңдеуінен газ қысымын өрнектейік: 

2) Изохоралық процесс. 
Изохоралық процесс кезінде газ жұмыс нольге тең және жүйеге берілген жылу мөлшері жүйенің ішкі энергиясын өзгертуге жұмсалады. 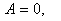

Ішкі энергия өзгерісі  ,
,
мұндағы:  - тұрақты көлемдегі мольдік жылу сыйымдылығы.
- тұрақты көлемдегі мольдік жылу сыйымдылығы.
3) Изобаралық процесс. 
Изобаралық процесс кезінде термодинамиканың жүйеге берілген жылу мөлшері жүйенің ішкі энергиясын өзгертуге және жүйенің сыртқы денелермен жұмыс атқаруына жұмсалады:
 немесе
немесе 
Жүйеге берілген жылу мөлшері:  ,
,
мұндағы:  - тұрақты қысымдағы мольдік жылу сыйымдылығы.
- тұрақты қысымдағы мольдік жылу сыйымдылығы.
Ішкі энергия мен термодинамикалық жұмыс келесі формулалармен өрнектелетінін ескерсек:
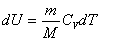 және
және 
термодинамиканың 1-заңы мына түрде жазылады:
 ,
, 
 екенін ескерсек
екенін ескерсек

 -ға теңдіктің екі жағын бөлсек
-ға теңдіктің екі жағын бөлсек
Майер формуласын аламыз:  .
.
Газдың тұрақты қысымдағы және тұрақты көлемдегі мольдік жылу сыйымдылықтарының айырмасы универсал газ тұрақтысына тең.
C p тұрақты қысымдағы мольдік жылу сыйымдылығы әрқашан C V тұрақты көлемдегі мольдік жылу сыйымдылығынан үлкен болады (сурет).

|
| Сурет Δ T = T 2 – T 1 температураға газдықыздырудың екі мүмкін процесі. p = const жағдайында газ A = p 1(V 2 – V 1) жұмысын атқарады. Сол себепті C p > C V. |
4) Адиабаталық процесс.
Сыртқы ортамен жылу алмаспай жүретін процесс адиабаталық процесс деп аталады.

Адиабаталық процесті сипаттайтын теңдеу Пуассон теңдеуі деп аталады.
 ,
,
мұндағы:  - Пуассон коэфиценті немесе адиабата көрсеткіші.
- Пуассон коэфиценті немесе адиабата көрсеткіші.
Адиабаталық процесті сипаттайтын графикті адиабата деп атайды.

Адиабаталық процесс кезінде атқарылатын жұмыс
 .
.
5) Политроптық процестер
Политроптық процестер деп жүруі кезінде жылу сыйымдылығы тұрақты болып қалатын процестерді айтады.

Политроп теңдеуі- 
мұндағы:  - политроп көрсеткіші.
- политроп көрсеткіші.
Жылу сыйымдылығы мен политроп көрсеткішінің арасындағы байланыс:
 .
.
9. Қайтымды және қайтымсыз процесстер. Жылу машиналары. Карно циклы
Қайтымды процесс кері бағытта өткізуге болатын процесті тура бағытта өткізгенде жүйе қандай күйлерден өтсе, кері бағытта сондай тізбегінен өтетін процесті айтады. Қайтымды процеске тек тепе тең процестер жатады. Қайтымды процесте жүйені қоршаған денелерде ешқандай өзгеріс болмайды.
Қайтымсыз процестер өздігінен бір бағытта өтетін процес. Нақты процестер қайтымсыз процестер болады. Олар мейлінше баяу өте отырып, қайтымды процестерге тек жуықтай алады. Қайтымды процеске мысал ретінде вакумдегі абсолют серпімді серіппеге ілінген дененің өлшейтің тербелісің алуға болады. Кедергісі бар ортада өтетін процестердің барлығы қайтымды процестер. Қайтымсыз процестерге температуралары әр түрлі денелердің бір біріне жылу алмасу салдарынан температуралары тенелу процесі жатады, себебі жылу ыссы денеден салқынға беріледі, керісінше болу мүмкін емес. Термодинамиканың ІІ бастамасы термодинамикалық процестердің қайтымсыздығын тұжырымдайды.
Отынның ішкі энергиясын механикалық энергияға айналдыратын машиналарды жылу машиналары деп атайды. Механикалық энергияны әрі қарай электр және басқа кез келген энергия түрлеріне айналдыруға болады. Қазіргі жылу машиналардың көбінде механикалық жұмысты қыздырылған газ ұлғайғанда жасайды. Осы газ жұмыс денесі деп аталады. Автомобиль қозғалтқышында жұмыс денесі- ауа, жылу бу турбиналық станцияларда - судың буы.
Жұмыс денесі қыздырғыштан Q жылу мөлшерін алып көлемін ұлғайтқанда, механикаық жұмыс жасайды. Мысалы, Автомобиль қозғалтықышының цилиндріндегі ауаның қызуы осы цилиндрдің ішінде бензин жағу арқылы өтеді. Жылуды механикалық жұмысқа айналдыру үшін оны ұлғая алатын денеге беру керек. Сонда жұмыс мынаған тең болады:

Ең үлкен жұмыс изотермиялық процесте алынады, себебі ішкі энергия өзгермейді:

Бірақ техникада жылудың механикалық жұмысқа түрленуінің осы сияқты бірлік процесі қызығушылық тудырмайды. Жылуды жұмысқа түрлендіретін нақты құрылғылар (бу машинасы, іштен жану двигательдер және т.с.с.) циклды түрде жұмыс істейді, яғни оларда болатын процестер периодты қайталанып отырады. Басқаша айтқанда, жүйе дөңгелек процесс жасауға тиісті. (13.1-сурет). Цикл ішіндегі атқарылатын жұмыс тұйық қисықпен шектелген ауданға тең.
Кельвин принципі: кейбір денеден тартып алынған жылуды механикалық жұмысқа түрлендіретін және сол кезде басқа денелерде ешқандай өзгерістерді тудырмайтын циклдық процесті жүргізу мүмкін емес.
Сөйтіп, жылу двигателі жұмыс істеу үшін суытқыш қажет (үшінші дене). Энергияның сақталу заңына сәйкес двигательдің атқаратын жұмысы мынаған тең:



13.1-сурет 13.2-сурет
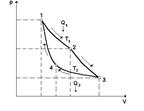
Двигательдің атқаратын  жұмысының, қыздырғыштан алатын
жұмысының, қыздырғыштан алатын 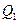 (13.2-сурет) жылу мөлшеріне қатынасын жылу двигателінің пайдалы әсер коэффициенті (ПӘК) деп атайды:
(13.2-сурет) жылу мөлшеріне қатынасын жылу двигателінің пайдалы әсер коэффициенті (ПӘК) деп атайды:
 (13.10)
(13.10)
Двигательдің атқаратын жұмысы мейлінше жоғары болу үшін Карно циклын (13.3-сурет) пайдалану керек.
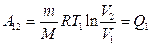 ,
,
13.3-сурет
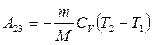 ,
,  ,
, 
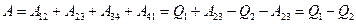 .
.
Адиабаттық процестер үшін мынаны жазуға болады:
 ,
,  ,
,
немесе
 .
.
Сонда ПӘК былайша табылады:
 (13.11)
(13.11)
Карно теоремалары:
1. Суытқыш пен қыздырғыштың берілген температурасында жұмыс істейтін жылулық машинаның ПӘК-і суытқышпен қыздырғыштың сол температурасындағы қайтымды Карно циклы бойынша жұмыс істейтін машинаның ПӘК-нен жоғары бола алмайды.
Карно циклының ПӘК-і жұмыстық дененің тегіне тәуелсіз.
10. Термодинамиканың екінші бастамасы. Энтропия. Энтропия қасиеттері. Статистикалық соқтығысу. Термодинамиканың үшінші бастамасы
dQ жылу көлемі, бір күйден екінші күйге өткендегі берілген немесе алынған жүйеде, бастапқы және соңғы күйлермен анықталмайды, бірақ осы ауысу тәсіліне тәуелді (¶Q жүйенің күй функциясы емес). Әдетте, келтірілген жылу көлемі - жылу ¶Q жүйенің температурасы Т-ға жүйедегі күйлер шексіз аз өзгерістер қатынасы кезіндегі - күй жүйесінің функциясы. Кез- келген айналмалы жүйеде

Интеграл астындағы теңдеу қайсыбір функцияның толық диференциялы, ол жүйедегі күйлердің тек қана бастапқы және соңғы мәндерімен анықталады.
Энтропия S жүйенің күй функциясы деп аталады, дифференциялы  :
:
dS= 
Энтропияның өзгеруі. Қайтымды процесстер үшін жабық жүйеде DS = 0; қайтымсыз циклдер үшін DS>0.
Клаузиус теңcіздігі: жабық жүйедегі энтропия өсуі мүмкін (қайтымсыз процестер жағдайында) немесе қалыпты күйде қалады (қайтымды процестер жағдайында)
dS және dQ бірдей белгі болғандықтан, яғни өзгеру сипаттамасы бойынша энтропияны жылу алмасу процесінің бағытында деп айтуға болады.
Денені қыздырғанда dQ> 0, оның энтропиясы өзгереді dS > 0, суытқанда dQ < 0 және дененің энтропиясы төмендейді dS < 0
Изоэнтропия деп тұрақты энтропия кезінде өтетін процесті айтады. (S = const)
Энтропия ретсіз жүйенің өлшемі болады – неғұрлым макрокүйлер саны көп болса, соғұрлым энтропия көп болады. Жабық жүйедегі барлық процесстер, оның энтропиясының өсуіне әкеледі. Энтропия, күйдің ықтималдылығы максималды болғанша, жабық жүйедегі аз ықтималдылықтан көп ықтималдыққа қарай бағытталып жүреді, Тепе-теңдік күйде күй системасының ең үлкен ықтималдылығы орындалады, мұнда микрокүйлердің саны максималды болғандықтан, энтропия да максималды болады.
Термодинамиканың екінші бастамасы. Кез-келген жабық жүйедегі қайтымсыз процесс мына түрде болады - жүйенің энтропиясы өседі (энтропияның өсу заңы)
Термодинамиканың бірінші бастамасы деп - термодинамикалық процестерге қатысты энергияның сақталу және түрлену заңын айтады.
Термодинамиканың екінші бастамасы - термодинамикалық процестердің жүру өту бағытын анықтайды, яғни табиғатта қандай процестердің болатынын немесе болмайтынын көрсетеді.
Термодинамиканың екінші бастамасының екі анықтамасы бар: олар энтропияның өсу заңының эквиваленті.
1) Кельвин бойынша: жалғыз нәтижесі қыздырғыштан алынған жылуды оған эквивалент жұмысқа айналдыратын айналмалы процесс мүмкін емес;
2) Клаузиус бойынша: бар нәтижесі - аз қыздырылған денеден көп қызған денеге жылу беру болып табылатын айналмалы процесс мүмкін емес;
термодинамиканың үшінші бастамасы – абсолют нөлге ұмтылғанда тепе-тең күйде дененің энтропиясының нөлге ұмтылуы 
11. Нақты газдың физикалық моделі. Нақты газ заңдарының идеал газ заңдарынан ауытқуы. Молекула аралық əсерлесудің потенциалдық энергиясы. Ван-дер-Ваальс теңдеуі және оны талдау. Нақты газдарды қарастырғанда молекуланың өзіндік көлемін және молекула аралық өзара әсерлесу күшін ескеру керек.Молекулалардың өзара әсерлесу күші – қысқа әсерлі олар  м аз арақашықтықта пайда бола бастайды. Молекулалардың өзара әсер күші дегеніміз бұл тартылу күшінің қорытқы күші
м аз арақашықтықта пайда бола бастайды. Молекулалардың өзара әсер күші дегеніміз бұл тартылу күшінің қорытқы күші  (олар үлкен арақашықтықта әсерлеседі) және тебілу күші
(олар үлкен арақашықтықта әсерлеседі) және тебілу күші 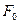 (олар аз қашықтықта әсерлеседі)
(олар аз қашықтықта әсерлеседі)  қашықтықта бұл күштер бір-бірін теңестіреді және
қашықтықта бұл күштер бір-бірін теңестіреді және  . Сонымен
. Сонымен  - бұл молекулалар жылулық қозғалыста болмайтын, молекулалар арасыдағы тепе-теңдік арақашықтық. Тұрақты тепе-теңдік күйде,
- бұл молекулалар жылулық қозғалыста болмайтын, молекулалар арасыдағы тепе-теңдік арақашықтық. Тұрақты тепе-теңдік күйде,  болғанда, молекулалардың өзара әсерлесуінің
болғанда, молекулалардың өзара әсерлесуінің  потенциалдық энергиясы минималь болады.
потенциалдық энергиясы минималь болады.

 мен
мен  арасындағы қатынас әртүрлі агрегаттық күйдің критерииі болып саналады.
арасындағы қатынас әртүрлі агрегаттық күйдің критерииі болып саналады.
 тепе-теңдікте тұрған (
тепе-теңдікте тұрған ( ) молекулаларды ажырату үшін тартылу күшіне қарсы істелінетін жұмысты анықтайды.
) молекулаларды ажырату үшін тартылу күшіне қарсы істелінетін жұмысты анықтайды.
 молекуланың жылулық қозғалысының бір еркіндік дәрежесіне келетін екі еселенген орташа энергиясын анықтайды.
молекуланың жылулық қозғалысының бір еркіндік дәрежесіне келетін екі еселенген орташа энергиясын анықтайды.
 болған кезде зат газ тәрізді күйінде болады, сонымен молекуланың жылулық қозғалысы молекуланың байланысуына қарсы әсер етеді (конденсация).
болған кезде зат газ тәрізді күйінде болады, сонымен молекуланың жылулық қозғалысы молекуланың байланысуына қарсы әсер етеді (конденсация).
 зат қатты күйде болады, сонымен жылулық энергия молекуланы бір бірінен “жұлуға” жеткіліксіз.
зат қатты күйде болады, сонымен жылулық энергия молекуланы бір бірінен “жұлуға” жеткіліксіз.
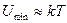 зат сұйық күйде болады, сонымен молекуланың жылулық қозғалысының нәтижесінде молекулалар кеңістікте араласады, орындарымен алмасады, бірақ
зат сұйық күйде болады, сонымен молекуланың жылулық қозғалысының нәтижесінде молекулалар кеңістікте араласады, орындарымен алмасады, бірақ  арақашықтықтан ары кетпейді.
арақашықтықтан ары кетпейді.
Ван-дер-Ваальс теңдеуі. Идеал газдың күй теңдеуіне  молекулалардың өзіндік көлемін және молекулалардың өзара әсерлесуін ескеретін түзету енгіземіз.
молекулалардың өзіндік көлемін және молекулалардың өзара әсерлесуін ескеретін түзету енгіземіз.
 Нақты газдың шын көлемі
Нақты газдың шын көлемі  , мұндағы
, мұндағы  - молекулалардың өзінің алатын көлемі. Радиусы
- молекулалардың өзінің алатын көлемі. Радиусы  екі молекула
екі молекула  арақашықтықтан аз қашықтыққа жақындай алмайды, сонымен екі молекуланың центрі үшін радиусы
арақашықтықтан аз қашықтыққа жақындай алмайды, сонымен екі молекуланың центрі үшін радиусы  сфералық көлем болмайды. Бұл
сфералық көлем болмайды. Бұл  көлемі бір молекуланың көлемінен 8 есе үлкен, бір молекулаға есептегенде төрт еселенген молекула көлеміне тең.
көлемі бір молекуланың көлемінен 8 есе үлкен, бір молекулаға есептегенде төрт еселенген молекула көлеміне тең.
Молекулалардың өзара тартылу күшін ескеру газға қосымша 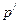 қысымын енгізумен жүреді, ол ішкі қысым деп аталады.
қысымын енгізумен жүреді, ол ішкі қысым деп аталады.
 , мұндағы
, мұндағы  - Ван-дер-Ваальс тұрақтысы.
- Ван-дер-Ваальс тұрақтысы.
Газдың молі үшін Ван-дер-Ваальстің теңдеуі- нақты газ күйінің теңдеуі:

Газдың кез келген массасы үшін:
 , мұндағы
, мұндағы  ,
,  .
.
12. Нақты газдың физикалық моделі. Нақты газдың ішкі энергиясы. Джоуль-Томсон эффектісі Нақты газ молекулаларының арасындағы өз ара әсерлердің нәтижесінде олардың өз ара потенциялық энергиясы Ер пайда болады да, бұл энергия газ молекулаларының Ек қозғалыс кинетикалық энергиясымен қатар газдың ішкі энергиясының құрамына кіреді:
U =E k + Ep.
Бізге газдың киломоліндегі молекулалардың кинетикалық энергиясы
Е k = CVТ, яғни температура функциясы екені белгілі.
Молекулалардың өз ара потенциялық энергиясы, олардың бір-бірінен
орташа ара қашықтықтарына байланысты. Сондықтан Ер газ көлемінің функциясы болуға тиіс. Демек, нақты газдың ішкі энергиясы мына екі параметрдің функциясы екен: Т және V.
Газ ұлғайған кезде молекулалардың арасындағы тартылыс күштерді жеңуге кеткен жұмыс істелуге тиіс. Механикадан ішкі күштерде қарсы істелетін жұмыс системаның, потенциялық энергиясын арттыруға жұмсалатыны белгілі. Сыртқы күштерді жеңуге кеткен жұмыстың 
өрнек арқылы анықталатыны сияқты киломоліндегі молекулалардың арасында әсер етуші ішкі күштерді жеңу жұмысын да  түріндежазуымызғаболады,
түріндежазуымызғаболады,
мұндағы рi- Ван-дер-Ваальстықгазжағдайында  -ғатеңішкіқысым.
-ғатеңішкіқысым.  -.ны молекулалардың өзара потенциялық энергиясының d Ер өсімшесіне теңестіре отырып, мынаны аламыз;
-.ны молекулалардың өзара потенциялық энергиясының d Ер өсімшесіне теңестіре отырып, мынаны аламыз;
 Бұл өрнекті интегралдау потенциялық энергия үшін мынаны береді:
Бұл өрнекті интегралдау потенциялық энергия үшін мынаны береді: 
Интегралдау тұрақтысының мәнін Uішкі энергияға арналған өрнек шекті жағдайда, яғни көлем шексіздікке дейін ұлғайған жағдайда идеал газдың ішкі энергиясына арналған өрнекке айналатындай етіп алуымыз керек (көлемді ұлғайтқан кезде нақты газдардың бәрі өздерінің қасиеттері жөнінен идеал газға жуықтайтынын еске салайық). Осы пікірлерге сүйеніп, интегралдау тұрақтысын нольге тең деп алу керек. Сонда нақты газдың ішкі энергиясы үшін мынадай өрнек шығады:
 (1)
(1)
бұдан біз ішкі энергияның температураны арттырған жағдайда да, көлемді арттырған жағдайда да өсетінін көреміз.
Егер газ қоршаған ортамен жылу алмаспай-ақ және сыртқы жұмыс жасамай-ақ ұлғаятын, не сығылатын болса, онда оның іщкі энергиясы термодинамиканың бірінші бастамасына сәйкес тұрақты болып қалуға тиіс. Мұндай жағдайда энергиясы (1) ф.ормуласы бойынша анықталатын газ үшін мына шарт сақталуға тиіс:

бұдан  мен
мен  таңбалары қарама-қарсы екені шығады.
таңбалары қарама-қарсы екені шығады.
Демек, бұл сияқты жағдайларда газ ұлғайған кезде әрқашан сууға тиіс, ал сығылса қызуға тиіс.Яғни Ван-дер-Ваальс теңдеуіне бағынатын газ. Сыртқы ортаменен энергияның алмасуы болмаса, көлемі өзгергенде газдың ішкі энергиясының  қоры тұрақты болып қалады.
қоры тұрақты болып қалады.
Олай болса

яғни, нақты газдың көлемі өзгергенде потенциалдық энергияның өзгерісі салдарынан молекулалар қозғалысының кинетикалық энергиясыда өзгереді.  теңдігі нақты газ үшінде орындалады, себебі
теңдігі нақты газ үшінде орындалады, себебі  оның молекулалар қозғалысының кинетикалық энергиясымен ғана анықталады.
оның молекулалар қозғалысының кинетикалық энергиясымен ғана анықталады.
Сонда

Сыртқы денелермен жұмыс атқарылмаса және олармен жылу алмасуы болмаса, көлемі өзгергенде нақты газдың температурасыда өзгереді.Тек нақты газдарда болатын бұл құбылысты Джоуль-Томсон эффектісі дейді. Егер ұлғаю кезінде газдың температурасы төмендесе, Джоуль-Томсон эффектісін оң д ейді, ал егер газдың температурасы жоғарласа – теріс дейді.
Зер салып қараса, Ван-дер-Ваальс тендеуі мен Джоуль - Томсон эффектісінің арасында байланыс бары байқалады. Ван-дер-Ваальс теңдеуіндегі «а» және «в» тұрақтыларының ара қатынасына байланысты газдың кызуы немесе сууы мүмкін. Атап айтканда қысымға енгізілген « » - түзетуі, көлемге енгізілген «в»түзетуге қарағанда еске алмайтындай өте аз болатын болса, онда көлемі ұлғайғанда газ қызады (Джоуль — Томсон эффектісі теріс деп аталады). Ал көлемге енгізілген түзету«в» ) қысымға енгізілген түзетуге «
» - түзетуі, көлемге енгізілген «в»түзетуге қарағанда еске алмайтындай өте аз болатын болса, онда көлемі ұлғайғанда газ қызады (Джоуль — Томсон эффектісі теріс деп аталады). Ал көлемге енгізілген түзету«в» ) қысымға енгізілген түзетуге « » қарағанда өте аз шама болса, онда көлемі ұлғайғанда газ суыйды (Джоуль — Томсон эффектісі оң деп аталады).
» қарағанда өте аз шама болса, онда көлемі ұлғайғанда газ суыйды (Джоуль — Томсон эффектісі оң деп аталады).
Газдарды сұйыққа айналдыру үшін оң Джоуль - Томсон эффектісі негізінде жұмыс істейтін Линде машинасы пайдаланылады. Машина арқылы сұйық ауа алуға болады. Сұйық ауа биология мен химияда кеңінен пайдаланылады. Айталық, сұйық ауа көмегімен қатырылған қарапайым организмдер өзінің өмір сүргіштік қабілетін сақтап қалады. Мұнай, жер май (керосин) мен сұйық. ауаны бір-біріне араластырғанда оксиликвит деп аталатын жарылғыш зат алуға болады.
Джоуль-Томсон эффектісінің таңбасы  және
және  түзетулерінің қайсысы үлкенірек роль атқаратынына байланысты.
түзетулерінің қайсысы үлкенірек роль атқаратынына байланысты.
Екі жағдайды жеке алып қарастырайық:
1. Ван-дер-Ваальс теңдеуіндегі  түзетуді елемеуге болады.
түзетуді елемеуге болады.
2. Ван-дер-Ваальс теңдеуіндегі  түзетуді елемеуге болады.
түзетуді елемеуге болады.
13. Нақты газдың изотермалары. Сұйық пен будың тепе-теңдігі. Қаныққан будың қасиеттері. Ауаның ылғалдылығы.
Жылулық қозғалыс әсерiнен пайда болатын кинетикалық энергияның артықтығынан қашанда молекуланың жеке бөлшектерiнiң сұйық бетiнен бөлiнiп шыға алады. Заттың сұйық күйден газ күйiне өту процесiн буға айналу деп атайды. Неғұрлым сұйықтың температурасы жоғары болса, соғұрлым сұйық тезiрек буға айналады.
Буға айналудың екi түрi бар: булану және қайнау. Кез келген температурада және тек сұйық бетiнен шығып бу күйiне айналуды – булану деп атайды. Бу – буланудың әсерiнен пайда болатын газ. Булану барысында сұйық салқындайды.
Буланған молекулалардың белгiлi бiр бөлiгi хаостық (ретсiз) қозғалыс жасай отырып қайтадан сұйық бетiне түсуi және оның молекулаларына айналуы керек. Соныменен, булану процессiмен қатар бiрмезгiлде конденсация деп аталатын керi процесс те жүредi.
Конденсация – бұл заттың салқындау немесе сығылуының салдарынан газ тектес күйден сұйық күйге айналу процессi. Сұйық бетiндегi будың қысымы неғұрлым жоғары болса, сол температурада конденсацияға ұшырайтын молекулалар саны да соғұрлым көп болады.
Бетi ашық ыдыстағы сұйықтың булану процесi конденсация процесiнен басым болып келедi. Ал бетi жабық ыдыста сұйық пен будың арасында, булану процесi мен конденсация процесстерi бiрiн-бiрi толықтыратындай, динамикалық тепе-теңдiк орнайды. Өз сұйығымен динамикалық тепе-теңдiкте болатын буды қаныққан бу деп атайды.
Температура тұрақты болған жағдайда қаныққан будың қысымы оның алатын көлемiне байланысты болмайды.
Егер сұйықтың булануы конденсациядан басым болса немесе сұйық толық буланып кетсе, онда оның устiндегi буды қанықпаған бу деп атайды. Буларға, тек бу қанықпай тұрған жағдайда ғана, идеалды газдар үшiн орныққан заңдарды қолдануға болады.
Жер атмосферасындағы су буының бар екендiгiн сипаттайтын шама ылғалдылық деп аталады. Берiлген жағдайдағы 1 м3 ауа құрамындағы су буларының массасы ауаның абсолюттiк ылғалдылығы f деп аталады. Әдетте оны CИ өлшем бiрлiк жүйесiнде емес г/м3 бiрлiгiмен өрнектейдi:
f = ρбу(г/м3) ≈ P(мм. сынап бағанасы бойынша).
Бұл жерде су буының қысымы деп оның үлестiк қысымын айтады, яғни атмосфераны құрайтын – азот, оттегi және т.б. компоненттерi жоқ, болғандығы су буының жасайтын қысымы.
Ауаның салыстырмалы ылғалдылығы φ деп ауадағы су буының қысымы p -ның атмосфералық температурадағы судың қаныққан буының қысымы pk – ға қатынасына тең шаманы айтады.
φ = (p/pk) · 100 % (2.1)
pk шамасының мәндерi белгiлi сәйкес кестелерден анықталады. Ауаның температурасы төмендеген сайын оның салыстырмалы ылғалдылығы артады, себебi неғұрлым ауаның температурасы төмен болса, соғұрлым су буы қанығуға жақындай түседi.
Салыстырмалы ылғалдықты өлшеу үшiн арнайы психрометр деп аталатын прибор қолданылады.
Салқындату барысында (процесiнде) бұрын қанықпаған бу қаныққан буға айналатын температура шық нүктесi деп аталады. Шық нүктесiне тең температурада атмосферадағы су буы конденсациялана бастайды. Тұман пайда болып, шық түседi, қатты дене беттерi терлей бастайды.
Сұйықтық құрлымы және оның қасиеттері. Беттік қабат. Беттік қабат энергиясы. Беттік керілу. Жұғу. Лаплас қысымы, капиллярлы құбылыс. Ертінділер
Қатты дене мен газдың ортасынан орын алатын заттың агрегаттық күйі сұйық деп аталады. Сұйықтың кейбір қасиеттері қатты денеге, ал енді бір қасиеттері газға ұқсайды. Алайда сұйық газдан да, қатты денеден де өзгеше. Сұйық қатты дене сияқты белгілі бір формаға ие болмайды, ол ауырлық күшінің әсерінен өзі құйылған ыдыстың формасына ие болады. Газ молекулалары бір-бірімен молекулааралық күшпен байланыспаған болса, сұйық молекулалары бір-бірімен молекулааралық күшпен мықтап байланысқан.
Сұйық молекулалары бір-бірінен молекула мөлшеріндей (шамасындай) қашықтықта орналасады. Олай болса, сұйық молекулалары еркін қозғала алмайды. Сұйық молекулаларының қозғалысын алғаш Ян Френкель зерттеген. Оның пайымдауынша сұйық молекуласы біраз уақыт тепе-теңдік маңайында бір орында шамамен 10~10-10~12 с тербеліп тұрады да, айналасындағы басқа бөлшектердің әсерінен өз орнынан ыршып кетіп, басқа орынға барып тербеледі. Сөйтіп, сұйық молекулалары бір орыннан екінші орынға көшіп жүреді.
Сұйықтар да газдар тәрізді, абсолют аққыш. Сүйыққа ауырлық күші әсер етпейтіндей жағдай жасасақ, ол шар формасына ие болады. Мұндай құбылыс салмақсыздық кезінде космос корабльдерінде байқалады.
Газдарға қарағанда сұйық өте нашар сығылады. Сұйықтардың бұл қасиеті олардың молекулаларынын, өте тығыз орналасуымен түсіндіріледі. Сұйықтың сығылу коэффициенті мынаған тең:

Мұндағы V- сұйықтың бастапқы көлемі, қысым  Р-ға өскенде көлем
Р-ға өскенде көлем  -ға кішірейеді.
-ға кішірейеді.
Сұйықтар жылулық ұлғаю коэффициентіне ие болады. Дененің, жылулық ұлғаю коэффициентін өлшейтін құралды дилатометр деп атайды. Қысым тұрақты болғанда сұйықтың көлемдік ұлғаю коэффициенті мына формуламен анықталады:

Сұйықтар, қатты денелер тәрізді беріктік қасиетке ие. Сұйық бағанының бірлік көлденең қимасына түсірілген күштің әсерінен сұйық бағанының үзілуін сұйық беріктігі деп атайды. Ол Н/м2-пен өлшенеді.
Бензолдың беріктігі 157* 105 Н/м2, ал судыкі - 280 * 105 Н/м2.
Температура аса жоғары болмаған кезде сұйықтардың молекулалық көлемі газдардың молекулалық көлеміне қарағанда әлдеқайда аз болады. Сұйық молекулаларының тартылу күші газ молекулаларының тартылу күшіне қарағанда көбірек.
Сұйық бетіндегі барлық молекулалар күші сұйыққа қысым түсіреді. Осы қысымды ішкі немесе молекулалық қысым деп атайды. Сұйықтың табиғатына, құрамына байланысты сұйық беті дөңес немесе ойыс болуы мүмкін. Осы ойыс немесе дөңес бетте беттік керілу күші нәтижесінде қосымша қысым пайда болады.
Дөңес бет астында пайда болған қосымша қысым төмен бағытталса, ойыс бет астындағы қысым жоғары қарай бағытталады (сурет). 1805 жылы Лаплас осы қосымша қысымды анықтайтын формуланы тұжырымдады.

 ,
,
мұндағы P – қосымша қысым, 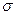 - беттік керілу коэффициенті, R1, R2 - қисықтық радиустары.
- беттік керілу коэффициенті, R1, R2 - қисықтық радиустары.
Егер бет сфералық бет болса, онда R1= R2 =R болады да
Лаплас формуласы былайша өрнектеледі:  Дөңес бет үшін плюс таңбасы, ойыс бет үшін минус таңбасы қойылады. Қосымша қысымды кейде Лаплас қысымы немесе капиллярлық қысым деп атайды. Механикада сияқты жүйе потенциалдық энергиясы аз күйге талпынады, және потенциалдық энергиясы аз күй біршама тұрақты болып есептелінеді, изотермиялық шарттарында термодинамикада жүйе еркін энергиясы аз күйге талпынады. Сондықтан сұйықтың беті сығылуға тырысады. Осыған орай, сұйықтың бетінде беттік керілу деп аталынатын күштер пайда болады. Осында сұйықтық бет жазықтығының әр жақтарына изотропты тартылған жұқа резеңкелік қабатқа ұқсайды.
Дөңес бет үшін плюс таңбасы, ойыс бет үшін минус таңбасы қойылады. Қосымша қысымды кейде Лаплас қысымы немесе капиллярлық қысым деп атайды. Механикада сияқты жүйе потенциалдық энергиясы аз күйге талпынады, және потенциалдық энергиясы аз күй біршама тұрақты болып есептелінеді, изотермиялық шарттарында термодинамикада жүйе еркін энергиясы аз күйге талпынады. Сондықтан сұйықтың беті сығылуға тырысады. Осыған орай, сұйықтың бетінде беттік керілу деп аталынатын күштер пайда болады. Осында сұйықтық бет жазықтығының әр жақтарына изотропты тартылған жұқа резеңкелік қабатқа ұқсайды.
Беттік керілуді біз сабын үлдірлерінен көре аламыз. Мысалы,сабындық еріткіден шығарылған сымдық рамкада сабындық үлдір пайда болады. Егер де рамканың бір MN сымы онша үйкеліссіз MM’ және NN’ сымдарда жылжыса, онда беттік керілу күштері оны бағытына қарай M’N’ тартады және үлдірдің ауданы кішірейеді. Және керісінше, сабын үлдірінің ауданын үлкейту үшін f күш түсіру керек. Сымның  ығысқанда
ығысқанда  жұмыс атқарылады, осы кезде үлдірдің ауданы
жұмыс атқарылады, осы кезде үлдірдің ауданы  мынаған өзгереді. Сондықтан
мынаған өзгереді. Сондықтан  ескеріп
ескеріп  мына түрге ие болады.
мына түрге ие болады.

Мұндағы 2 көбейтіндісі үлдірдің екі беттің бар болғанын ескереді. Сабын үлдіріне бағытында жасалынатын,  сабын үлдірлерінің әрбір MN қашықтығына бөлінген күш. Сандық жағынан бұл күш тығыздықтық еркін беттік энергияға тең болып келеді, өйткені 1Дж/м2= 1Н/м. Сондықтан
сабын үлдірлерінің әрбір MN қашықтығына бөлінген күш. Сандық жағынан бұл күш тығыздықтық еркін беттік энергияға тең болып келеді, өйткені 1Дж/м2= 1Н/м. Сондықтан  беттік керілу деп аталынады. Ол сұйықтың қасиеттеріне байланысты және үлкен кеңістікте пайдаланылады. Көбінесе беттік керілу 200С температурада 10-2– ден 10-1 Н/м- ге дейін болады. Мысалы, Эфирде -1,71*10-2, ацетонда -2,33*10-2, бензолда 2,89*10-2 Н/м.Бірақ сынапта
беттік керілу деп аталынады. Ол сұйықтың қасиеттеріне байланысты және үлкен кеңістікте пайдаланылады. Көбінесе беттік керілу 200С температурада 10-2– ден 10-1 Н/м- ге дейін болады. Мысалы, Эфирде -1,71*10-2, ацетонда -2,33*10-2, бензолда 2,89*10-2 Н/м.Бірақ сынапта 
 0,465 Н/м.
0,465 Н/м.
Беттік керілу — екі фазаның (дененің) бөліну бетінің термодинамикалық сипаттамасы. Өлшем бірліктері Дж/м2 немесе Н/м. Беттік керілуді бөліну беті сұйықтық болған жағдайда, бет контурының ұзындық бірлігіне әсер ететін және фазалардың берілген көлемдерінде бетті ең кіші шамаға (минимумға) дейін жиыруға ұмтылатын күш ретінде де қарастыруға болады. Екі қоюланған (конденсацияланған) фазаның шекарасындағы беттік керілу, әдетте, фазааралық керілу деп аталады. Жаңа бетті түзетін жұмыс, зат молекулаларын дене көлемінен беттік қабатқа ауыстыру кезіндегі молекулааралық ілініс күшін жеңуге жұмсалады. Беттік қабаттағы молекулааралық күштердің тең әсерлі күшінің шамасы дене көлеміндегідей нөлге тең болмайды әрі ол ілініс күштері көбірек болатын фаза ішіне қарай бағытталады. Сонымен беттік керілу беттік (фазааралық) қабаттағы молекулааралық күштердің теңгерілмеуінің өлшемі болады.
15. Аморфты және кристалды денелер. Байланыс энергиясы кристалдың беріктілігі. Полимерлер. Қатты дененің жылулық ұлғаюы. Қатты денелердің жылу сыйымдылығы. Атомдары немесе молекулалары реттелiп орналасқан және периодты түрде қайталанып тұратын iшкi структурасын түзетiн қатты денелер кристаллдар деп аталады. Кристалдардың қырлары әрқашан жазық және дұрыс геометриялық пiшiндi болып келедi. Бөлшектердiң орналасуының салыстырмалы түрде орныққан скелетi кристалдық торлар деп аталады, ал сол торлардың орналасқан орындары түйiндер деп аталады (2.9 – сурет). Кристалдардың сыртқы пiшiнiнiң дұрыстығы – олардың реттелген құрылысының бiр ғана салдары емес. Олардың ең басты ерекшелiгi кристалдың физикалық қасиеттерiнiң ондағы таңдалған бағытына байланыстылығында. Кристалдардың бұл қасиетi анизотропия деп аталады. Барлық кристалды денелер анизотропты болып келедi. Анизотропияның бiр себебi – кристалдық тор түйiндерiнiң тығыздығы әр түрлi бағытта әр түрлi болған жағдайдағы, бөлшектердiң дұрыс ретпен орналасуы. Осы бағыттардағы бөлшектердiң өзара әсерi де бiрдей болмайды. Бұдан, әр түрлi бағыттардағы кисталдардың механикалық берiктiгi әр түрлi екендiгi шығады. Көптеген кристалдар жылу мен электр тогын әр бағытта әр-түрлi өткiзедi. Кристаллдың оптикалық қасиеттерi де оның бағытына байланысты болуы мүмкiн.

|
| 2.9-сурет |
Белгiлi бiр температураға дейiн қыздырғанда (әр заттың өз температурасы бар) зат қатты кристалдық күйден сұйық күйге өтедi. Осы процесс балқу деп аталады, ал балқуға ұшырататын температура балқу температурасы деп аталады. Монокристалдар мен поликристалдар. Қатты денелердiң негiзгi түрiне металдар жатады. Олардың да кристалдық структурасы бар. Бiрақ, бiр қарағанда, олардың кристалдық құрылымы не сырт пiшiнiнен, не физикалық қасиеттерiнен байқалмайды. Металдар кәдiмгi күйде анизотропияны анықтай алмайды. Себебi металл көптеген өзара бiтiсiп кеткен кiшкентай кристаликтерден тұрады. Олардың әр қайсысының қасиеттерi бағытына байланысты, бiрақ олар бiр-бiрiне қарағанда ретсiз бағытталған. Сондықтан, көлемi жекелеген кристаликтердiң көлемiнен анағұрлым үлкен металл iшiндегi барлық бағыттар тең және оның қасиеттерi барлық бағытта бiрдей болады. Көптеген кiшкентай кристаликтерден тұратын қатты дене поликристалдық дене деп аталады, ал монокристалдар деп аталады. Аморфтық денелер. Кристалдық структурасы бар денелермен қатар табиғатта аморфтық денелер деп аталатын көптеген әртүрлi денелер бар. Олар қатты денелер қатарына жатады, бiрақ оларда кристалдарға тән, стуктураның сол фрагментiндегi барлық бағыттар бойынша қайталанушылық жоқ. Тек көршi атомдар ғана белгiлi бiр тәртiппен орналасқан. Сұйықтар секiлдi, аморфтық денелер үшiн бөлшектердiң жақынырақ орналасу тәртiбi тән, бiрақ олардың қимылдары (қозғалуы) өте жәй. Аморфтық денелерге шыны, пластмасса, шайыр, смола және т.б. жатады. Барлық аморфты денелер изотропты болып келедi, яғни олардың физикалық қасиеттерi барлық бағытта бiрдей деген сөз. Сыртқы әсерлердiң нәтижесiнде, аморфтық денелер бiр мезгiлде, қатты денелер секiлдi, серпiмдiлiк қасиетiн және, сұйықтар тәрiздi, аққыштық қасиетiн анықтайды. Бұның мысалы ретiнде әр түрлi смолалардың қасиеттерiн қарастыруға болады. Төменгi температураларда аморфтық денелер өз қасиеттерi жағынан қатты денелердi еске түсiредi. Олардың аққыштық қасиеттерi жоқ дерлiк. Бiрақ, температураның ұлғаю шамасына қарай аморфтық денелер де жұмсарады және олардың қасиеттерi барынша сұйықтың қасиеттерiне жақындай түседi. Бұл мынаған байланысты. Аморфтық денелердiң атомдары немесе молекулалары, сұйық молекулалары секiлдi,өзiнiң тепе-теңдiк күйiнiң маңында тербелiс уақытына ие. Бiрақ, бұл уақыт, сұйықтарға қарағанда, өте көп. Тек температураның өсуiмен ғана, бiр тепе-теңдiк күйден келесi күйге атомдардың секiрiсi бiртiндеп жиiлейдi де, дене аға бастайды. Аморфтық денелердiң кристалдық денелерге қарағандағы бiр ерекшелiгi сонда, олардың белгiлi бiр балқу температурасы болмайды.
16. Клапейрон-Клаузиус теңдеуі. Зат күйінің диаграммасы. Үштік нүкте күй диаграммасының ғылыми технологиялық мәні
Клапейрон — Клаузиус теңдеуі З аттың кез келген екі фазасының тепе-теңдік күйде шамасы температураға тәуелді болатын тек белгілі бір қысым кезінде ғана бола алатынын көрдік. Бұл тәуелділіктің жалпы түрін термодинамиканың екінші бастамасының көмегімен шығарып алуға болады. Ол үшін берілген заттың өз ара тепе-теңдіктегі екі фазасынан тұратың системаға қатысты Карно циклін қарастырайық.Цикл ішінде орындалатын жұмыс А сан жағынан, цикл ауданына тең. Сондықтан мынаны жаза аламыз:
 (1)
(1)
Бұл (1) теңдеуі жуықтап алынған.  нольге ұмтылған кездегі (ол үшін
нольге ұмтылған кездегі (ол үшін  нольге ұмтылуы керек) шекте (1) өрнегі дәл теңдеуге айналады. Цикльдің п. ә. коэффициенті анықтама бойынша мынаған тең:
нольге ұмтылуы керек) шекте (1) өрнегі дәл теңдеуге айналады. Цикльдің п. ә. коэффициенті анықтама бойынша мынаған тең:
 (2)
(2)
Сонымен қатар мынаны жазуға болады:  (3)
(3)
(2) және (3) өрнектерді бірімен-бірін теңестіре отырып,  үшін мынаны аламыз:
үшін мынаны аламыз: 

 . Бұдан
. Бұдан  , (4)
, (4)
 нольге ұмтылғандағы шекте (4) жуықтеңдеу мынадай дәл теңдеуге айналады:
нольге ұмтылғандағы шекте (4) жуықтеңдеу мынадай дәл теңдеуге айналады:
 (5)
(5)
Соңғы (5) қатысы Клапейрон - Клаузиус формуласы (немесе теңдеуі) деп аталады. Клапейрон - Клаузиус теңдеуі температура бойынша тепе-теңдік қысымнан алынған туындыны жылуға ауысумен, теңбе-теңдіктегі фазалардың температурасы және меншікті көлемдерінің айырымымен байланыстырады.(5) бойынша  -туындының таңбасы, жылудың жұтылуы кезінде болатын фазалық өтумен қоса жүретін көлемнің езгерісіне - артуына немесе кемуіне тәуелді болады.
-туындының таңбасы, жылудың жұтылуы кезінде болатын фазалық өтумен қоса жүретін көлемнің езгерісіне - артуына немесе кемуіне тәуелді болады.
Затты сұйық күйінде алып онымен тепе-тендікте тұрған қаныққан буды қарастырайық та, көлемін өзгертпей одан біртіндеп жылу алатын болайық. Бұл процесс заттың температурасының төмендеуімен және соған сәйкес қысымының төмендеуімен байланысты болады. Сондықтан (р, Т) диаграммада зат күйінсуреттейтін нүкте төмен қарай булану қисығының бойымен қозғалатын болады (4 - сурет).Бұл қысымның тепе-теңдік мәніне жауап беретін заттың кристалдану температурасына жеткенге дейін созылады. Бұл температураны Түш арқылы белгілейік. Кристалдану жүріп жатқ ан уақыт бойы, температура мен қысым ұдайы тұрақты болып қала береді. Сол кезде сыртқа әкетіліп жатқан жылу, кристалдану кезінде бөлініп жатқан жылу боп табылады.
Температура Түш және соған сәйкес тепе-теңдік қысым рүш - қатты, сұйық және газ тәрізді фаза сияқты заттың үш фазасының үшеуі де тепе-теңдікте тұратын температура мен қысымның жалғыз мәні. Диаграммадағы (р,Т) соған сәйкес нүкте үштік нүкте деп аталады. Сөйтіп, үштік нүкте заттың үш фазасының үшеуі де тепе-теңдікте тұра алатын шарттарды анықтайды. Кристалдану процесі аяқталғаннан кейін тепе-теңдік күйде қатты фаза мен газ тәрізді фаза қалады. Егер заттан жылу алуды одан әрі соза берсек, температура тағы төмендей бастайды. Соған сәйкес кристалдық фазамен тепе-теңдікте тұрған будың, қысымы да азая бастайды. Зат күйін көрсететін нүкте сублймация қисығының бойымен төмендй бастайды.
 Үштік нүкте температурасы, рүш қысымда тұрып заттың балқитын температурасы болады. Бұдан басқа қысымдарда заттың, балқу температурасы басқаша болады. Заттың балқу қысымы мен балқу температурасының арасындағы байланыс үштік нүктеден басталатын балқу қисығы арқылы кескінделеді. Сөйтіп, үштік нүкте қатты және сұйық, сұйық және газ, ақырында, қатты және газ күйлерінін тепе-теңдік
Үштік нүкте температурасы, рүш қысымда тұрып заттың балқитын температурасы болады. Бұдан басқа қысымдарда заттың, балқу температурасы басқаша болады. Заттың балқу қысымы мен балқу температурасының арасындағы байланыс үштік нүктеден басталатын балқу қисығы арқылы кескінделеді. Сөйтіп, үштік нүкте қатты және сұйық, сұйық және газ, ақырында, қатты және газ күйлерінін тепе-теңдік
(5 – сурет) жағдайларын анықтайтын үш қисықтың қиылысқан нүктесі болады.
Қатты және сұйық фазаның меншікті көлемдерінің қатысына байланысты, балқу қисығының барысы не 4 -суретте көрсетілгендей болады, не 5 -суретте көрсетілгендей болады.
Балқу, булану және сублимация қисықтары, координата жазықтығын үш облысқа бөледі. Сублимация және балқу қисықтарының сол жағында қатты фаза облысы, балқу және булану қисықтарының арасында сұйық күйлер облысы, ақыр аяғында, булану мен сублимация қисықтарының оң жағында заттың газ күйлерінің облысы жатыр. Бұл облыстардың бірінен қалауымызша алған нүкте заттың сәйкес бір фазалы күйін көрсетеді (біз ұдайы тек тепе-теңдік күйді, яғни заттың сыртқы жағдайлар тұрақты болғанда, қанша ұзақ болса да тұра алатын күйін сөз етіп отырмыз). Бұл облыстарды шектейтін қисықтардың біреуінде жатқан кез келген нүкте, заттың тиісті екі фазасының тепе-теңдік күйін көрсетеді. Үштік нүкте үш фазаның барлығының тепе-тендік күйін кескіндейді.
Сөйтіп, диаграммадағы әрбір нүкте заттың белгілі бір тепе-теңдік күйін кескіндейді. Сондықтан да оны к ү й диаграммасы деп атайды.
Дағдылы заттардың көпшілігінде үштік нүкте атмосфералық қысымнан едәуір төмен жатады, сондықтан бұл заттардың қатты күйден газ тәрізді. күйге өтуі екг арадағы сұйық фаза арқылы жүзеге асады. Атап айтқанда, мысалы, судың үштік нүктесіне 4,58 мм. сын. бағанасындағы қысым және 0,0075° С температура сәйкес келеді.
Көмір қышқылы үшін үштік нүкте қысымы 5,11 ат -ға тең (үштік нүкте температурасы - 56,6°С). Сондықтан көмір қышқылы атмосфера қысымында тек қатты және газ тәрізді күйлерде ғана болады. Қатты көмір қышқылы (құрғақ мұз) тікелей газға айналады. Көмір қыш
Date: 2016-06-09; view: 4104; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |