
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Молекулалық физика жауаптары
1. Заттардың молекулалық-кинетикалық теориясын тәжірибе жүзінде негіздеу. Молекулалық физика туралы түсінік. Макроскопиялық жүйенің термодинамикалық жəне статикалық зерттеу əдісі. Молекулалық физика нені қамтиды? Мұнда газдардың, сұйықтықтардың және қатты денелердің құрылысы, олардың сыртқы әсерлердің (қысым, темп-ра, электр және магнит өрістері) нәтижесінде өзгеруі, тасымалдау құбылысы (диффузия, жылуөткізгіштік, ішкі үйкеліс), фазалық тепе-теңдік және ауысу процестері (кристалдану және балқу, булану және конденсация, т.б.) заттардың кризистік күйі, әр түрлі фазалардың бөліну шекараларындағы беттік құбылыстар қарастырылады. 20 ғасырда молекулалық физиканың жедел қарқынмен дамуы нәтижесінде одан статистикалық физика, физ. кинетика, қатты денелер физикасы, физ. химия тәрізді ірі, өз алдына дербес салалар бөлініп шықты. Қазіргі ғылым мен техниканың жаңа заттар мен материалдарды кеңінен пайдалануының нәтижесінде заттар құрылысын зерттеудің сан алуан әдістері пайда болды. Заттардың және олардың зерттеу әдістерінің әр түрлі болуына қарамастан молекулалық физика заттар құрылысының микроскопиялық (молекулалық) сипатына негізделе отырып, олардың макроскопиялық қасиеттерін зерттейді. Молекулалы физика негіздері. Молекулалық физика дегеніміз физиканың заттың құрылысымен қасиеттерін молекула-кинетикалық деп аталатын тұрғыдан зерттейтін физиканың бөлімі болып табылады. Бұл тұрғыдан алғанда, қатты,сұйық және газ күйінде кездесетін кез-келген дене өте кішкентай дербес бөлшектердің-молекулалардың үлкен жиынтығынан тұрады. Кез-келген заттың молеулалары қалыптасқан бағыты жоқ, ретсіз, хаосты қозғалысты болады.
Молекулалардың хаосты қозғалыста болуының тікелей дәлелдемесі-броундық қозғалыс болып табылады. Бұл құбылыстың мәнісі мынада: сұйықта жүзіп жүрсең өте кішкентай (тек микроскоппен коруге болатын) бөлшектер үздіксіз,ретсіз қозғалыста болады, бұл қозғалысының әсеріне ғана байланысты болады. Броундық бөлшектер молекулалардың ретсіз соққылауының әсерінен қозғалыста болады.
Денелердің әр түрлі қасиеттерін және зат күйінің өзгерістерін зерттеумен термодинамика шұғылданады. Алайда термодинамиканың молекула-кинеткалық теориядан айырмашылығы, ол- денелер мен табиғат құбылыстарының микроскопиялық суреттемесін ескермей, тек олардың макроскопиялық қасиеттерін ғана зерттейді. Термодинамика молекулалар мен атомдарды қарастырмай-ақ, процестерді микроскопиялық тұрғыдан қарастыруға сүйенбей, оның өтуі жайында бірқатар қорытындылар жасайды.
Термодинамика негізінде көптеген тәжірбиелік деректердің жинағын жалпылау арқылы тағайындалған бірнеше негізгі заңдар жатыр (оларды термодинамика бастамалары деп атайды) Осы себептен термодинамиканың қорытындылары өте жалпы сипатта болады.
Зат күйінің өзгерістерін әр түрлі көзқарас тұрғысында қарастыра отырып, термодинамика мен молекула-кинетикалық теория бір-бірін толықтырып, негізінен бір тұтас ілім құрайды. Молекула-кинетикалық ұғымдардың даму тарихына орала отырып, алдымен заттың атомистикалық құрылысы жайында ұғымдарды о бастан-ақ көне гректер айтқанын ескерте өтеді.Алайда көне гректердің бұл идеялары данышпандық болжам ғана еді.
XVII ғасырда атомистика болжам емес,ғылыми гипотеза түрінде қайтадан келе бастады. Бұл гипотеза, әсіресе, орыстың данышпан ғалымы мен ойшылы М.В.Ломоносовтың (1711-1765) еңбектерінде айрықша дамытылды, ол өз заманында белгілі болған физикалық және химиялық құбылыстардың бір тұтас суретемесін беруге талпынды. Бұл үшін ол материяның корпускалық (осы кездегі технология бойынша-молекулалық) құрылысы жайлы ұғуға сүйенді. Өз заманында үстемдік еткен жылу тегі (гипотетті жылу сұйығы, оның денедегі шамасы дененің қаншалықты қызғандығын анықтайды) теориясына қарсы шығып, Ломоносов «жылудың себебін» дене бөлшектерінің айналмалы қозғалыста болуынан деп атады. Сөйтіп, Ломоносов негізінде молекула-кинетикалық көзқарасты тұжырымдады деуге болады.
XIX ғасырдың екінші жартысында және XX ғасырдың басында көптеген ғалымдардың еңбектерімен атомистика ғылыми теорияға айналды.
Молекулалы-кинетикалық теорияның негізгі қағидалары және оның тәжірбиелік дәлелдемелері.
Зат құрылымының молекулалы –кинетикалық құрылымы теориясын (МКТ) көптеген бақылаулар мен тәжірбиелердің жалпылама қорытындысы ретінде М.В.Ломоносов жасады. Оның негізгі қағидаларын атап өтейік.
1.Барлық денелер микробөлшектерден(атомдар немесе молекулалардан) тұрады әрі дененің массасы өзін түзетін микробөлшектердің массаларының қосындысына тең: m=moM
2.Денедегі микробөлшектер үздіксіз және хаосты қозғалыста болады әрі бұл қозғалыстың жылдамдығы дененің температурасына тәуелді, сондықтан оны жылулық қозғалыс деп атайды.
3.Денедегі микробөлшектер өзара әрекеттеседі әрі өзара әрекеттесу күшінің тегі электромагниттік болып табылады. Дене бөлшектерінің арасында тебілу күштері де, тартылу күштері де бар.
Молекулалы-кинетикалық теоорияның негізгі қағидаларын дәлелдейтін тәжірбиелік деректерді келтірейік:
1.Заттардың бөлінгіштігі. Осы кезде заттың физикалық және химиялық қасиеттері өзгеріссіз қалады.
2.Газдардың сызылғыштығы. Бұл дене молекулаларының арасында үлкен қашықтықтардың болатынын көрсетеді.
3.Газдың кез-келген көлемді алатыны. Бұл дерек молекулалардың қозғалыста болатынын, сонымен қатар олардың арасындағы қашықтықтардың өзгеріп отыратынын білдіреді.
4.Еселік қатынастар заңы. Бұл заң бойынша кез-келген химиялық қосылытар пайда болғанда рекцияға түсетін заттардың массалары өзара белгілі қатынаста болады. Бұл тікелей болмаса да, денелердің атомдардан тұратынын көрсетеді.
5.Газдың өзі тұрған ыдыстың қабырғасына қысым түсіруі. Бұл молкулалардың қозғалыста болатынын көрсетеді.
6.Диффузия – бір заттың молекулаларының екінші заттың молекулааралық кеңістігіне еніп кетуі.Диффузияны газдарда (иіс судың, бензиннің және т.б иісінің ауада таралуы)сұйықтарда (бояулардың, сияның, тушьтің, сүттің суда таралуы) және қатты денелерде (ұзақ уақыт бойы қорғасын және алтын цилиндрлер бір-біріне тығыз бетестіріліп қойылады)бақылауға болады.
7.Молекулаларды электрондық микроскопте немесе иондық проекторда бақылау. Қазіргі кезде атомдарды күрделі туннельдік микроскоптардың көмегімен бақылауғаболады, олар 100 миллион есе ұлғайтуға қамтамасыз етеді.
8.Болат цилиндрге құйылған майды қатты қысқанда май цилиндрдің сыртына тамшылап шығып, ал цилиндрдің өзі болса бүтін күйінде қала берген. Бұл молекулалардың арасында кеңістіктердің барлығын, яғни дененің тұтас болмайтынын көрсетед.
9. Беттері әдейілеп тегістеліп бір-бірімен түйістірілген екі қорғасын цлиндрдің бір-біріне жабысып қалуы. Бұл жағдайда екі цилиндр біртұтас көрінеді.
10.Денелердің беріктігі денедегі микробөлшектердің өзара тартылатынын білдіреді. Жай таяқтың өзін оп-оңай сындыра алмайсың, себебі молекулалардың арасында тартылыс күші бар.
11. Денелердің серпімді деформациялық қасиеттері де дененің микробөлшектерінің арасында өзара әректтесу күштерінің бар екенін көрсетеді.
12.Броундық қозғалыс дегеніміз- сұйықта немесе газда қалқып жүрген қандай да бір заттың өте ұсақ бөлшектерінің сұйық немесе газ молекулаларының соққыларының әрекетінен бейберекет қозғалуы. Бұл қозғалыс денедегі молекулалардың хаосты қозғалысының айқын дәлелі. Мұны ағылшын ботанигі Р.Броун 1827 жылы тұңғыш рет бақылады. Ол суға түскен плаун спораларын микроскоппен бақылай отырып, оларды хаосты қозғалатынына назар аударды.
Молекулалық физика және термодинамика макроскопиялық денелердің, былайша айтқанда, өте көп микробөлшектерден (молекулалар, атомдар, иондар, электрондар т.с.с.) тұратын денелердің физикалық қасиеттерін зерттейтін физиканың бөлімдері. Осы қасиеттерді зерттеу үшін сапалы түрде алшақ және бірін-бірі толықтыратын екі әдіс қолданылады: молекулалы-кинетикалық (статистикалық) және термодинамикалық. Жүйелерді құрайтын микробөлшектердің қозғалысы сипаттамаларының орташаланған мәндері негізінде макроскопиялық жүйелердің қасиеттерін зерттеу әдісі, молекулалы – кинетикалық (статистикалық) әдіс деп аталады. Жүйелерде жүретін энергияның алмасу заңдарына сүйене отырып макроскопиялық жүйелердің қасиеттерін зерттеу әдісі термодинамикалық деп аталады.
Идеалды газдың физикалық моделі. Идеалды газды тəжірибелік заңы. Менделеев-Клапейрон теңдеуі. Газдық тұрақтылық. Идеалды газ үшін МКТ-ның негізгі теңдеуі.
Макроәлем мен микроәлемнің арасындағы сандық байланысты табу үшін мәселені барынша ықшамдауымыз керек. Әр түрлі газдардың молекулалары бір-бірінен өлшемдері мен массалары және түрліше қосылыстары бойынша да ерекшеленеді. Сонымен қатар әр түрлі газдар молекулаларының арасындағы өзара әрекеттесу күштерімен ерекшеленеді. Егер осы факторлардың барлығын ескерсек,онда алға қойған мақсатымыз шым-шытырық болып кетеді. Сондықтан есептеулерді жеңілдету үшін молекулалы-кинетикалық теорияда нақты газдардың қарапайым физикалық моделі – идеал газ моделі енгізілді. Мұндай газ жоқ, бірақ макро және микроәлемдер арасындағы байланысты тағайындау үшін ол бізге қажет, сонымен қатар идеал газ нақты газдың ең көрнекі, сипатты деген қасиеттеріне ие болуы тиіс.
Идеал газ дегеніміз – молекулалары шексіз аз көлем алатын серпімді шариктер болып табылатын және өзара әрекеттесуі тек олардың бір-бірімен тікелей немесе ыдыстың қабырғасымен соқтығысуы кезінде ғана білінетін газ болып табылады.
Молекула – кинетикалық теорияның негізгі теңдеуі: барлық дене молекулалардан құралады, молекулалар үздіксіз бейберекет қозғалыста болады және өзара әсерлеседі.
 немесе
немесе  Мұндағы:
Мұндағы:  - орташа квадраттық жылдамдық.
- орташа квадраттық жылдамдық.  - молекулалардың ілгерілемелі қозғалысының орта кинетикалық энергиясы.
- молекулалардың ілгерілемелі қозғалысының орта кинетикалық энергиясы.
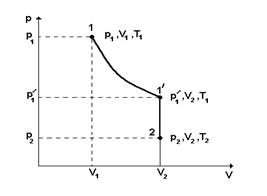
Идеал газдың күй теңдеуі (Менделеев-Клапейрон теңдеуі). Газдың массасы тұрақты болсын  Газдың 1-ші (
Газдың 1-ші (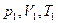 ) күйден 2 – ші (
) күйден 2 – ші (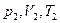 ) күйге өтуін қарастырайық. (сурет)
) күйге өтуін қарастырайық. (сурет)
 ,
,  ,
,  - ті шығарып тастай отырып, алатынымыз
- ті шығарып тастай отырып, алатынымыз
 , немесе
, немесе 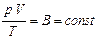 .
.
Бұл – Клапейрон теңдеуі.  - әртүрлі газдар үшін әртүрлі газ тұрақтылары. Менделеев Клапейрон теңдеуін Авогадро заңымен біріктірді. Бір моль үшін
- әртүрлі газдар үшін әртүрлі газ тұрақтылары. Менделеев Клапейрон теңдеуін Авогадро заңымен біріктірді. Бір моль үшін  тұрақтысы барлық газдар үшін бірдей.
тұрақтысы барлық газдар үшін бірдей.  , мұндағы
, мұндағы  - универсал газ тұрақтысы. Кез-келген
- универсал газ тұрақтысы. Кез-келген  массалы газ үшін
массалы газ үшін  .
.
3.Заттардың молекулалық-кинетикалық теориясын тәжірибе жүзінде негіздеу. Молекулалардың өзәра әрекеттесуі. Менделеев-Клапейрон теңдеуі.
Дене құрылымының молекулалық кинетикалық теориясы деп барлық денелер жеке бейберекет қозғалыстағы бөлшектерден тұрады деген көзқарас негiзiнде макроскоптық денелердiң қасиеттерi мен жылу процестерiне түсiнiк беретiн iлiмдi айтады.
Молекулалы-кинетикалық теоорияның негізгі қағидаларын дәлелдейтін тәжірбиелік деректерді келтірейік:
1.Заттардың бөлінгіштігі. Осы кезде заттың физикалық және химиялық қасиеттері өзгеріссіз қалады.
2.Газдардың сызылғыштығы. Бұл дене молекулаларының арасында үлкен қашықтықтардың болатынын көрсетеді.
3.Газдың кез-келген көлемді алатыны. Бұл дерек молекулалардың қозғалыста болатынын, сонымен қатар олардың арасындағы қашықтықтардың өзгеріп отыратынын білдіреді.
4.Еселік қатынастар заңы. Бұл заң бойынша кез-келген химиялық қосылытар пайда болғанда рекцияға түсетін заттардың массалары өзара белгілі қатынаста болады. Бұл тікелей болмаса да, денелердің атомдардан тұратынын көрсетеді.
5.Газдың өзі тұрған ыдыстың қабырғасына қысым түсіруі. Бұл молкулалардың қозғалыста болатынын көрсетеді.
6.Диффузия – бір заттың молекулаларының екінші заттың молекулааралық кеңістігіне еніп кетуі.Диффузияны газдарда (иіс судың, бензиннің және т.б иісінің ауада таралуы)сұйықтарда (бояулардың, сияның, тушьтің, сүттің суда таралуы) және қатты денелерде (ұзақ уақыт бойы қорғасын және алтын цилиндрлер бір-біріне тығыз бетестіріліп қойылады)бақылауға болады.
7.Молекулаларды электрондық микроскопте немесе иондық проекторда бақылау. Қазіргі кезде атомдарды күрделі туннельдік микроскоптардың көмегімен бақылауғаболады, олар 100 миллион есе ұлғайтуға қамтамасыз етеді.
8.Болат цилиндрге құйылған майды қатты қысқанда май цилиндрдің сыртына тамшылап шығып, ал цилиндрдің өзі болса бүтін күйінде қала берген. Бұл молекулалардың арасында кеңістіктердің барлығын, яғни дененің тұтас болмайтынын көрсетед.
9. Беттері әдейілеп тегістеліп бір-бірімен түйістірілген екі қорғасын цлиндрдің бір-біріне жабысып қалуы. Бұл жағдайда екі цилиндр біртұтас көрінеді.
10.Денелердің беріктігі денедегі микробөлшектердің өзара тартылатынын білдіреді. Жай таяқтың өзін оп-оңай сындыра алмайсың, себебі молекулалардың арасында тартылыс күші бар.
11. Денелердің серпімді деформациялық қасиеттері де дененің микробөлшектерінің арасында өзара әректтесу күштерінің бар екенін көрсетеді.
12.Броундық қозғалыс дегеніміз- сұйықта немесе газда қалқып жүрген қандай да бір заттың өте ұсақ бөлшектерінің сұйық немесе газ молекулаларының соққыларының әрекетінен бейберекет қозғалуы. Бұл қозғалыс денедегі молекулалардың хаосты қозғалысының айқын дәлелі. Мұны ағылшын ботанигі Р.Броун 1827 жылы тұңғыш рет бақылады. Ол суға түскен плаун спораларын микроскоппен бақылай отырып, оларды хаосты қозғалатынына назар аударды. Молекулардың өзара әрекеттесу күштерін голландия физигі Я.Д. Ван-дер-Ваальс зерттеген. Молекула аралық күштердің бірнеше түрлері болады және олардың әрбіреуінің өз ерекшеліктері бар. Мысалы: молекула-дипольдардың электрлік күштері дипольдің бағытына тәуелді, сондықтан бағдарлы күштер деп атайды. Дисперциялық және индукциялық күштер де бар. Тартылыс күштерінің 3түрі де қашықтыққа тәуелді 1/r7-не пропорционал кемиді.Тебілу күштеріне қатысты жағдай мынадай:1) олар молекулалар мен атомдардың арақашықтығы азайғанда өте тез артады.2) олар жеке молекуланың түріне тәуелділігі,мұны ескеру және басқа молекулаларға тарату өте қиын. Тебілу күштері молекулалар бір-біріне жақындағанда 1/r 9 қатынасына пропорционал артады.
Идеал газдың күй теңдеуі (Менделеев-Клапейрон теңдеуі). Газдың массасы тұрақты болсын  Газдың 1-ші (
Газдың 1-ші (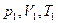 ) күйден 2 – ші (
) күйден 2 – ші (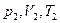 ) күйге өтуін қарастырайық. (сурет)
) күйге өтуін қарастырайық. (сурет) 
 ,
,  ,
,
 - ті шығарып тастай отырып, алатынымыз
- ті шығарып тастай отырып, алатынымыз
 , немесе
, немесе 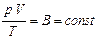 .
.
Бұл – Клапейрон теңдеуі.  - әртүрлі газдар үшін әртүрлі газ тұрақтылары. Менделеев Клапейрон теңдеуін Авогадро заңымен біріктірді. Бір моль үшін
- әртүрлі газдар үшін әртүрлі газ тұрақтылары. Менделеев Клапейрон теңдеуін Авогадро заңымен біріктірді. Бір моль үшін  тұрақтысы барлық газдар үшін бірдей.
тұрақтысы барлық газдар үшін бірдей.  , мұндағы
, мұндағы  - универсал газ тұрақтысы. Кез-келген
- универсал газ тұрақтысы. Кез-келген  массалы газ үшін
массалы газ үшін  .
.
4.Больцман тұрақтысы. Абсолютті температура. Молекулалық газ жылдамдығы. Идеалды молекулалық газдың таралу жылдамдығы. Максвелл бойынша таралуы. Температура үшiн pV/N = kT түрiндегi формуланы практикада пайдалану пропорционалдық коэффициенттiң k сандық мәнiн бiлудi қажет етедi. Оны табуға болады, егер тәжiрибелерден белгiлi мәлiметтердi пайдаланса. Атап айтқанда, үш ыдыспен жасалған тәжiрибеден: V = 0.1 м3 көлемдi алатын сутегiнiң бiр молi үшiн, θ= pV/N шамасы температураның T1 =273o К мәнiнде мынаған тең θ0 = 3.76·10-21 Дж, ал T2=373o К болғанда – θ100 = 5.14·10-21 Дж. Температураның осы мәндерiндегi айырмасын θ = kT өрнегiн пайдаланып жазсақ, шығатыны θ100 – θ0 = k(Т2 – Т1) немесе (5.14 –3.76)·10-21 Дж = k ·100o К. Бұдан k = 1.38·10-23 Дж/К. (1.18)
Бұл коэффициент Больцман тұрақтысы деп аталады. Ол энергетикалық (Дж) өлшем бiрлiкпен анықталатын θ температураны, өлшем бiрлiгi Кельвинмен анықталатын, Т температурамен байланыстырады.
Барлық газдар жылу тепе-теңдiгi кезiнде температуралары бiрдей болады. Молекулалардың жылулық қозғалысы сөз болғандықтан, температураны молекулалық деңгейдегi физикалық шамалар арқылы жазу керек. Бұндай шама ретiнде молекуланың iлгерлемелi қозғалысының кинетикалық энергиясын алуға болады. Бұл жорамал үш ыдыспен жасалған тәжiрибеде толық дәлелденедi. Тәжiрибе көрсеткендей, θ=pV/N қатынасы температурадан басқа ештеңеден тәуелдi емес, сондықтан оны Т температураның бiрден-бiр өлшемi ретiнде қарастыруға болады. θ = kТ немесе pV/N = kT, (1.14)
мұнда k – Больцман тұрақтысы деп аталатын пропорционалдық коэффициентi.
(1.14) теңдiгiмен анықталатын температура терiс шама болуы мүмкiн емес. Сондықтан ол абсолюттi температура деп аталады.
Температураның абсолюттi нөлi (Т = 0) деп молекулалық қозғалыстардың тоқтаған кезiн (E = 0) айтады. Бұл табиғаттағы ең төмен температура. Осы анықтама негiзiнде ағылшын ғалымы У.Кельвин температураның абсолюттi шкаласы ұғымын енгiздi. Бұл шкала бойынша температура абсолюттi нөлден бастап саналады және оның бөлiктерi Цельсий шкаласының градусына тең. Абсолюттi T температура мен Цельсий шкаласы бойынша t температураның арасындағы байланыс Т = t +273 теңдiгiмен берiледi. СИ жүйесiнде абсолюттi температура кельвинмен өлшенедi және ол К әрпiмен белгiленедi. Бiр кельвин Цельсий шкаласы бойынша бiр градусқа тең (1 К =1o С).
(1.14) өрнегiн молекулалық-кинетикалық теорияның PV/N =2/3  түрiндегi негiзгi теңдеуiмен теңестiрiп
түрiндегi негiзгi теңдеуiмен теңестiрiп
 . (1.15)
. (1.15)
Осылайша, абсолюттi температура газ молекулаларының жылулық қозғалысының орташа кинетикалық энергиясының өлшемi болып табылады.
Ағылшын ғалымы Максвелл газ молекулаларының жылдамдық бойынша таралып орналасуын анықтайтын заңды ашты. Бұл заңдылық Максвелл таралуы деп аталды.
Максвелл ықтималдық теориясы мен математикалық статистика заңдылықтарын пайдалана отырып таралу функциясын алды.
Таралу функциясы  - дегеніміз жылдамдықтары модулі
- дегеніміз жылдамдықтары модулі  интервалы арасында жататын газ молекулаларының үлесі болып табылады.
интервалы арасында жататын газ молекулаларының үлесі болып табылады.
 -функциясы газ молекулаларының жылдамдықтар бойынша таралып орналасу функциясы деп аталады. Өз кезегінде
-функциясы газ молекулаларының жылдамдықтар бойынша таралып орналасу функциясы деп аталады. Өз кезегінде  молекулалардың жылдамдықтарының модульдері
молекулалардың жылдамдықтарының модульдері  және
және  аралығында жату ықтималдылығын анықтайды.
аралығында жату ықтималдылығын анықтайды.

мұндағы:  -таралу тығыздығы,
-таралу тығыздығы, 
 .
.
Жылдамдықтары  -ден
-ден  -ге дейінгі аралықта жататын молекулалар саны:
-ге дейінгі аралықта жататын молекулалар саны:

Газ молекулаларының жылдамдықтар бойынша таралу графигі келесі суретте көрсетілген.


мұндағы: Т1<Т2.
Газ температурасы артқан сайын графиктің максимумы үлкен жылдамдықтар жағына ығысады. Сондықтан газдарды қыздырғанда аз жылдамдықпен қозғалатын молекулалардың үлесі азаяды, ал үлкен жылдамдықпен қозғалатын молекулалардың үлесі артады.
Газдағы көпшілік молекулалар ықтимал жылдамдықтай жылдамдықпен қозғалады.  Молекулалардың орташа жылдамдығы -
Молекулалардың орташа жылдамдығы -  .
.
Молекулалардың орташа квадраттық жылдамдығы -  Яғни осы формулалардан
Яғни осы формулалардан  болатыны көрінеді.
болатыны көрінеді.
5. Барометрлік формула. Больцман таралуы. Бос молекуланың сандық дəрежесі. Идеалды газдың ішкі энергиясы. Авогадро санын тәжірибе жүзінде анықтау. Кез – келген газдың молекулалары Жердің тартылыс потенциалдық өрісінде орналасады. Бір жағынан тартылыс, екінші жағынан молекулалардың жылулық қозғалысы, биіктік бойынша газ қысымы азайып отыратындай газдың белгілі бір стационарлық күйіне алып келеді.

 делік, яғни олар биіктіктен тәуелсіз болсын. Олай болса, егер
делік, яғни олар биіктіктен тәуелсіз болсын. Олай болса, егер  биіктікте атмосфералық қысым
биіктікте атмосфералық қысым  - ға тең десек, онда
- ға тең десек, онда 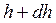 биіктікте ол
биіктікте ол  - ға тең.
- ға тең.  ,мұнда
,мұнда  -
- 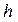 биіктіктегі газдың тығыздығы.
биіктіктегі газдың тығыздығы.
Сондықтан, 
Егер  , онда
, онда 
,
Немесе  Интегралдағаннан кейін
Интегралдағаннан кейін 
Немесе  . (10.9)
. (10.9)
Кез-келген биіктікте  (10.10)
(10.10)
Қысымның биіктікке қатысты азаю заңын көрсететін осы теңдеу барометрлік формула деп аталады. ( Берілген биіктіктегі қысымды өлшей отырып Жер бетінен алғандағы осы биіктікті анықтау үшін қолданылынады).
 екенін ескере отырып, былай жазуға болады:
екенін ескере отырып, былай жазуға болады:
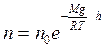 , немесе
, немесе  (10.11)
(10.11)
Бұл жерде  - тартылыс күшінің өрісіндегі молекулалардың потенциалдық энергиясы.
- тартылыс күшінің өрісіндегі молекулалардың потенциалдық энергиясы.
Егер де газ қандай-да бір басқа күш өрісінде орналасатын болса, оның молекулалары белгілі бір потенциалдық энергияны иемденеді. Онда берілген  энергияны иеленген бөлшектердің саны мына өрнектің көмегімен анықталады:
энергияны иеленген бөлшектердің саны мына өрнектің көмегімен анықталады:  Бұл өрнек Больцман үлестірілуі деп аталады.
Бұл өрнек Больцман үлестірілуі деп аталады.
Газ молекуласының еркіндік дәрежесі деп молекуланың кеңістіктегі орнын анықтайтын тәуелсіз параметрлердің жиынтығын айтамыз. Егер кез-келген дене кеңістікте қозғалатын болса, онда осы қозғалысты тәуелсіз алты қозғалыстың жиынтығы түрінде қарастыруға болады: үш ілгерілемелі қозғалыстың (тікбұрышты координаталар жүйесінің осьтері бойымен), үш айналмалы қозғалыстың (дененің массалар центрі арқылы өтетін өзара перпендикуляр үш осьтің айналасында) жиынтығы.
Қалыпты жағдайда газ молекулаларының еркіндік дәрежесі: 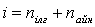
Жоғары температураларда бұл еркіндік дәрежесіне тербелмелі қозғалыстың бұл еркіндік дәрежесі қосылады. Бір атомды газ үш бағытта ілгерілемелі қозғала алады. Сондықтан бір атомды газдың еркіндік дәрежесі  -ке тең. Екі атомды газ үш бағытта ілгерілемелі және екі бағытта айналмалы қозғала алады. Сондықтан екі атомды газдың еркіндік дәрежесі
-ке тең. Екі атомды газ үш бағытта ілгерілемелі және екі бағытта айналмалы қозғала алады. Сондықтан екі атомды газдың еркіндік дәрежесі  -ке тең болады.
-ке тең болады.
Үш атомды газ үш бағытта ілгерлемелі және үш бағытта айналмалы қозғала алады Сондықтан үш атомды газдың еркіндік дәрежесі 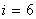 -ға тең болады.
-ға тең болады.
Идеал газдың ішкі энергиясы Заттарды құрайтын бөлшектердің қозғалысының орташа кинетикалық энергиясының осы бөлшектердің өзара әсерлесу орташа потенциалдық энергиясына қосындысын ішкі энергия деп атайды. Өлшем бірлігі  .
.
 Идеал газдың ішкі энергиясы абсолют температураға тура пропорционал болады:
Идеал газдың ішкі энергиясы абсолют температураға тура пропорционал болады:  Идеал газдың ішкі энергиясының өзгерісі
Идеал газдың ішкі энергиясының өзгерісі  Кез-келген газдардың ішкі энергиясы
Кез-келген газдардың ішкі энергиясы  мұндағы:
мұндағы:  – газ молекуласының еркіндік дәрежесі.
– газ молекуласының еркіндік дәрежесі.
6. Молекулалардың еркін жүру жолының орташа ұзақтығы және орташа ұзындығы. Газдағы диффузия. Газдың ішкі үйкелісі (тұтқырлығы). Газдардағы жылуөткізгіштік
Молекулалар бейберекет (хаосты) қозғалысы кезінде молекулалар бір- бірімен үздіксіз соқтығысып отырады. Молекула траекториясы броун бөлшегінің траекториясына ұқсас және сынық сызық болып табылады. Екі кезек соқтығысудың арасындағы молекуланың жүрген  жолын оның еркін жүру жолының ұзындығы деп атайды.
жолын оның еркін жүру жолының ұзындығы деп атайды.
10.8-сурет
Еркін жүру жолының ұзындығы үнемі өзгеріп отырады. Бірак молекулалар саны орасан зор және олар бейберекет қозғалыста болғандықтан молекулаланың еркін жүру жолының  орташа ұзындығы туралы айтады.
орташа ұзындығы туралы айтады.  - ны анықтау үшін молекуланың 1с уақыт ішіндегі жүріп өткен барлық жолының сол уақыттағы молекуланың ұшыраған соқтығысуларының орташа
- ны анықтау үшін молекуланың 1с уақыт ішіндегі жүріп өткен барлық жолының сол уақыттағы молекуланың ұшыраған соқтығысуларының орташа  санына бөлу керек:
санына бөлу керек:
 (10.13)
(10.13)
 -і анықтау үшін молекуланы диаметрі
-і анықтау үшін молекуланы диаметрі  шарик деп алып, ал басқа молекулалар қозғалмайды деп есептейік.
шарик деп алып, ал басқа молекулалар қозғалмайды деп есептейік.

10.9-сурет
Сонда 1с уақыттағы молекулалар соқтығысуларының орташа  саны сынық цилиндрдің
саны сынық цилиндрдің  көлеміндегі
көлеміндегі  молекулалар санына тең. Сынық цилиндрдің көлемін биіктігі
молекулалар санына тең. Сынық цилиндрдің көлемін биіктігі  және табанының ауданы
және табанының ауданы  түзетілген цилиндрдің көлеміне тең деп алуға болады.
түзетілген цилиндрдің көлеміне тең деп алуға болады.
 . (10.14)
. (10.14)
Егер басқа молекулалардың қозғалысын ескерсек, онда дәлме-дәл теориялық
есептеулер бойынша:  Сонда еркін жүру жолының орташа
Сонда еркін жүру жолының орташа
ұзындығы мынаған тең:  . (10.15)
. (10.15)
Еркін жүру жолының ұзындығы қысымға кері пропорционал, себебі:
 . (10.16)
. (10.16)
яғни, қысым төмендеген сайын  артады. Кейбір қысымда еркін жүру жолының ұзындығы газ орналасқан ыдыстың өлшеміне тең боладыда, одан ары өспейді. Осы кездегі газдың күйін вакуум деп атайды.
артады. Кейбір қысымда еркін жүру жолының ұзындығы газ орналасқан ыдыстың өлшеміне тең боладыда, одан ары өспейді. Осы кездегі газдың күйін вакуум деп атайды.
Ыдыстың 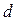 өлшемімен еркін жүру жолының
өлшемімен еркін жүру жолының  ұзындығының ара қатысына байланысты вакуумның мына түрлерін ажыратады:
ұзындығының ара қатысына байланысты вакуумның мына түрлерін ажыратады:
1) орта вакуум 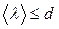 2) жоғары вакуум
2) жоғары вакуум  >
> 
3) аса жоғары вакуум  >>
>> 
Қазіргі кезде алынатын ең жоғары вакуум  мм. сын. бағ.
мм. сын. бағ.
Егер термодинамикалық жүйе тепе-теңдік күйде болмаса, жүйеде тасымалдау құбылыстары деп аталатын қайтымсыз ерекше процестер жүреді. Олардың нәтижесінде массаның, импульстің және энергияның кеңістіктегі тасымалдануы жүреді.
Тасымалдау құбылыстарына диффузия (массаның тасымалдануы), ішкі үйкеліс (импульстің тасымалдануы) және жылу өткізгіштік (энергияның тасымалдануы) жатады.
Тасымалдау құбылыстарының жалпы теңдеуі молекула-кинетикалық теория негізінде алынады.
Егер тасымалдау тек  - осі бойымен өтетін болса, онда
- осі бойымен өтетін болса, онда
 , (10.17)
, (10.17)
мұндағы  - газдың тасымалданатын физикалық сипаттамасы,
- газдың тасымалданатын физикалық сипаттамасы,
 - тасымалдану кезінде
- тасымалдану кезінде  уақыт ішіндегі
уақыт ішіндегі  - осі бағытына перпендикуляр орналасқан
- осі бағытына перпендикуляр орналасқан  аудан арқылы өтетін молекулалар саны,
аудан арқылы өтетін молекулалар саны,  қатынасы
қатынасы  - шамасының градиенті
- шамасының градиенті

10.10-сурет
Бұл жағдайдағы тасымалданатын шама – молекула массасы  . Олай болса
. Олай болса
 ,
,
ал
 .
.
Сонда
 .
.
 ,
,  деп диффузия коэффициентін белгілесек,
деп диффузия коэффициентін белгілесек,
 , (10.18)
, (10.18)
диффузия теңдеуін немесе Фик заңын аламыз.
Диффузия коэффициенті 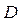 газ қысымына кері пропорционал (себебі
газ қысымына кері пропорционал (себебі  ~
~ 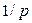 ) және температураның квадрат түбіріне тура пропорционал (себебі
) және температураның квадрат түбіріне тура пропорционал (себебі 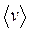 ~
~  )
)
Ішкі үйкеліс
Бұл жағдайдағы тасымалданатын шама – молекула импульсы  . Мұндағы
. Мұндағы  - газ қабатының жылдамдығы. Олай болса
- газ қабатының жылдамдығы. Олай болса
 ,
,
ал
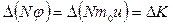 ,
,
мұндағы  - шекаралық
- шекаралық  аудандағы
аудандағы  уақыт ішіндегі газ қабаттары импульстерінің өзгерісі. Сонда
уақыт ішіндегі газ қабаттары импульстерінің өзгерісі. Сонда
 .
.
 ,
,  деп ішкі үйкеліс коэффициентін белгілесек,
деп ішкі үйкеліс коэффициентін белгілесек,
 (10.19)
(10.19)
ішкі үйкеліс теңдеуін немесе Ньютон заңын аламыз.
Ішкі үйкеліс коэффициенті қысымға тәуелсіз (себебі  ~
~  , ал
, ал  ~
~  ) және температураның квадрат түбіріне тура пропорционал. Бірақ вакуум үшін
) және температураның квадрат түбіріне тура пропорционал. Бірақ вакуум үшін  қысымға тәуелсіз, сондықтан
қысымға тәуелсіз, сондықтан  ~
~  .
.
Бұл жағдайдағы тасымалданатын шама – молекуланың энергиясы
 Олай болса
Олай болса  ,
,
ал  ,
,
мұндағы  - температураның кему бағытына перпендикуляр орналасқан
- температураның кему бағытына перпендикуляр орналасқан
 аудан арқылы
аудан арқылы  уақыт ішінде тасымалданатын жылу мөлшері.
уақыт ішінде тасымалданатын жылу мөлшері.
Сонда 
 ,
, 
деп жылу өткізгіштік коэффициентін белгілесек,
 (10.20)
(10.20)
жылу өткізгіштік теңдеуін немесе Фурье заңын аламыз.
Жылу өткізгіштік коэффициенті қысымға тәуелсіз, себебі  ~
~  , ал
, ал  ~
~  . Бірақ вакуум үшін
. Бірақ вакуум үшін  қысымға тәуелсіз, сондықтан
қысымға тәуелсіз, сондықтан  ~
~  . Сиретілген газ үшін жылу өткізгіштік коэффициентінің қысымға тәуелділігі Дьюар ыдысында (термос) пайдаланылады.
. Сиретілген газ үшін жылу өткізгіштік коэффициентінің қысымға тәуелділігі Дьюар ыдысында (термос) пайдаланылады.
Тасымалдау коэффициенттерінің арасында мына байланыстар бар
 ,
,  . (10.21)
. (10.21)
7.Жылу алмасу және жұмысты энергияның берілу әдістері ретінде қарастыру. Ішкі энергия – жүйе күйінің функциясы. Дененің ішкі энергиясы – бұл молекулалардың жылулық қозғалысының
кинетикалық энергиясы мен олардың өзара әсерлесуінің потенциалдық энергиясының жиынтығы.
Идеал газдың бір моль мөлшері үшін оның ішкі энергиясы:
 , (11.7)
, (11.7)
ал газдың кез-келген массасы үшін  . (11.8)
. (11.8)
Механикалық қозғалыстың энергиясы жылулық қозғалыстың энергиясына ауыса алады және керісінше. Осындай ауысу кезінде энергияның сақталу және түрлендірілу заңы орындалады. Термодинамикалық процестерге қатысты бұл заң термодинамиканың бірінші бастамасы болып табылады.
Ішкі энергиясы  -ге тең кейбір жүйе (поршень астындағы цилиндрдегі газ) сырттан
-ге тең кейбір жүйе (поршень астындағы цилиндрдегі газ) сырттан 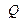 жылу мөлшерін алып, сыртқы күштерге қарсы
жылу мөлшерін алып, сыртқы күштерге қарсы  жұмыс атқарсын. Сонда жүйе ішкі энергиясы
жұмыс атқарсын. Сонда жүйе ішкі энергиясы  -ге тең жаңа күйге ауысады.
-ге тең жаңа күйге ауысады.
Егер жылу жүйеге берілсе  оң болып саналады, ал жұмыс
оң болып саналады, ал жұмыс 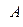 оң болу үшін ол сыртқы күштерге қарсы орындалу қажет. Жүйе бірінші күйден екіншіге кез келген тәсілмен ауысқанда энергияның сақталу заңына сәйкес ішкі энергияның
оң болу үшін ол сыртқы күштерге қарсы орындалу қажет. Жүйе бірінші күйден екіншіге кез келген тәсілмен ауысқанда энергияның сақталу заңына сәйкес ішкі энергияның  өзгерісі бірдей болады да мынаған тең:
өзгерісі бірдей болады да мынаған тең:
 , немесе
, немесе 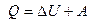
Жүйеге берілген жылу мөлшері оның ішкі энергиясын өзгертуге және жүйенің сыртқы күштермен жұмыс істеуіне жұмсалады.
Термодинамиканың бірінші заңының дифференциалды түрі:  ,
,
мұндағы  - толық дифференциал, ал
- толық дифференциал, ал  және
және  толық дифференциал емес.
толық дифференциал емес.
Күй функциясы дегеніміз жүйе бір күйден екіншіге ауысқанда өзгерісі осы ауысуға сәйкес келетін термодинамикалық процестің түріне тәуелсіз болатын және бастапқы күймен соңғы күйдің параметрлерінің мәндерімен толық анықталатын жүйенің физикалық сипаттамасы. Күй функциясына ішкі энергия жатады. Жүйенің істейтін жұмысы және оның алған жылу мөлшері жүйенің бір күйден екінші куйге ауысу жолына тәуелді, сондықтан олар процесс функциясына жатады. Осыған байланысты, жүйенің әр түрлі күйдегі ие болатын жұмысы немесе жылу қоры туралы айтудың мағынасы жоқ.
Мысалы,
 ,
,  ,
, 
 Егер жүйе бастапқы күйге қайтып оралатын болса, оның ішкі энергиясының өзгерісі
Егер жүйе бастапқы күйге қайтып оралатын болса, оның ішкі энергиясының өзгерісі  .Сонда
.Сонда  .
.
Date: 2016-06-09; view: 4307; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |