
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

K, Ca, Na, Al, Mn, Zn, Fe, Ni, Sn, H, Cu, Hg, Ag, Au
Слева направо падает восстановительная способность атомов и нарастает окислительная способность ионов.
Ряд металлов, расположенных по нарастанию алгебраической величины их потенциалов, называется рядом напряжений металлов.
В этот ряд включен и водород, потенциал которого принимается равным нулю.
Каждый металл, стоящий в ряду напряжений впереди, способен вытеснять из соединений все металлы, стоящие за ним. Водород из разбавленных кислот вытесняется лишь теми металлами, которые стоят в ряду напряжений впереди него.
Каждая окислительно-восстановительная реакция слагается из полуреакций окисления и восстановления. Когда реакция протекаем в гальваническом элементе или осуществляется путем электролиза, то каждая полуреакция протекает на соответствующем электроде; поэтому полуреакции называют также электродными процессами. Каждому электродному процессу соответствует электродный потенциал.
В результате изучения потенциалов различных электродных процессов установлено, что их величины зависят от трех факторов: 1) от природы веществ-участников электродного процесса, 2) от соотношения между концентрациями этих веществ, 3) от температуры системы. Эта зависимость выражается уравнением Нернста (В. Нернст, 1889 г.):
j = j 0 + 2,3  lg
lg 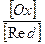 ,
,
где j 0 - стандартный электродный потенциал данного процесса; R - газовая постоянная; Т - абсолютная температура; n - число электронов, принимающих участие в процессе; F - постоянная Фарадея,  и
и  - произведения концентраций веществ, участвующих в окисленной (Ox) и в восстановленной (Red) формах.
- произведения концентраций веществ, участвующих в окисленной (Ox) и в восстановленной (Red) формах.
Физический смысл величины j 0 становится ясным при рассмотрении случая, когда концентрации всех веществ, участвующих в данном электродном процессе равны единице. При этом условии второе слагаемое правой части уравнения обращается в нуль (lg1=0) и уравнение принимает вид: j = j 0.
Концентрации, равные единице, называются стандартными концентрациями. Поэтому и потенциал, отвечающий этому случаю, называется стандартным потенциалом. Итак, стандартный электродный потенциал - это потенциал данного электродного процесса при концентрациях всех участвующих в нем веществ, равных единице.
Таким образом, в уравнении электродного потенциала первое слагаемое (j 0) учитывает влияние на его величину природы веществ, а второе (2,3  lg
lg 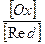 ) - их концентраций. Кроме этого оба члена изменяются с температурой.
) - их концентраций. Кроме этого оба члена изменяются с температурой.
Для обычной при электрохимических измерениях стандартной температуры (250С = 298К), при подстановке значений постоянных величин [R = 8,31 Дж/(моль.К), F = 96500 Кл/моль] уравнение принимает вид:
j = j 0 + 2,3 × 8,31  lg
lg 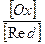 = j 0 +
= j 0 +  lg
lg 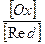 .
.
Для построения численной шкалы электродных потенциалов нужно потенциал, какого-либо электродного процесса принять равным нулю. В качестве эталона для создания такой шкалы принят электродный процесс
2Н+ + 2 e- = Н2 .
Сопоставляя значения электродных потенциалов соответствующих электрохимических систем, рассчитав значение электродвижущей силы окислительно-восстановительной реакции (Е), можно заранее определять направление, в котором будет протекать данная реакция. Если E > 0, реакция протекает в прямом направлении, т.е. слева направо. Если Е < 0, реакция протекает в обратном направлении, т.е. справа налево.
Пример 2.
Определить направление возможного самопроизвольного протекания реакции
2 Hg + 2 Ag+ = 2Ag + Hg22+
при следующих концентрациях (в моль/л) участвующих в реакции ионов: [Ag+] = 10-4, [Hg22+] = 10-1
Решение:
Выпишем значения стандартных электродных потенциалов взаимодействующих электрохимических систем:
Hg22+ + 2 e- = 2 Hg0, j 01 = 0,79В;
Ag+ + e- = Ag0, j 02 = 0,8 В.
Теперь вычислим значения электродных потенциалов при указанных в условии задачи концентрациях
j 1 = j 01 +  lg[Hg22+] = 0,79 + 0,03 lg10-1 = 0,79 - 0,03 = 0,76В;
lg[Hg22+] = 0,79 + 0,03 lg10-1 = 0,79 - 0,03 = 0,76В;
j 2 = j 02 +  lg[Ag+] = 0,8 =0,059 lg10-4 = 0,8 - 0,24 = 0,56В.
lg[Ag+] = 0,8 =0,059 lg10-4 = 0,8 - 0,24 = 0,56В.
Далее определяем ЭДС (Е) окислительно-восстановительной реакции
Е = jокислителя - j восстановителя, в заданной окислительно-восстановительной реакции, серебро является окислителем, а ртуть- восстановителем, следовательно, Е = j 2 - j 1 = 0,56 - 0,76 = - 0,2 В. В данном случае Е < 0, реакция протекает в обратном направлении, т.е. справа налево.
Если окислительно-восстановительную реакцию осуществить так, чтобы процессы окисления и восстановления были пространственно разделены, и создать возможность перехода электронов от восстановителя и окислителю по проводнику (внешней цепи), то во внешней цепи возникнет направленное перемещение электронов - электрический ток. При этом энергия химической окислительно-восстановительной реакции превращается в электрическую энергию. Устройства, в которых происходит такое превращение, называются химическими источниками электрической энергии, или гальваническими элементами.
Всякий гальванический элемент состоит из двух электродов-металлов, погруженных в растворы электролитов; последние сообщаются друг с другом - обычно через пористую перегородку.
Электрод, на котором происходит процесс окисления, называется анодом (он заряжен отрицательно и имеет меньшее значение электродного потенциала).
Электрод, на котором происходит процесс восстановления, называется катодом (он заряжен положительно и имеет большее значение электродного потенциала).
Максимальное значение напряжения гальванического элемента, соответствующее обратимому протеканию реакции, называется электродвижущей силой гальванического элемента и обозначается E. 
E = j + - j-, если E > 0, следовательно, гальванический элемент работать будет.
При схематическом изображении гальванического элемента граница раздела между металлом и раствором обозначается вертикальной чертой, граница между растворами электролитов - двойной вертикальной чертой.
Химическая реакция, которая лежит в основе работы гальванического элемента называется токообразующей.
Date: 2016-01-20; view: 386; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |