
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Кріоскопічні сталі деяких розчинників
| Розчинник | Кк | Розчинник | Кк |
| Вода Нітробензол Бензол | 1,86 5,90 5,10 | Фенол Камфора | 7,80 49,00 |
Зниження тиску насиченої пари над розчином так само, як і зниження температури замерзання розчину залежить лише від кількості часток, молекул, іонів, асоціатів розчиненої речовини і не залежить від природи цих частинок. Зазначені властивості одержали назву колігативних властивостей розчинів. Відомо, що 1 моль речовини вміщує NА= 6,02×1023 молекул (стала Aвогадро). Однак, якщо утворення розчину супроводжується асоціюванням молекул розчиненої речовини, тобто утворенням часток, що складаються з груп молекул, при розчиненні 1 моль речовини, утворюється менша кількість часток у розчині (N£NА), тобто концентрація виявиться меншою порівняно з тією, що була б за відсутності асоціації. Це призводить до того, що зменшення температури замерзання розчину  виявиться замалим, а розрахована молярна маса буде завеликою.
виявиться замалим, а розрахована молярна маса буде завеликою.
При розчиненні електроліту дисоціація його молекул призводить до збільшення кількості частинок у розчині залежно від природи електроліту і ступеня його дисоціації. В цьому випадку (N> NА) концентрація виявиться більшою за розраховану і зниження температури замерзання розчину буде завеликим, а розрахована молярна маса – замалою.
Одержані таким чином молярні маси називають " уявними ".
Для слабкого електроліту відношення істинної молярної маси Міст до "уявної" Муяв показує в скільки разів збільшилась кількість частинок в розчині внаслідок дисоціації: 
 (3.14)
(3.14)
Число і називається ізотонічним коефіцієнтом. Залежність між ізотонічним коефіцієнтом і та ступенем дисоціації a така:
 (3.15)
(3.15)
звідки
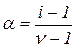 (3.16)
(3.16)
де n – кількість іонів, на які дисоціює молекула в розчині.
Якщо розчинення неелектроліту не супроводжується його асоціацією (наприклад, утворення водних розчинів невеликих концентрацій сахарози, сечовини), кріометричні вимірювання дають істині значення молярної маси. Таким чином, у водних розчинах істинна молярна маса визначається тільки у випадку неелектролітів (сахароза, глюкоза та ін.).
Молярна маса електролітів визначається кріоскопічним методом в органічних розчинниках, у яких розчинена речовина не дисоціює.
Якщо розчинена речовина – електроліт, що розпадається на два іони, використовують рівняння для розрахунку коефіцієнта активності розчиненої речовини g:
 (3.17)
(3.17)
де
 (3.18)
(3.18)
Якщо відомий коефіцієнт активності, можна обчислити активність розчиненої речовини а, моляльна концентрація якої С, г/л:
 (3.19)
(3.19)
Date: 2016-01-20; view: 466; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |