
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Химическое равновесие. Рассмотрим обратимую химическую реакцию получения иодоводорода:
Рассмотрим обратимую химическую реакцию получения иодоводорода:
H2(г)+J2(г)  2HJ(г)
2HJ(г)
Очень подробно эту реакцию исследовал Боденштейн (1890-1900гг). Суть его опытов состояла в том, что заполненные смесью водорода и иода стеклянные ампулы помещали в термостат. Через определенные промежутки времени эти ампулы быстро охлаждали, что приводило к прекращению химической реакции. Последующий анализ указывал на содержание в каждой ампуле водорода, иода и иодоводорода.
Если бы эта реакция протекала нацело, из 0,5 моль H2 и 0,5 моль J2 должен бы образоваться 1 моль HJ. Однако реакция прекращалась по достижении содержания HJ=0,78моль; при этом достигалось равновесие. То же количество HJ оказывалось в ампуле, когда к равновесию подходили с «противоположной» стороны, т.е. в ампулу помещали 1 моль HJ, который разлагался при температуре на H2 и J2.
Не очевидно, что в равновесной системе водорода, иода и иодоводорода реакция продолжается, но в действительности протекает обе реакции- прямая и обратная, скорости которых равны.
Состояние химического равновесия характеризуется тем, что скорость прямой реакции равна скорости обратной реакции. При этом количество продукта, которое образуется за единицу времени, равно количеству этого же вещества, которое распадается на исходное за это время. Когда достигнуто равновесие, концентрация веществ во времени не меняется. Эти концентрации называется равновесным.
Свойства равновесного состояния:
1. Равновесие должно быть динамичным, т.е. после действия фактора смещающего равновесное состояние, система должна, вновь вернутся к равновесию.
2. К состоянию равновесия можно подойти, как со стороны исходных веществ, так и со стороны продуктов реакции.
3. Равновесие характеризуется min значением термодинамических потенциалов, т.е. 0 –значением изменения этих функций.
dGT,P=0; dFT,V=0.
КОНСТАНТА РАВНОВЕСИЯ. ВЫВОД КОНСТАНТЫ РАВНОВЕСИЯ
Рассмотрим химическую реакцию в газовой фазе: aA + bB = cC + dD
T=const; P= const.
Воспользуемся уравнением равновесия в изохорно-изотермических процессах для неизолированных систем, выраженным через химические потенциалы

Для каждого химического потенциала можно записать:


Т.к. химические потенциалы в стандартных условиях  и стехиометрические коэффициенты являются постоянными величинами, их можно сгруппировать:
и стехиометрические коэффициенты являются постоянными величинами, их можно сгруппировать:
 ,
,
где  =
= 



Константа равновесия (Кр) — выражается через равновесное парциальное давление компонентов.
Парциальное давление — это объем одного газа, который занимал бы вес объём данного газа. ∑pi=p
СПОСОБЫ ВЫРАЖЕНИЯ КОНСТАНТ РАВНОВЕСИЯ И СВЯЗИ МЕЖДУ НИМИ
1. Через равновесные концентрации:


С учетом уравнения  парциальное давление равно:
парциальное давление равно:


Подставив это выражение в уравнение константы Кр, получим:
 ,
,
где ∆n=c+d-a-b
Окончательно получаем:

2. Через равновесные мольные доли (Niили Хi,Уi)
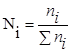 — мольная доля данного компонента. Мольная доля — это отношение числа молей одного компонента к суммарному числу молей всех компонентов реакции.
— мольная доля данного компонента. Мольная доля — это отношение числа молей одного компонента к суммарному числу молей всех компонентов реакции.
aA + bB = cC + dD
∑ni=a+b+c+d;
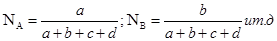
Сумма мольных долей всех участников реакции равна единице:



Пример. Смесь содержит 120г NaOH и 180г воды. Найти мольные доли вещества.
Сначала найдем количества вещества:

Общее количество молей ∑n= 3+10= 13(молей)

Из уравнения состояния смеси: 
 — для смеси газов.
— для смеси газов.

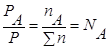

 ,
,
где ∆n=c+d-a-b

Пример: 1) 
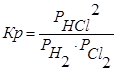
2) 

Константа равновесия меняется: 10-20˂Кр˂1020. Чем больше значение константы равновесия, тем сильнее равновесие сдвинуто в сторону образования продуктов реакции.
РАСЧЕТ СОСТАВА РАВНОВЕСНОЙ СМЕСИ
В объеме 10 л смешали 29 г бутана (С4Н10) и 10 г водорода (Н2). Определить состав равновесной смеси (концентрации всех веществ в состоянии равновесия), если для данной реакций при температуре Т константа равновесия Кс=2.
С4Н10(г)↔С4Н6(г)+2Н2(г)
1. Находим число молей веществ в исходном состоянии.

2. Реакция идет в прямом направлении, т.к. нет С4Н6.
3. Задаемся условиями: пусть равновесие наступит тогда, когда образуется х молей бутена (С4Н6). Значит, образуется 2х молей водорода и его будет (5+2х) молей. Израсходуется х молей батана (С4Н10) и его будет (0,5-х) молей.
Тогда равновесные количества вещества будут равны:
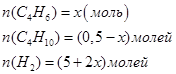
Концентрация их будут равны:

Подставляем эти концентрации в выражение константы равновесия Кс:

Решаем уравнения и получаем:
Хmin=0
Xmax=0,5
0˂X˂0,5
Находим Х следовательно, находим равновесные концентрации веществ.
В заключении проверяется правильность решения. Полученные данные подставляются в уравнение константы равновесия Кс. Если оно равно 2, то задача решена правильно.
| <== предыдущая | | | следующая ==> |
| | | I. По табличным значениям |
Date: 2016-02-19; view: 736; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |