
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Типы реакций и их классификация
Наибольшая степень, в которой концентрации входят в правую часть кинетического уравнения, определяет порядок реакции.
Важнейшей характеристикой химической реакции является скорость. Скорость химического процесса определяется как возрастание или уменьшение концентрации данного вещества во времени.
Химические реакции происходят при столкновении молекул. Число столкновений при заданных внешних условиях (температура, давление, среда) является функцией концентрации реагирующих веществ. В результате реакции часть исходных молекул расходуется на образование продуктов реакции, концентрация исходных веществ при этом убывает и скорость реакции падает.
Если скорость реакции не зависит от концентрации участвующих в реакции реагентов, ее называют реакцией нулевого порядка. Пусть вещество А превращается в вещество В со скоростью, не зависящей от наличной концентрации вещества А (ферментативные реакции, идущие в условиях избытка субстрата). Запишем кинетическое уравнение
k0
А ==> B
Обозначив строчными буквами концентрации а и b, получим кинетические уравнения
da/dt = -k0
db/dt = k0
k0 — константа скорости реакции нулевого порядка. Решения этих уравнений представляют собой линейные функции от времени
а = - k0 t + C1
b = k0 t + C2
C1 и C2 — константы интегрирования, которые можно найти, задав начальные условия (например, при t = 0, а = а0 и b = 0).
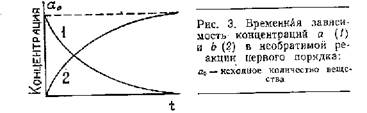
Реакциями первого порядка называются процессы, скорость которых зависит от одной концентрации. Простейший случай такого уравнения:
k1
А => B
Кинетические уравнения запишутся так;
da/dt = -k1 a
db/dt = k1 a
Решение этой системы уравнений также несложно. Для первого уравнения, интегрируя, получим
a = C1 e –k1t
Из начальных условий (при t = 0, а = а0 и b = 0) следует, что
C1 = a0 ..
Выражение для проще всего найти из условия сохранения общей массы вещества в закрытой системе: в любой момент времени а + b = а0, откуда
b = а0 — а = а0 (1 — e –k1t).
Вид кривых изменения а и b во времени показан на рис.1.
Date: 2016-02-19; view: 477; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |