
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Тема 2 Термодинамические процессы
Большое значение для теоретических исследований и решения практических задач имеют так называемые изопараметрические процессы, протекающие при постоянном (фиксированном) значении одного из параметров состояния и адиабатный процесс, который протекает без теплообмена с окружающей средой.
Термодинамические процессы удобно иллюстрировать в виде соответствующих линий (кривых) процесса на двумерных фазовых диаграммах. Широкое распространение имеют pv-, Ts-, hs -диаграммы, которые условно показаны на рис. 1.2.

В общем случае расчет любого термодинамического процесса 1-2 при заданных начальных параметрах (p1, v1, T1) должен сводиться к определению конечных параметров (p2, v2, T2) состояний газа (рабочего тела) и вычислению участвующей в процессе теплоты q1-2, изменению внутренней энергии Δu=u2-u1, энтальпие Δh=h2-h1, энтропие Δs=s2-s1 и работе деформации объема рабочего тела l1-2. Таким образом, рассматриваемый процесс однозначно характеризуется значениями следующих функций процесса, параметров состояния и функций состояния:
(p1, v1, T1, p2, v2, T2, Δu, Δh, Δs, q1-2, l1-2).
Очевидно, что перечисленный спектр величин должен быть дополнен сведениями о физической природе рабочего тела (cp, cv, μг и т.д.).
Следует отметить, что на pv -диаграмме линии процесса описываются уравнением p·vn= const. (Каждому термодинамическому процессу соответствует свое значение показателя политропы n).
Определим уравнение, описывающее линии процесса на T s-диаграмме.
 Для этого рассмотрим совместно следующие выражения:
Для этого рассмотрим совместно следующие выражения:
δq=сdT,
δq=Tds.
Учитывая равенство левых частей этих выражений, приравниваем их правые части:
сdT= Tds.
В полученном дифференциальном уравнении производим разделение переменных и осуществляем интегрирование
dT/T=ds/c 
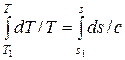

 ,
,
где T1, s1 – соответствуют началу процесса; с – теплоемкость рассматриваемого процесса.
Ниже приведены математические зависимости и фазовые диаграммы, необходимые для анализа и осуществления соответствующих расчетов при исследовании конкретных изопараметрических процессов.
При анализе каждого из изопараметрических процессов необходимо определить значения показателя политропы, теплоемкости процесса и изменения функций состояния, а также величину теплоты, принимающей участие в данном процессе и работу расширения, совершаемый ТДС при протекании рассматриваемого процесса.
Изохорный процесс v= const, dv=0.
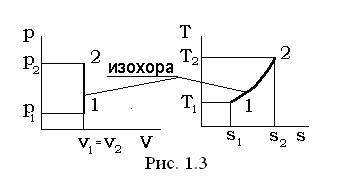
В уравнении линии процесса p×vn= const, (p1/n v= const) условие v= const удовлетворяется при n=¥, а теплоемкость изохорного процесса в соответствии с выражением равна  .
.
Из уравнения состояния идеального газа p×v=Rг×T (при условии v=const) следует
 const
const  .
.
Перечень величин, представленных в выражении для изохорного процесса, взаимосвязан следующими соотношениями:
p1×T2 = p2 ×T1;
 l1-2= 0, v1= v2;
l1-2= 0, v1= v2;
 q1-2= u2 - u1;
q1-2= u2 - u1;
 Δu=u2 - u1= cv× (T2 -T1);
Δu=u2 - u1= cv× (T2 -T1);
 Δh=h2 - h1=cp× (T2 -T1);
Δh=h2 - h1=cp× (T2 -T1);

 ;
;
.
Изобарный процесс p= const, dp=0
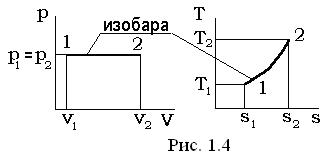
В уравнении политропного процесса p×vn= const, условие р = const удовлетворяется при n = 0; теплоемкость равна  .
.
Из уравнения состояния p×v=Rг×T (при условии p= const) следует  const,
const,  .
.
Соотношения между величинами для изобарного процесса определяются путем интегрирования соответствующих выражений, как это производилось при рассмотрении изохорного процесса и имеют окончательный вид:
v1×T2= v2× T1;
q1-2= h2 - h1;
l1-2= p1× (v2 - v1) = p2× (v2 - v1);
Δu=u2 - u1= cv× (T2 -T1);
Δh=h2 - h1=cp× (T2 -T1);
 .
.
Изотермический процесс Т= const, dТ=0.

В уравнении политропного процесса T×vn-1= const, условие Т= const удовлетворяется при n = 1, а теплоемкость для этого случая определяется из выражения  .
.
Из уравнения состояния p×v=Rг×T (при условии T= const) следует p×v=Rг×T = const, pv = p1 v1 = p2 v2Þ p1 v1= p2 v2.
Перечень величин в изотермическом процессе взаимосвязан следующими соотношениями:
p1× v1 = p2×v2; (
 ;
; 
q1-2= l1-2;
Δu=u2 - u1= 0;
Δh=h2 - h1=0;
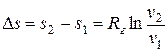 ;
;
T2=T1.
Date: 2016-02-19; view: 467; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |