
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Основное уравнение молекулярно-кинетической теории газов
Хаотичность теплового движения частиц газа означает, что ни одно их направлений их движения не является преимущественным. Соударения между частицами приводит к тому, что скорость их движения непрерывно изменяется по модулю и направлению.
Движение каждой частицы может быть описано законами механики. Но число частиц в газе очень велико и силы, действующие между ними таковы, что описать свойства совокупности частиц невозможно.
В таких случаях для исследования применяется статистический метод. С помощью особого математического аппарата теории вероятностей вычисляются физические величины, характеризующие движение всех частиц (средняя скорость, средняя энергия).
Основное уравнение кинетической теории газов устанавливает зависимость между давлением газа р, его объемом V и кинетической энергией поступательного движения его частиц Eк
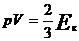 , (6)
, (6)
где 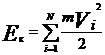 – суммарная кинетическая энергия поступательного движения N одинаковых частиц газа, находящихся в объеме V.
– суммарная кинетическая энергия поступательного движения N одинаковых частиц газа, находящихся в объеме V.
m – масса частицы;
Vi – скорость частицы.
Введем среднюю квадратичную скорость
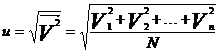 , (7)
, (7)
где 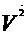 – средний квадрат скорости частиц.
– средний квадрат скорости частиц.
( – не путать с квадратом средней скорости).
– не путать с квадратом средней скорости).
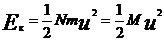 , (8)
, (8)
где 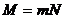 – масса газа,
– масса газа,
тогда
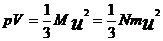 . (9)
. (9)
Откуда можно выразить давление газа
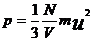 , (10)
, (10)
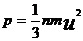 , (11)
, (11)
если 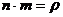 , то
, то
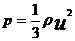 , (12)
, (12)
где r = m × n – плотность газа;
n = N/V – концентрация – число частиц газа в единичном объеме.
Для одного моля газа уравнение (9) будет иметь вид
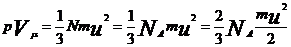 , (13)
, (13)
где  – число Авогадро.
– число Авогадро.
Так как 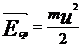 – средняя кинетическая энергия хаотичного теплового движения молекул, то
– средняя кинетическая энергия хаотичного теплового движения молекул, то
 . (14)
. (14)
Сравним уравнение (14) с уравнением Менделеева-Клайперона
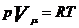 . (15)
. (15)
Приравняем их правые части
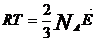 , (16)
, (16)
выразим `Е
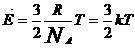 , (17)
, (17)
где 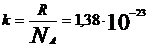 , Дж/К – постоянная Больцмана.
, Дж/К – постоянная Больцмана.
Формула (17) дает физический смысл термодинамической температуры.
Термодинамическая температура является мерой кинетической энергии теплового хаотического движения частиц идеального газа.
Среднюю кинетическую энергию, и с дополнительными оговорками.
По школьному молекулярно-кинетическому определению температуры E = nT, где n - количество степеней свободы молекулы.
Т. к. в системе СИ для этой формулы единицы измерения слева и справа по историческим причинам разные, то пришлось измерить и ввести константу, переводящую одно в другое. Эта константа называется половиной постоянной Больцмана k/2, в системе СИ формула имеет вид:
E = n * (k/2) * T
Половинка - это чтобы другие уравнения было удобно записывать. Проще в этой формуле поделить пополам, чем делить пополам что-то в других формулах.
PS. Если нужно проверить правильность доказательства - посмотрите определение температуры и постоянной Больцмана в учебнике, доказательство зависит от определений, а корректность самих определений следует из равномерности распределения энергии по степеням свободы. Я не знаю, на каком уровне нужно провести док-во, если делать все по-честному, то нужно сначала распределение Максвелла изучить.
Date: 2016-02-19; view: 382; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |