
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Введение. Тема: окислительно восстановительные реакции
Реферат по химии
Тема: окислительно восстановительные реакции
Выполнила: ученица 12 а класса
Малютина Жанна
Содержание.
Введение
Классификация химических реакций
Классификация окислительно-восстановительных реакций
Окислительно-восстановительные реакции в неорганической химии
Окислительно-восстановительные реакции в органической химии
Электролиз
Окислительно-восстановительные реакции в природе, промышленности, жизни человека
Заключение
Введение
Актуальность: распространение окислительно- восстановительных реакций во всех сферах жизни человека, в природе, внутри организмов.
Объект: окислительно- восстановительные реакции.
Предмет: превращения веществ с точки зрения окисления- восстановления.
Цель:1)понять принцип превращения веществ;2)изучить роль окислительно- восстановительных реакций в природе, промышленности, жизни человека.
Задачи:1) исследовать теоретический материал по окислительно- восстановительным реакциям;2)применить полученные знания на практике.
Материалы и методы: реферативно-аналитический, научно- практический.
Новизна: раскрыть дальнейшие перспективы роли окислительно- восстановительных реакций.
Практическое применение: все сферы жизни человека.
Классификация химических реакций
Химические реакции- процессы, в результате которых из одних веществ образуются другие, отличающиеся от них по составу и строению. Классификация химических реакций многопланова (схема), в ее основу могут быть положены различные признаки.
По изменению степеней окисления химических элементов, образующих вещества, различеют окислительно- восстановительные реакции, и реакции, протекающие без изменения степеней окисления химических элементов.
Реакции, идущие с изменением степеней окисления элементов- окислительно- восстановительные реакции.
К ним относится множество реакций, в том числе все реакции замещения, а также те реакции разложения, в которых участвует хотя бы одно простое вещество. [8]
Пример ОВР в неорганической химии:
2KMnO4 + 16HCl= 2KCl + 2MnCl2 + 5Cl2↑ + 8H2O
Mn+7 +5e- → Mn+2 2 (восстановление)
2Cl-1 +2e- → Cl20 5 (окисление)
В органической химии ярким примером окислительно- восстановительных реакций может служить восстановление альдегидов в соответствующие спирты:
CH3-C-H=0 + H2 → CH3- CH2OH
С+1 +2e- → C-1 1 (восстановление)
H20 – 2e- → 2H+1 1 (окисление)
К реакциям, идущим без изменения степеней окисления химических элементов относятся все реакции ионного обмена, а также многие реакции соединения, например:
Многие реакции разложения:
2Fe(OH)3 → Fe2O3 + 3H2O
Реакции этерификации:
HCOOH + CH3OH → HCOOCH3 + H2O.
Классификация окислительно- восстановительных реакций
1 Окислительно-восстановительные реакции, при которых изменяют степень окисления атомы элементов, входящих в состав разных веществ.
Примером является горение спиртовки, применяемой в большинстве лабораторных работ:
C2H5OH + 3O2 → 2CO2 + 3H2O
C-1 – 5e-→ C+4 (окисление)
С-3 -7e- → C+4 (восстановление)
Это типичная реакция горения органических веществ(рис.1)
2 Окислительно-восстановительные реакции, при которых степень окисления изменяют атомы разных элементов одного и того же вещества.
Примерами могут служить многие процессы термической диссоциации. Так, в ходе термической диссоциации водяного пара:
2H2O = 2H2 + O2
2H+ +2e- → H20 (восстановление)
2O-2 -4e- → O20 (окисление)
Другим примером может служить реакция разложения нитрита аммония, применяемая в лабораторной практике для получения чистого азота:
NH4NO2 = N2 + 2H2O
2N-3 – 6e- → N20 (окисление)
2N+3 + 6e- → N20 (восстановление)
Диспропорционирования.
Так, при взаимодействии хлора с водой получается смесь соляной(HCl) и хлорноватистой(HClO) кислот:
Cl2 + H2O = HCl + HClO
Здесь и окисление, и восстановление претерпевает хлор:
Сl2 + H2O = 2HClO + 2H+ + 2e- (окисление)
Сl2 +2e- = 2Cl- (восстановление)
Окислительно-восстановительные реакции в неорганической химии
Опыт 1.
Если прикоснуться горящей спичкой к кучке оранжево-красных кристаллов дихромата аммония (NH4)2Cr2O7,произойдет нечто примечательное: начинается «извержение» маленького «вулкана». Из центра стремительно вылетают раскаленные докрасна частицы «пепла», размеры «вулкана» быстро увеличиваются. [1]
Дихромат аммония (NH4)2Cr2O7 содержит атомы азота в низшей степени окисления (III) и хрома- в высшей степени окисления (+VI). Между этими атомами при поджигании происходит внутримолекулярный обмен электронами:
(NH4)2Cr2O7
(NH4)2Cr2O7 = N2↑ + Cr2O3 +4H2O↑ +Q
2N-3 -6e- →N20 1 (окисление)
2Cr+6 + 6e-→2Cr+3 1 (восстановление)
Раскаленные частицы и зеленоватый «пепел» - это частицы оксида хрома Cr2O3 , выбрасываемые при разложении дихромата аммония газообразным азотом N2(рис.3, 4).
Опыт 2.
В старинных руководствах по химическому анализу рекомендуется использовать «раствор хамелеона» для определения в образцах неизвестного состава сульфита натрия Na2SO3, пероксида водорода H2O2 или щавелевой кислоты H2C2O4.[1]
«Раствор хамелеона» - это раствор перманганата калия KMnO4, который при химических реакциях в зависимости, в зависимости от среды, меняет свою окраску по-разному.
Вот так идет взаимодействие перманганата калия с различными веществами:
2KMnO4 + 10FeSO4 + 8H2SO4 = K2SO4 + 5Fe2(SO4)3 + 8H2O + 2MnSO4
Mn+7 +5e- → Mn+2 (восстановление) 2
2Fe+2 – 2e- → 2Fe+3 (окисление) 5
2KMnO4 + 3H2O2 = 2MnO2 +3O2↑ +2KOH +2H2O
Mn+3 +5e- → Mn+4 (восстановление) 2
2O-1 - 2e- → O20 (окисление) 5
2KMnO4 + Na2SO3 + 2KOH = 2K2MnO4 + Na2SO4 + H2O
Mn+7 +1e- → Mn+6 (восстановление) 2
S+4 -2e- → S+6 (окисление) 1
В ходе перечисленных реакций наблюдается обесцвечивание перманганата калия KMnO4 (рис.5).
Опыт 3.
В качестве примеров реакций, в которых пероксид водорода H2O2 служит окислителем, можно привести окисление иодида калия KI:
2KI + H2O2 = I2 + 2KOH
2I- -2e- → I2o (окисление) 1
2O-1 +2e- → 2O-2 (восстановление) 1
В результате реакции выделяется йод (рис.6)
Опыт 4.
Хроматы- соли не существующей в свободном состоянии хромовой кислоты H2CrO4, получаемой лишь в виде водных растворов с концентрацией не свыше 75%.
Соединения хрома меняют окраску в зависимости от среды.
Например, в кислой среде наблюдается изменение цвета из желтого в зеленый.[10]
K2Cr2O7 + 3Na2SO3 + 4H2SO4 → K2SO4 + 3Na2SO4 + Cr2(SO4)3 + 4H2O
2Cr+6 +6e- → 2Cr+3 (восстановление) 1
S+4 -2e-→ S+6 (окисление) 3
Сr2(SO4)3 + 10KOH + 3H2O2 = 2K2CrO4 + 3K2SO4 + 8H2O
2Cr+3 - 6e- → 2Cr+6 (окисление) 1
2O-1 +2e- → 2O-2 (восстановление) 3
Наблюдается переход цвета из зеленого в желтый (рис.7).
Опыт 4.
Ряд напряжений металлов дает возможность, не проводя опытов, заранее определить, какие металлы будут «вытеснять» друг друга из растворов солей (табл.1).
Если в голубой раствор сульфата меди(II) CuSO4 опустить железный гвоздь, предварительно очищенный наждачной бумагой, то вскоре он покроется красноватым слоем металлической меди. Раствор (теперь уже сульфата железа(II)) приобретет бледно- зеленую окраску.[2]
СuSO4 + Fe = FeSO4 + Cu↓
Сu+2 +2e- → Cu0 (восстановление) 1
Fe0 -2e- → Fe0 (окисление) 1
С кислотами реагируют почти все металлы. Водород служит эталоном для сравнения способности металлов взаимодействовать с кислотами-неокислителями. Это могут делать металлы, расположенные левее водорода в ряду напряжений: от K до свинца Pb.[7] Например:
2Al + 6HCl = 2AlCl3 + 3H2↑
Al0 -3e- → Al+3 (окисление)
2H+ +2e- → H20 (восстановление)
Концентрированная серная H2SO4 и азотная HNO3 кислоты реагируют с металлами по-разному, в зависимости от положения металла в ряде напряжений и концентрации кислоты (схема1).
химия альдегид диссоциация окислительный восстановительный
Окислительно-восстановительные реакции в органической химии
Опыт 1.
При добавлении к глюкозе раствора перманганата калия, подкисленного серной кислотой, происходит окисление глюкозы и обесцвечивание перманганата калия:
5С6H12O6 + 24KMnO4 + 36H2SO4 → 12CO2 +8Cr2(SO4)3 + 8K2SO4 + 43H2O
6C0 – 24e-→ 6C+4 (окисление) 5
Mn+7 +5e- → Mn+2 (восстановление) 24
C12H22O11 + 8K2Cr2O7 + 32H2SO4 → 12CO2↑ + 8Cr2(SO4)3 + 8K2SO4 + 43H2O
12C0 -48e- → 12C+4 (окисление) 1
2Cr+6 + 6e- →2Cr+3 (восстановление) 8
5С2H5OH + 4KMnO4 + 6H2SO4 → 5CH3COOH + 2K2SO4 + 4MnSO4 + 17H2O
С-1 -4e- → C+3 (окисление) 5
Mn+7 +5e-→ Mn+2 (восстановление) 4
Опыт 2.
При прокаливании медной проволоки (она чернеет) и опускании ее в раствор спирта, происходит окисление спирта до альдегида, и выделяется чистая медь(рис.8)
С2H5O + CuO → C2H5O2 + Cu
2С-1 -2e- → 2C+1 (окисление) 1
Сu+2 – 2e- → Cu0 (восстановление) 1
В организме человека, употребляющего алкогольные напитки, также происходит окисление спирта до альдегида, что наносит вред здоровью. Этаналь вызывает разрушение клеток мозга, человек ощущает головную боль.
В организме животных и человека запасается жир, при окислении которого выделяется энергия, необходимая для осуществления жизненно важных процессов:
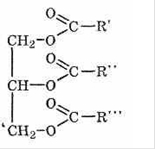
+ [O] → CO2 + H2O +Q
Опыт 3.
При пропускании аммиачного раствора оксида серебра через альдегид, на поверхности пробирки выделяется чистое серебро (рис.9):
Ag2O + 4 NH4OH => 2 [Ag(NH3)2]OH + Н2O
R-CH=O + 2 [Ag(NH3)2]OH => RCOONH4 + 2 Ag +3 NH3 + H2O
Эта реакция используется при изготовлении игрушек, посуды, украшений.
Окислительно-восстановительные реакции в органической химии сложны, интересны и играют огромную роль в промышленности, фармакологии, природе, жизни организмов и человека.
Химические источники электрической энергии
В конце XVIII в. Итальянский физиолог Луиджи Гальвани впервые заметил появление кратковременного электрического тока в мышцах лягушки, лапка которой находилась в соприкосновении с двумя различными металлами(медной проволочкой и железной сеткой).[6]
Впервые гальванический элемент создал итальянский физик Алессандро Вольта (1745-1827). Он же сконструировал батарею гальванических элементов в виде так называемого «вольтова столба». Для этого ученый последовательно соединил чередующиеся медные и цинковые кружки, между которыми находились суконные прокладки, пропитанные растворами кислоты или щелочи.
Широко известный медно цинковый гальванический элемент был создан в 1836 г. Английским исследователем Джоном-Фредериком Даниелем. Усовершенствовал его русский ученый Борис Семенович Якоби.[5]
Гальванический элемент- устройство, которое применяют для непосредственного преобразования энергии химической реакции в электрическую энергию.(рис.1, 2).
Действие любого гальванического элемента основано на протекании в нем окислительно-восстановительной реакции. В простейшем случае гальванический элемент состоит из двух пластин или стержней, изготовленных из различных металлов и погруженных в раствор электролита. Такая система делает возможным пространственное разделение окислительно- восстановительной реакции: окисление протекает на одном металле, а
восстановление- на другом. Таким образом, электроны передаются от восстановителя к окислителю по внешней цепи.
Например, медно- цинковый гальванический элемент(элемент Якоби- Даниеля) состоит из медной пластины, погруженной в раствор сульфата меди (медный электрод), и цинковой пластины, погруженной в раствор сульфата цинка(цинковый электрод). Оба раствора соприкасаются друг с другом, но для предупреждения смешения они разделены перегородкой, изготовленной из пористого материала.
При работе элемента, т.е. при замкнутой цепи, цинк окисляется: на поверхности его соприкосновения с раствором атомы цинка превращаются в ионы и, гидратируясь, переходят в раствор. Высвобождающиеся при этом электроны движутся по внешней цепи к медному электроду.
Zn= Zn2++ 2e-
На медном электроде протекает восстановление ионов меди. Электроны, приходящие сюда от цинкового электрода, соединяются с выходящими из раствора дегидратирующимися ионами меди; образуются атомы меди, выделяющиеся в виде металла.
Cu2+ + 2e- = Cu0
Электрод, на котором протекает окисление, называется анодом. Электрод, на котором протекает восстановление, называется катодом. В медно- цинковом элементе цинковый электрод является анодом, а медный- катодом.
На основе гальванического элемента протекает процесс электролиза. Электролиз- окислительно-восстановительная реакция, происходящая пр прохождении постоянного электрического тока через электромагнитную систему, состоящую из двух электродов и расплава или раствора электролита.
Схема электролиза раствора хлорида меди(II) c инертным анодом:
СuCl2
Катод ← Сu2+ 2Cl- → Анод
Cu2+ +2e- = Cu 2Сl-= 2Cl + 2e-
2Cl = Cl2
Схема электролиза раствора сульфата калия с инертным анодом:
2K2SO4
Катод ← 4K+ 2SO42- → Анод
4H2O + 4e- = 4K+ + 4OH- + 4H+ 2H2O = 2SO42- + 4H+ + 2O2- +4e-
4H = 2H2 2O2- = O2
Схема электролиза сульфата никеля с никелевым анодом:
NiSO4
Катод ← Ni2+ SO42- → Анод
Ni2+ + 2e- = Ni0 Ni0 = Ni2+ + SO42- + 2e-
Важнейшее применение электролиз находит в металлургической и химической промышленности, и в гальванотехнике. [4]
Окислительно- восстановительные реакции в природе, промышленности и жизни человека
Все процессы в живой природе сопровождаются превращением энергии и ее переходами из одной формы в другую. В течение одного дня взрослый человек потребляет примерно 10 млн. Дж энергии. Главный источник энергии - химические реакции: окисление жиров и углеводов, поступающих в человеческий организм с пищей. [9]
Синтез жиров и углеводов, которые есть в пище, тоже требует затрат энергии. Основной источник земной энергии – солнечный свет. Свет представляет собой один из мощных факторов воздействия на химические процессы. Достаточно вспомнить, что жизнь на Земле поддерживается
благодаря растениям, а растения осуществляют синтез органических веществ, используя энергию излучения Солнца. Фотосинтез(рис.10) - самый крупный из химических процессов на Земле. Энергия солнечного света при участии хлорофилла запасается в продуктах фотосинтеза именно в углеводах:
6CO2 + 6H2O → C6H12O6 + O2↑
Синтез углеводов протекает согласно циклу Кальвина (рис.11) и распадается с выделением энергии по циклу Кребса (рис.12)- это наиболее важные окислительно-восстановительные реакции в организмах, поддерживающие жизнь на нашей планете.
«Серебро» из глины.
Приоритет открытия алюминия Al, который одно время называли «серебром из глины», принадлежит датскому физику Гансу- Христиану Эрстеду(1777-1851), известному больше своими работами по электромагнетизму. Чтобы получить алюминий, Эрстед нагревал безводный хлорид алюминия с амальгамой натрия (раствором натрия в ртути):
AlCl3 + 3Na(Hg) = Al + 3NaCl3 + Hg
Продукты реакции он обработал водой для растворения хлорида натрия NaCl,а из остатка, содержащего амальгаму алюминия, удалил нагреванием ртуть. Так в 1825 г. Впервые был получен алюминий.
В 1827 г. Немецкому химику Вёлеру также удалось выделить алюминий, используя реакцию восстановления гексафторалюмината натрия металлическим калием:
Na3[AlF6] + 3K= Al + 3NaF + 3KF
Алюминий в этом случае легко отделяется от фторидов калия KFи натрия NaF, хорошо растворимых в воде.
В 1845 г. Два химика независимо друг от друга – немец Бунзен и француз Анри- Этьен Сент- Клер- Девилль (1818- 1881)- разработали первый промышленный метод получения алюминия, основанный на восстановлении тетрахлоралюмината натрия
Na[AlCl4] + 3Na= Al + 4NaCl.[1]
Нержавеющая железная колонна
Эта знаменитая Кутубская колонна высотой около семи метров и массой 6,5 т. Надпись на колонне говорит о том, что она была поставлена в 9 в. До н. э. Ржавление железа- образование метагидроксида железа FeO(OH)- связано со взаимодействием его с влагой и кислородом воздуха:
4Fe + 2H2O + 3O2= 4FeO(OH).
Однако эта реакция при отсутствии в железе различных примесей, и прежде всего углерода, кремния и серы, не протекает. Колонна была изготовлена из очень чистого материала: железа в колонне оказалось 99,72%. Этим и объясняется её долговечность и коррозионная устойчивость.[1]
Польза пероксида. Пероксид водорода H2O2, вернее, его водный 3%-й раствор, известен как крововосстанавливающее средство при травмах кожи. При лечении открытых травм H2O2 служит для обогащения крови больного кислородом O2 непосредственно возле поврежденного места тела:
2H2O2 = 2H2O + O2↑
2O-1 - 2e- → O20 (окисление) 1
2O-1 + 2e-→ 2O-2 (восстановление) 1
После хирургической обработки раны пациенту делают инъекции 0,01%-го водного раствора пероксида водорода, вводя его в артерии, снабжающие кровью орган или участок тела.[1]
Озонное старение каучуков, резин и пластмасс.
Скорость реакции озона с двойной связью С=С в 100 000 раз выше, чем скорость реакции озона с одинарной связью С-С. Поэтому от озона в первую очередь страдают каучуки и резины.
Озон реагирует с двойной связью с образованием промежуточного комплекса:
У комплекса есть две возможности:
1) Образовать молозонид:
2) При соударении с другой молекулой олефина (каучука) дать исходные продукты:
Основной путь предотвращения озонной деструкции и резин – поиск веществ, которые реагируют с озоном быстрее, чем озон реагирует с двойными связями каучуков и резин.Примеры реакций антиозонантов с озоном:
В технологической практике наибольший эффект достигается при применении антиозонантов в сочетании с восками (предельные углеводороды).
Заключение.
Изучение окислительно-восстановительных реакций является актуальной задачей в настоящее время. Они принадлежат к числу наиболее распространенных химических реакций и играют важную роль в природе и технике. Около 80% всех химических превращений происходит в живой и неживой природе в результате процессов окисления-восстановления. Проявление различных жизненных функций организма связано сзатратой энергии, которую наш организм получает из пищи в результате окислительно-восстановительных реакций.
Весь окружающий нас мир можно рассматривать как гигантскую химическую лабораторию, в которой ежесекундно протекают окислительно-восстановительные процессы. Это фотосинтез и круговорот веществ, гниение и брожение, нервная деятельность человека и животных.
Большинство химических процессов, осуществляемых человеком в его практической деятельности, представляют собой окислительно-восстановительные реакции. Их можно наблюдать при сгорании топлива в топках паровых котлов и двигателей внутреннего сгорания, в процессах коррозии металлов. Получение металлов и неметаллов, кислот, щелочей, строительных материалов, высокомолекулярных соединений, медикаментов и т.д. основано на использовании окислительно- восстановительных реакций
В последние годы разработаны электрохимические преобразователи информации и электрохимические устройства, в основе действия которых лежат законы электролиза. Широко используются в технике различные источники тока.
Окислительно-восстановительные процессы, протекающие в природе и технике, нередко наносят огромный ущерб. В качестве примеров можно привести коррозию металлов, лесные пожары, окисление азота при сжигании топлива, образование чрезвычайно токсичных диоксидов и т.д. При помощи окислительно- восстановительных реакций проводят анализ различных веществ, очищают многие вещества, природные и сточные воды, газовые выбросы электростанций и т.д. [11]
| <== предыдущая | | | следующая ==> |
| Количество критериев выбора | | | В семейно - бытовой сфере |
Date: 2015-05-23; view: 3749; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |