
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Равновесие химическое
Можно ли держать в одной колбе вместе основание и кислоту? Ответ на этот вопрос не так прост, как может показаться сразу: нельзя, потому что в результате начавшейся реакции сразу же образуются соль и вода. Но бывают случаи, когда свободное основание и свободная кислота могут мирно сосуществовать в одной колбе. Возьмем соль, например хлорид алюминия, и попытаемся растворить ее в воде. Конечно, произойдет гидролиз по уравнению:
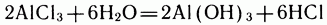
Но эта реакция обратимая:
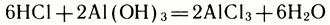
Сколько бы мы ни выдерживали смесь, как бы ее ни перемешивали — она остается мутноватой, будет содержать студенистый осадок амфотерного гидроксида алюминия, в данной системе выступающего как основание (см. Амфотерность). А значит, там же всегда будет находиться и какое-то количество соляной кислоты. Основание и кислота в одной колбе. Почему они могут сосуществовать? Потому что в той же колбе есть еще избыток воды и хлорид алюминия, способные реагировать друг с другом. Одновременно идут с одинаковой скоростью реакции (1) и (2). При этом в единицу времени образуется столько же новых веществ, сколько расходуется начальных соединений. Такое состояние системы называется химическим равновесием.
Смешаем в газовой фазе или в разбавленном растворе два вещества — А и В, которые могут реагировать друг с другом с образованием продуктов реакции С и D. Допустим, что это обратимая реакция; большинство химических реакций обратимые, т. е. при взаимодействии веществ С и D вновь образуются А и В:
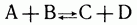
В самом начале реакции, когда веществ А и В много, а С и D еще мало, скорость прямой реакции  велика:
велика:
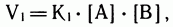
где  — константа скорости прямой реакции, а
— константа скорости прямой реакции, а 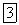 и
и  — концентрации исходных реагентов.
— концентрации исходных реагентов.
Через некоторое время часть молекул А и В прореагирует и концентрация их упадет; скорость прямой реакции уменьшится. В то же время возрастут концентрации продуктов реакции (С и D) и скорость взаимодействия между ними V2. Она определяется по аналогичной формуле:
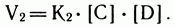
В какой-то момент скорости прямой и обратной реакций сравняются, установится динамическое равновесие, постоянное для данной системы при данных условиях. Вывести систему из равновесия можно, только меняя условия, по принципу Ле Шателье. Какими бы ни были исходные концентрации, равновесные концентрации реагентов и продуктов реакции строго связаны между собой законом действия масс, и их можно рассчитать, определив значение константы равновесия 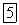
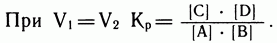
Определив константу равновесия в лабораторных опытах, нетрудно рассчитать состав равновесной смеси. Но и это еще не всё. Воздействуя на равновесную смесь тем или иным способом, например добавляя в нее один из исходных реагентов в избытке (на практике для этого чаще всего берут самый дешевый из них), можно смещать равновесие и получать больше самых нужных, или, как говорят химики, целевых, продуктов. Например, в реакции гидролиза хлорида алюминия:
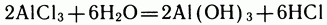
взвесь  можно удалить, предусмотрев в установке устройство для фильтрования жидкости. Удалив гидроксид алюминия из системы, мы тем самым ускорим гидролиз
можно удалить, предусмотрев в установке устройство для фильтрования жидкости. Удалив гидроксид алюминия из системы, мы тем самым ускорим гидролиз  . На практике иногда удается смещать равновесие реакций, связывая один из продуктов реакции в комплексное соединение. Так поступают, в частности, при умягчении воды с помощью комплексообразующих соединений.
. На практике иногда удается смещать равновесие реакций, связывая один из продуктов реакции в комплексное соединение. Так поступают, в частности, при умягчении воды с помощью комплексообразующих соединений.
Понятие о химическом равновесии объясняет и эмпирическое правило, гласящее, что реакция идет до конца, если один из ее продуктов выпадает в осадок или улетучивается в виде газа. Теперь мы знаем, что с осадком и газом часть вещества оказалась выведенной из реакции. Это повлияло на соотношение (концентрации) реагентов и сместило химическое равновесие. Все произошло в соответствии с положениями закона действия масс.
В отдельных случаях, когда проведение экспериментальных исследований затруднительно, константы равновесия химических реакций рассчитывают с помощью методов химической термодинамики.
При этом иногда удается определить не только состав реакционной смеси и выход продуктов реакции, но и способы увеличения выхода целевого продукта: давление, нагрев (подвод энергии извне) или, наоборот, быстрое охлаждение...
Катализаторы не влияют на положение равновесия. В равной мере ускоряя и прямую и обратную реакции, они помогают скорее достичь равновесия, но не сдвинуть его в какую-либо сторону.
Принцип Ле Шателье — Брауна (1884 г.) — если на систему, находящуюся в устойчивом равновесии, воздействовать извне, изменяя какое-либо из условий равновесия (температура, давление, концентрация, внешнее электромагнитное поле), то в системе усиливаются процессы, направленные на компенсацию внешнего воздействия.
Анри Ле Шателье (Франция) сформулировал этот термодинамический принцип подвижного равновесия, позже обобщённый Карлом Брауном[1].
Принцип применим к равновесию любой природы: механическому, тепловому, химическому, электрическому (эффект Ленца, явление Пельтье)[2].
Содержание
Влияние температуры
Влияние температуры зависит от знака теплового эффекта реакции. При повышении температуры химическое равновесие смещается в направлении эндотермической реакции, при понижении температуры — в направлении экзотермической реакции. В общем же случае при изменении температуры химическое равновесие смещается в сторону процесса, знак изменения энтропии в котором совпадает со знаком изменения температуры. Зависимость константы равновесия от температуры в конденсированных системах описывается уравнением изобары Вант-Гоффа:
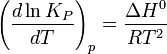
в системах с газовой фазой — уравнением изохоры Вант-Гоффа
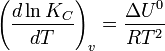
В небольшом диапазоне температур в конденсированных системах связь константы равновесия с температурой выражается следующим уравнением:
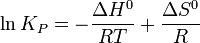
Например, в реакции синтеза аммиака
N2 + 3H2 ⇄ 2NH3 + Q
тепловой эффект в стандартных условиях составляет -92 кДж/моль, реакция экзотермическая, поэтому повышение температуры приводит к смещению равновесия в сторону исходных веществ и уменьшению выхода продукта.
Влияние давления
Давление существенно влияет на положение равновесия в реакциях с участием газообразных веществ, сопровождающихся изменением объёма за счёт изменения количества вещества при переходе от исходных веществ к продуктам:
При повышении давления равновесие сдвигается в направлении, в котором уменьшается суммарное количество молей газов и наоборот.
В реакции синтеза аммиака количество газов уменьшается вдвое: N2 + 3H2 ↔ 2NH3
Значит, при повышении давления равновесие смещается в сторону образования NH3, о чём свидетельствуют следующие данные для реакции синтеза аммиака при 400 °C:
| давление, МПа | 0,1 | |||||
| объемная доля NH3, % | 0,4 |
Влияние инертных газовВведение в реакционную смесь или образование в ходе реакции инертных газов действует так же, как и понижение давления, поскольку понижается парциальное давление реагирующих веществ. Следует отметить, что в данном случае в качестве инертного газа рассматривается газ, не участвующий в реакции. В системах с уменьшением количества молей газов инертные газы смещают равновесие в сторону исходных веществ, поэтому в производственных процессах, в которых могут образовываться или накапливаться инертные газы, требуется периодическая продувка газоводов.
Влияние концентрации
Влияние концентрации на состояние равновесия подчиняется следующим правилам:
- При повышении концентрации одного из исходных веществ равновесие сдвигается в направлении образования продуктов реакции;
- При повышении концентрации одного из продуктов реакции равновесие сдвигается в направлении образования исходных веществ.
12)Закон действующих масс
[править | править исходный текст]
Материал из Википедии — свободной энциклопедии
Зако́н де́йствующих масс устанавливает соотношение между массами реагирующих веществ в химических реакциях при равновесии, а также зависимость скорости химической реакции от концентрации исходных веществ.
Закон действующих масс в химической кинетике[править | править исходный текст]
Закон действующих масс в кинетической форме (основное уравнение кинетики) гласит, что скорость элементарной химической реакции пропорциональна произведению концентраций реагентов в степенях, равных стехиометрическим коэффициентам в уравнении реакции[1]. Это положение сформулировано в 1867 году норвежскими учёными К. Гульдбергом и П. Вааге. Для элементарной химической реакции:
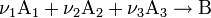
закон действующих масс может быть записан в виде кинетического уравнения вида:
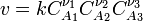
где 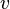 — скорость химической реакции,
— скорость химической реакции, 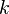 — константа скорости реакции.
— константа скорости реакции.
Для сложных реакций в общем виде это соотношение не выполняется. Тем не менее, многие сложные реакции условно можно рассматривать как ряд последовательных элементарных стадий с неустойчивыми промежуточными продуктами, формально эквивалентный переходу из начального состояния в конечное в «один шаг». Такие реакции называют формально простыми [2]. Для формально простых реакций кинетическое уравнение может быть получено в виде:
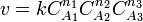
(для трех исходных веществ, аналогично приведённому выше уравнению). Здесь 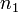 ,
, 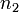 ,
, 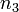 — порядок реакции по веществам
— порядок реакции по веществам 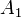 ,
, 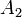 ,
, 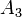 соответственно, а сумма
соответственно, а сумма 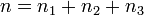 — общий (или суммарный) порядок реакции.
— общий (или суммарный) порядок реакции. 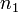 ,
, 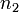 ,
, 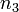 могут быть не равны стехиометрическим коэффициентам и не обязательно целочисленные.
могут быть не равны стехиометрическим коэффициентам и не обязательно целочисленные. 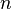 при определённых условиях может быть равно и нулю.
при определённых условиях может быть равно и нулю.
Закон действующих масс в химической термодинамике[править | править исходный текст]
В химической термодинамике закон действующих масс связывает между собой равновесные активности исходных веществ и продуктов реакции, согласно соотношению:
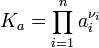
где
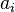 — активность веществ. Вместо активности могут быть использованы концентрация (для реакции в идеальном растворе), парциальные давления (реакция в смеси идеальных газов), фугитивность (реакция в смеси реальных газов);
— активность веществ. Вместо активности могут быть использованы концентрация (для реакции в идеальном растворе), парциальные давления (реакция в смеси идеальных газов), фугитивность (реакция в смеси реальных газов);
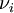 — стехиометрический коэффициент (для исходных веществ принимается отрицательным, для продуктов — положительным);
— стехиометрический коэффициент (для исходных веществ принимается отрицательным, для продуктов — положительным);
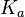 — константа химического равновесия. Индекс «a» здесь означает использование величины активности в формуле.
— константа химического равновесия. Индекс «a» здесь означает использование величины активности в формуле.
На практике в расчётах, не требующих особой точности, значения активности обычно заменяются на соответствующие значения концентраций (для реакций в растворах) либо парциальных давлений (для реакций между газами). Константу равновесия при этом обозначают 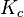 или
или 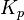 соответственно. Впервые закон действующих масс был выведен из кинетических представлений Гульдбергом и Вааге, а термодинамический вывод его дан Вант-Гоффом в 1885 году[3].
соответственно. Впервые закон действующих масс был выведен из кинетических представлений Гульдбергом и Вааге, а термодинамический вывод его дан Вант-Гоффом в 1885 году[3].
Пример: для стандартной реакции
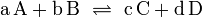
константа химического равновесия определяется по формуле
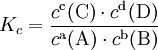
Date: 2015-05-22; view: 867; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |