
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Лечение системной склеродермии
Р.Т. Алекперов
Учреждение Российской академии медицинских наук Научно-исследовательский институт ревматологии РАМН, Москва
Системная склеродермия (ССД) – хроническое аутоиммунное заболевание соединительной ткани с гетерогенной клинической картиной [1]. Распространенность ССД в США составляет около 240 случаев на 1 млн населения; а среди больных преобладают женщины (соотношение женщин и мужчин – 5:1) [2]. Характерные клинические проявления заболевания отражают основные составляющие патогенеза ССД: аутоиммунные нарушения и воспаление, активация/повреждение сосудистого эндотелия и фиброз кожи и внутренних органов [3]. При ССД эндотелиальная активация сопровождается воспалительными изменениями и фиброзом, ведущим к прогрессирующей обструктивной васкулопатии и, в итоге, к выраженной дисфункции и повреждению внутренних органов [4, 5]. Патогенез болезни определяет основные принципы лечения, но выбор терапии зависит также от клинической формы, течения и стадии болезни.
Классификация
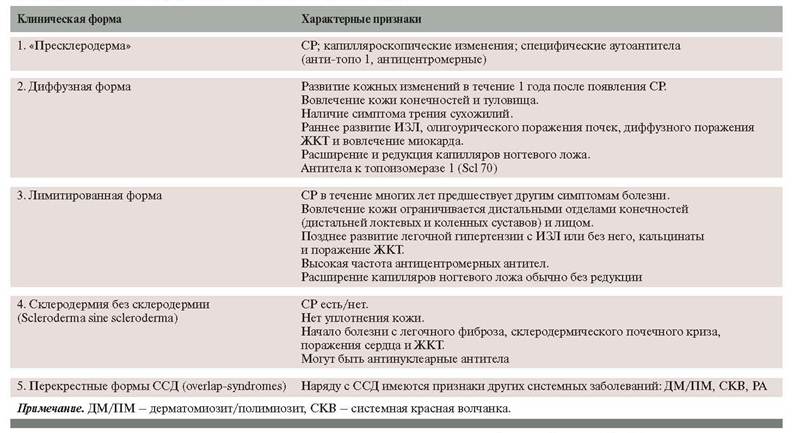
В основе классификации ССД лежат распространенность поражения кожи и ассоциированные типы висцеральной патологии (табл. 1) [6].
Обычно уже в течение первого года болезни можно определить тип поражения кожи. Диффузное поражение кожи, как правило, сопровождается прогрессирующим течением с ранним и выраженным вовлечением в процесс внутренних органов (обычно в течение первых 5 лет болезни) и конституциональными проявлениями. Для лимитированной формы ССД, наоборот, характерно медленное прогрессирование с поздним развитием висцеральных поражений. В некоторых случаях, при очевидных признаках специфических для ССД поражений, уплотнение кожи отсутствует – так называемая склеродермия без склеродермы. Отдельно выделяют перекрестные формы – случаи, когда наряду с проявлениями ССД отмечаются признаки других системных ревматических заболеваний, таких как системная красная волчанка, дерматомиозит/полимиозит или ревматоидный артрит (РА).
Лечение любого заболевания направлено на повышение выживаемости больных и улучшение качества жизни. Сегодня выживаемость при ССД остается самой низкой среди всех системных заболеваний соединительной ткани, а средняя длительность жизни составляет всего 11 лет после начала болезни [2]. Это обстоятельство делает необходимыми совершенствование традиционного лечения и разработку новых его методов. Исходя из патогенеза ССД, основными целями терапевтического воздействия являются сосудистый эндотелий (вазоактивная терапия), иммунная система (иммуносупрессия) и фибробласты (антифиброзная терапия). Характер и успех лечения во многом определяются клинической формой, течением болезни и выраженностью висцеральных поражений. В представленном обзоре приводится характеристика методов лечения и препаратов, эффективность которых доказана в контролируемых исследованиях или подтверждена серией клинических наблюдений.
Вазоактивная терапия
Нарушения регуляции сосудистого тонуса приводят к развитию таких осложнений, как дигитальные ишемические язвы, легочная артериальная гипертензия (АГ), гломерулярная дисфункция, острая склеродермическая почка, ишемия и фиброз миокарда, дисфункция желудочно-кишечного тракта (ЖКТ). В целях компенсации микроциркуляторного дефицита и уменьшения негативного воздействия повторных атак синдрома Рейно (СР), способствующих реперфузионному поражению тканей, обязательным компонентом лечения ССД являются вазодилататоры и антиагреганты.
Среди вазодилататоров препаратом выбора остаются блокаторы потенциал-зависимых медленных кальциевых каналов (кальциевые блокаторы), в первую очередь производные дигидропиридина. Эффективность кальциевых блокаторов в лечении СР, ассоциированного с ССД, продемонстрирована в нескольких рандомизированных клинических исследованиях [7]. Нифедипин является наиболее изученным при ССД производным дигидропиридина. В этих исследованиях было показано, что применение нифедипина в дозе 30–60 мг/сут значительно снижает частоту и выраженность эпизодов вазоспазма, а в некоторых случаях и его продолжительность [8]. Показано, что нифедипин в небольших дозах сублингвально за 15–30 мин эффективно предупреждает вазоспазм, индуцированный холодовым воздействием. Только в одной работе оценивали влияние нифедипина на заживление дигитальных язв, количество которых значительно уменьшилось после 16 нед лечения [9]. По сравнению с плацебо в ответ на охлаждение сублингвальный прием нифедипина достоверно повышал кожный кровоток в пальцах и мышечный кровоток в предплечье [10]. Этот эффект, однако, не был подтвержден при длительном применении препарата. Частое развитие побочных эффектов (от 20 до 35%) существенно ограничивает применение нифедипина. Использование ретардных форм препарата позволяет несколько снизить частоту и выраженность побочных эффектов. Однако в опубликованном метаанализе эффект кальциевых блокаторов в отношении снижения выраженности и частоты ишемических атак оценен в лучшем случае как умеренный; необходимо проведение крупных контролируемых исследований [7]. Важной является необходимость использования высоких доз (360 мг дилтиазема или 60 мг нифедипина в день), которые, однако, не всегда хорошо переносятся. При этом у некоторых больных на фоне такой терапии отмечается улучшение, что дает основание для ее применения.
В двойном слепом плацебоконтролируемом исследовании амлодипин (производное дигидропиридина) достоверно снижал частоту и выраженность вазоспастических атак, а также существенно нивелировал изменение пальцевого кровотока, связанное с постишемической реактивной гиперемией [11]. Недостатком препарата является развитие отека лодыжек приблизительно у 50% больных. Еще одним производным дигидропиридина, эффективно снижающим частоту и выраженность вазоспастических эпизодов, является исрадипин [12]. Исрадипин уменьшает уровень циркулирующего эндотелина 1, что объясняется улучшением тканевой перфузии. Собственный опыт применения исрадипина у больных ССД позволяет нам указать на хорошую переносимость и равноценную эффективность препарата при сравнении с нифедипином.
Таблица 1. Классификация системной склеродермии
Для лечения склеродермической ангиопатии применяли также ингибиторы ангиотензинпревращающего фермента (АПФ) и блокаторы рецепторов 1-го типа ангиотензина II (АТI). В рандомизированном контролируемом исследовании (РКИ), включавшем 86 больных с первичным и вторичным СР, было показано улучшение при лечении каптоприлом [13]. Ингибиторы АПФ значительно улучшили исход почечного криза, тогда как данные о профилактическом действии этих препаратов в отношении почечного криза противоречивы из-за снижения почечного кровотока под их влиянием. Интерес к ингибиторам АПФ появился после того, как была показана эффективность лозартана у больных с первичным СР. В сравнительном исследовании лозартан уменьшал частоту ишемических атак в большей степени, чем нифедипин, однако эти различия не были достоверными [14].
Пациентам с недостаточным ответом на традиционные вазодилататоры назначали аналоги простагландинов. Многие авторы описывают клиническое применение илопроста – стабильного аналога простациклина (простагландин I2). Установлена его вариабельная активность при СР, ассоциированном с ССД. Илопрост является мощным вазодилататором и ингибитором агрегации тромбоцитов. В 1998 г. в Кохрановском обзоре сообщалось об эффективности внутривенного введения илопроста при СР, вторичном по отношению к ССД. Отмечено снижение частоты и выраженности атак, а также ускорение заживления дигитальных язв [15]. В крупном РКИ было установлено, что инфузии илопроста короткими курсами уменьшают частоту и выраженность атак СР при ССД, однако не выявлено различий в заживлении дигитальных язв в группах больных [16]. Снижение частоты и выраженности атак СР при лечении илопростом выявлено также в двух других исследованиях [17, 18]. В небольшом исследовании [19], также включавшем больных ССД, назначение илопроста не влияло на выраженность или частоту СР, но ассоциировалось с улучшением заживления язв. Снижение частоты, выраженности и длительности атак СР наблюдалось при применении как высоких, так и низких доз илопроста [20]. Во время инфузий илопроста отмечалась высокая частота побочных реакций, включая головную боль, покраснение лица, тошноту, боль в челюсти, диарею, рвоту, реакцию в месте иньекции и миалгию, уменьшение которых возможно при лечении прерывистыми курсами [19, 21]. Другим представителем простагландинов с вазодилатирующим действием является алпростадил (простагландин Е1). В небольшом открытом исследовании ежедневная инфузия алпростадила в течение 6 дней ассоциировалось со снижением частоты и выраженности атак СР у больных ССД [22]. Однако в двойном слепом плацебоконтролируемом исследовании, включавшем больных с первичным или вторичным СР, ассоциированным с ССД, алпростадил оказался не более эффективным, чем плацебо [23].
В НИИР РАМН для лечения выраженного СР и язвенно-некротических поражений у больных ССД с успехом применяется вазапростан. В проспективном исследовании эффективности внутривенных инфузий препарата у 52 больных ССД показаны более выраженное снижение интенсивности СР и ускорение заживления дигитальных язв по сравнению с нифедипином. Алпростадил оказывает вазодилатационное действие и, кроме того, подавляет агрегационный потенциал тромбоцитов. Терапевтический эффект сохраняется в течение 4–9 мес. Алпростадил противопоказан больным с клинически манифестной или латентной сердечнососудистой патологией.
В нескольких исследованиях как альтернатива простагландинам у пациентов с выраженным СР, у которых не отмечалось положительного ответа на другие виды лечения, оценивали эффект антагонистов рецепторов эндотелина. Рецепторы эндотелина типа А (ETA), выявленные главным образом в гладкомышечных клетках сосудов, опосредуют вазоконстрикцию и клеточную пролиферацию. Рецепторы эндотелина типа В определяются в основном на эндотелиальных клетках и вызывают вазодилатацию посредством оксида азота. Первый представитель этой группы препаратов – бозентан – действует как неселективный антагонист рецепторов эндотелина 1. В Великобритании и Ирландии бозентан одобрен для профилактики дигитальных язв при ССД или язв другого генеза. Эти рекомендации основаны на результатах двух исследований. В рандомизированном двойном слепом плацебоконтролируемом исследовании, включавшем 122 больных ССД, изучали роль бозентана в предупреждении дигитальных язв. У больных, принимавших бозентан, отмечалось снижение частоты новых дигитальных язв в среднем на 48% по сравнению с плацебо, но язвы появлялись у одинакового процента больных в каждой группе, и бозентан, как казалось, не препятствовал и не тормозил образование первой дигитальной язвы. Не выявлено различий между группами больных в заживлении существующих язв [24]. В другом похожем исследовании, включавшем 188 больных ССД, сравнивали способность бозентана и плацебо предупреждать и заживлять дигитальные язвы. Общее число новых язв в течение 24 нед наблюдения достоверно различалось и составило 1,9 в группе бозентана и 2,7 в группе плацебо [25]. В одном исследовании отмечено улучшение поток-зависимой вазодилатации при лечении бозентаном больных ССД, но при этом не оценивали частоту или выраженность СР или дигитальных язв [26].
Описано заживление дигитальных язв после лечения бозентаном у больных ССД, у которых лечение блокаторами кальциевых каналов и силденафилом было неэффективным. Заживление язв отмечалось у 65% больных через 8—26 нед (в среднем 25 нед) лечения [27]. В то же время в одном из описаний серии случаев не наблюдалось улучшения течения СР, микроциркуляторного кровотока, систолического АД в пальцевой артерии [28]. Побочные эффекты бозентана включают серьезное поражение печени и тератогенное действие. В США бозентан разрешен FDA только для лечения легочной артериальной гипертензии (АГ) и доступен только через ограниченную сеть дистрибьюторов.
Относительно недавно для лечения поражений сосудов при ССД стали применять ингибиторы фосфодиэстеразы 5-го типа (ФДЭ 5). Эти препараты повышают содержание циклического гуанозин монофосфата (цГМФ) и оказывают отличное от простациклина и антагонистов рецепторов эндотелина действие на сосудистый тонус [29]. В рандомизированном двойном слепом исследовании сравнивали физиологические эффекты силденафила и альфа-токоферола у 15 больных с СР. Под влиянием силденафила наблюдалось повышение базального кожного кровотока в предплечье и плазменного уровня цГМФ. Альфа-токоферол не влиял на эти показатели [30]. В пилотном исследовании изучали клинические и гемодинамические эффекты варденафила у 40 больных с первичным и вторичным СР. Лазер-допплер-флоуметрия выявила у этих больных повышение пальцевого кровотока на 70%. Наблюдалось клиническое улучшение в виде уменьшения длительности, частоты и выраженности атак СР [31].
В двойном слепом исследовании изучали эффект силденафила в лечении СР, резистентного к другим вазодилататорам [32]. Это исследование включало 16 больных с вторичным СР, критериями включения были частые болезненные атаки СР и резистентность к терапии как минимум двумя вазодилататорами. До включения в исследования кальциевые блокаторы получали 94% больных, нитроглицерин – 39%, пентоксифиллин – 28%, ингибиторы АПФ – 22%, внутривенно простагландины – 17% и бозентан – 6%. Все вазодилататоры были отменены при включении в исследование. Под влиянием силденафила отмечались увеличение средней скорости капиллярного кровотока, а также значительное уменьшение частоты и длительности атак СР. У всех больных с хроническими дигитальными язвами произошло их заживление, у 2 пациентов язвы снова появились после отмены силденафила. Эффективность другого ингибитора ФДЭ 5 – тадалафила – изучали в двойном слепом РКИ, включавшем 25 больных с вторичным СР. Отмечены уменьшение частоты и длительности атак СР, а также заживление всех имевшихся и меньшая частота появления новых дигитальных язв по сравнению с плацебо [33].
Как показали длительные наблюдения большого числа больных, комбинация вазоактивных препаратов и антиагрегантов приводит к взаимному усилению их действия. Такое сочетание дает возможность применения минимально эффективной дозы каждого из этих препаратов и тем самым позволяет уменьшить частоту и выраженность побочных эффектов. Наиболее удобным и безопасным для длительного применения препаратом антиагрегантного действия является пентоксифиллин в адекватной суточной дозе 600–1200 мг. Исследование эффективности дипиридамола в двойном слепом плацебоконтролируемом исследовании не выявило его отличий от плацебо [34].
Антифиброзная терапия
Повышение растворимости коллагена дермы после лечения Д-пеницилламином, первоначально выявленное при болезни Вильсона и РА, явилось основанием для применения препарата как антифиброзного средства при ССД [35]. Проведенные вскоре после внедрения Д-пеницилламина в клиническую практику открытые исследования показали хорошие результаты и подтвердили целесообразность включения препарата в комплексную медикаментозную терапию ССД. В одном из первых ретроспективных исследований V.D. Steen и соавт. [36] установили, что у больных ранней диффузной ССД, которые принимали Д-пеницилламин в суточной дозе 500–1500 мг, выраженность и распространенность уплотнения кожи уменьшились в достоверно большей степени, чем у больных, которые не получали препарат. S.A. Jimenez и S.H. Sigal [37] в 15-летнем проспективном исследовании наблюдали 69 больных быстро прогрессирующей ССД с длительностью болезни <18 мес, которые получали Дпеницилламин в суточной дозе 750 мг в течение 6 мес и более. В результате лечения у 97% больных прекратилось прогрессирование болезни, отмечались дальнейшее смягчение, повышение эластичности кожи, восстановление потоотделения и волосяного покрова. У этих больных площадь фиброзно измененной кожи уменьшилась с 64,6±23,1 до 15,7±13,2% поверхности тела. Кроме того, у больных, принимавших Д-пеницилламин >6 мес, не отмечено поражения почек и прогрессирования интерстициального фиброза легких. В этом исследовании только 9 (13%) больных не завершили 6 мес лечения из-за развития побочных эффектов препарата. В 36-месячном проспективном исследовании M.A. Sattar и соавт. [38] наблюдали уменьшение степени и распространенности уплотнения кожи у всех больных диффузной ССД, которые принимали Д-пеницилламин в относительно небольших дозах. Авторы пришли к заключению, что длительное лечение Д-пеницилламином в малых дозах не только эффективно, но и не вызывает побочных эффектов.
Помимо воздействия на кожу, внимание исследователей привлекает влияние Д-пеницилламина на динамику висцеральных поражений при ССД. L.S. De Clerck и соавт. [39] в многолетнем исследовании анализировали изменения функции легких у больных ССД в 2 группах: у принимавших и у не принимавших Д-пеницилламин. По результатам исследования последнее значение диффузионной способности легких уменьшилось более чем на 10% только у 18% пациентов, принимавших Д-пеницилламин, и у 50% больных в группе сравнения. В аналогичном исследовании V.D. Steen и соавт. [40] наблюдали повышение диффузионной способности легких с 76 до 87% в группе больных, принимавших Д-пеницилламин, тогда как в контрольной группе изменение этого показателя было незначительным – с 73 до 76%. S. Jacobsen и соавт. [41] показали, что прогрессирующее снижение диффузионной способности легких у больных ССД ассоциируется с отсутствием предшествующего лечения Д-пеницилламином. В исследовании, посвященном выявлению предикторов острой склеродермической почки (ОСП), было установлено, что терапия Д-пеницилламином предотвращает развитие почечного криза [42].
Значительный резонанс вызвали результаты двойного слепого контролируемого исследования высокой и низкой дозы Д-пеницилламина у больных ранней диффузной ССД [43]. В конце 2-годичного исследования не выявлено различий между 2 группами больных в распространенности или выраженности уплотнения кожи, частоте почечного криза и смертности. Эти результаты вызвали возражение многих исследователей. В частности, в другом исследовании больные ССД, которые соответствовали тем же критериям отбора и наблюдались в течение такого же времени, имели значительно лучший исход [44]. К концу 2-го года средний кожный счет у больных, которые получали Д-пеницилламин, улучшился почти на 50% (по сравнению с 25% в контроле). В настоящее время показанием к применению Д-пепицилламина является ранняя стадия (первые 2–5 лет) диффузной формы ССД.
Прием Д-пеницилламина может сопровождаться развитием побочных эффектов, включая гематологические нарушения и различные аутоиммунные состояния, такие как пузырчатка, нефротический синдром, миастения. Эти побочные эффекты хорошо известны и не требуют специального обсуждения. Напомним, что побочные эффекты Д-пеницилламина развиваются преимущественно в первые полгода лечения и именно в этот период требуется тщательный мониторинг клеточного состава крови и протеинурии. В последние годы появились сообщения о развитии ассоциированного с антинейтрофильными цитоплазматическими антителами поражения почек и легких, индуцированного Дпеницилламином. Возможность подобного осложнения следует подозревать в случаях прогрессирующей нормотензивной почечной недостаточности или гемофтиза у больных, принимающих Д-пеницилламин. Побочные эффекты в большинстве случаев обратимы, и угроза их развития не может быть причиной отказа от лечения Д-пеницилламином у больных ранней диффузной ССД.
Терапия, избирательно блокирующая фиброзообразование, считается наиболее многообещающим подходом к лечению ССД. В последние годы описано несколько потенциальных молекулярных мишеней, включая трансформирующий фактор роста (ТФР), фактор роста соединительной ткани, тромбоцитарный фактор роста, деацетилазы гистонов, Rho-ассоциированные киназы, воздействие на которые может оказать антифиброзное действие [45].
ТФР является плейотропным цитокином, играющим важную роль в клеточной пролиферации и дифференциации, иммунном ответе, ангиогенезе и заживлении тканей [46, 47]. Отмечается повышенный интерес к исследованию препаратов, блокирующих ТФР, которые применяются для лечения неаутоиммунных заболеваний. Однако первые попытки блокады ТФР с помощью гуманизированных моноклональных антител (Cat192) у больных ССД с интерстициальными заболеваниями легких (ИЗЛ) оказались безуспешными [48]. Кроме того, у больных часто отмечались побочные эффекты.
Экспериментальные исследования на мышиной модели ССД показали, что развитие фиброза могут предотвратить ингибиторы тирозинкиназы [49]. Появились первые сообщения о применении иматиниба мезилата в виде монотерапии или в комбинации с циклофосфаном у больных ССД [50–52]. Однако делать какие-либо заключения преждевременно.
Иммуносупрессивная терапия
В отличие от других ревматических заболеваний эффективность иммуносупрессии при ССД остается предметом дискуссий. Иммуносупрессия не может считаться таргетной терапией при ССД вследствие неселективности и отсутствия убедительных доказательств ее эффективности. В то же время иммуносупрессивные препараты часто применяются при лечении ССД [53, 54]. F.H.J. van den Hoogen и соавт. [55] оценивали эффективность метотрексата в плацебоконтролируемом исследовании. После 48 нед терапии в группе метотрексата по сравнению с исходными результатами наблюдалось улучшение по ВАШ и силы сжатия кистей. Другие параметры, характеризующие состояние внутренних органов, оставались без изменений. Сделано заключение, что у больных активной ССД низкая доза метотрексата более эффективна, чем плацебо. В то же время в группе метотрексата 1 больная выбыла из исследования на 10-й неделе из-за почечного криза с исходом в хроническую почечную недостаточность, а в период между 24-й и 48-й неделями 2 больных умерли на фоне приема 25 мг метотрексата: одна из-за прогрессирующего фиброза легких, другая – внезапно, вероятно, вследствие инфаркта миокарда. В другом двойном слепом плацебоконтролируемом исследовании авторы не нашли четких доказательств эффективности метотрексата у больных ранней диффузной ССД [56]. Как следует из анализируемых работ, вопрос об эффективности метотрексата при ССД остается открытым. По-видимому, требуется унификация применяемых критериев, так как до сих пор нет единого мнения о клинически значимом изменении основного критерия оценки – кожного счета. На сегодняшний день применение метотрексата можно считать обоснованным при сочетании ССД с РА или полимиозитом, т. е. в тех случаях, когда эффективность метотрексата доказана.
В нескольких открытых исследованиях изучалась эффективность циклофосфана. ИЗЛ – основное показание для иммуносупрессивной терапии при ССД, в этих случаях традиционно назначают циклофосфан [57]. B. White и соавт. [58] наблюдали улучшение или стабилизацию функции легких у больных с альвеолитом при лечении циклофосфаном. Метаанализ рандомизированных и открытых клинических исследований показал, что применение циклофосфана в течение 12 мес ассоциируется с умеренным улучшением легочных функциональных тестов, которое нивелируется после отмены препарата [59]. Предпочтение отдается парентеральному введению препарата, так как при ежедневном приеме его внутрь часто развиваются побочные эффекты. Несмотря на токсичность циклофосфана, EULAR рекомендует его как препарат выбора для лечения ИЗЛ при ССД [60].
Добавление глюкокортикоидов (ГК) может повысить умеренный эффект монотерапии циклофосфаном. Метаанализ, проведенный C. Nannini и соавт. [61], показал, что наибольший эффект достигался в тех исследованиях, в которых одновременно с циклофосфаном применяли ГК [62, 63].
Результаты некоторых ретроспективных исследований указывают на повышение риска почечного склеродермического криза при добавлении ГК к лечению циклофосфаном.
В настоящее время как возможная альтернатива циклофосфану исследуется микофенолата мофетил при ИЗЛ у больных ССД, предварительные результаты обнадеживают. К настоящему времени проведены четыре неконтролируемых исследования микофенолата мофетила, в которых был получен эффект, сопоставимый с таковым циклофосфана, при этом без значительных побочных явлений при длительности лечения до 2 лет [64–67].
Сегодня в лечении различных ревматических заболеваний возрастает роль биологических агентов. Эти относительные новые препараты применяются при все большем числе аутоиммунных заболеваний, включая ССД.
Свойства потенциального эффективного средства для лечения ССД выявлены у ритуксимаба. В открытом исследовании, включавшем 8 больных, наблюдалось значительное уменьшение уплотнения кожи и гистологических показателей после 24 нед лечения [68]. Однако в другом исследовании, включавшем 15 больных ССД, не отмечено положительное влияние на изменения кожи и уменьшение уровня специфических аутоантител [69].
Циклоспорин оценивали в начале 90-х годов в нескольких небольших открытых исследованиях, в которых наблюдалось уменьшение уплотнения кожи [70]. Однако частым осложнением лечения являются АГ и индуцированный циклоспорином острый почечный криз, что делает целесообразность такой терапии проблематичной [71].
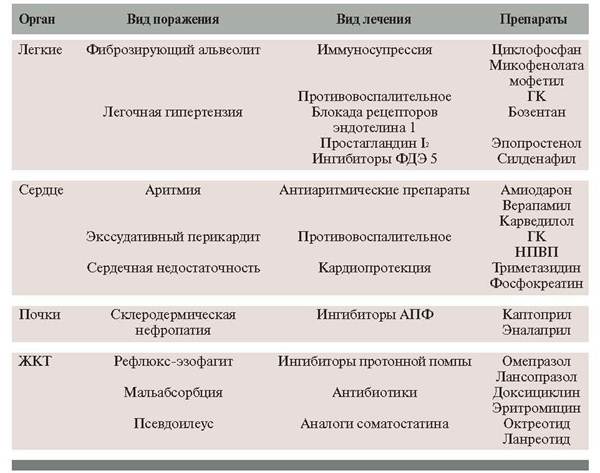
Таблица 2. Лечение висцеральных поражений при ССД
/////////**********//////////////
| Системная склеродермия |
Яндекс.Директ
 Ускоренный курс английскогоЗаговорить на английском языке просто! Пройди наш онлайн курс прямо сейчас!english.metland.meПермь Ускоренный курс английскогоЗаговорить на английском языке просто! Пройди наш онлайн курс прямо сейчас!english.metland.meПермь
|
| Неотложные состояния в терапии - Ревматические и системные заболевания | |
Системная склеродермия (ССД) — диффузное заболевание соединительной ткани, проявляющееся прогрессирующим фиброзом кожи, внутренних органов, сосудистой патологией по типу облитерирующего эндартериолита с распространенными вазо-спастическими нарушениями.
Классификация системной склеродермии (Н. Г. Гусева, 1975)
1.Характер течения:
· 1.1. Острое.
· 1.2. Подострое.
· 1.3. Хроническое.
2.Клинические формы:
2.1. Типичная, с характерным поражением кожи.
2.2. Атипичная, с очаговым поражением кожи:
· 2.2.1. Преимущественно висцеральная.
· 2.2.2. Преимущественно суставная.
· 2.2.3. Преимущественно мышечная.
· 2.2.4. Преимущественно сосудистая.
3.Стадии развития:
· 3.1. Начальная.
· 3.2. Генерализованная.
· 3.3. Терминальная.
4.Степень активности:
· 4.1. Минимальная (I).
· 4.2. Умеренная (II).
· 4.3. Высокая (III).
5. Клинико-морфологическая характеристика поражений:
· 5.1. Кожа и периферические сосуды — «плотный отек», индурация, атрофия, гиперпигментация, телеангиэктазии, синдром Рейно, очаговое поражение.
· 5.2. Локомоторный аппарат — артралгия, полиартрит (экссудативный или фиброзно-индуративный), полимиозит, кальциноз, остеолиз.
· 5.3. Сердце — миокардоз, кардиосклероз, порок сердца (чаще недостаточность митрального клапана).
· 5.4. Легкие — интерстициальная пневмония, пневмосклероз (компактный или кистозный), адгезивный плеврит.
· 5.5. Пищеварительный тракт — эзофагит, дуоденит, колит.
· 5.6. Почки — истинная склеродермическая почка, гломерулонефрит. 5.7. Нервная система — полиневрит, вегетативные сдвиги, нейропсихические расстройства.
Этиологияне выяснена. Предполагается вирусное и наследственное происхождение заболевания. Провоцирующие факторы — охлаждение, вибрация, травма, контакт с некоторыми химическими веществами, нейроэндокринные нарушения, аллергизация.
Патогенез системной склеродермии включает изменения обмена соединительной ткани (увеличение биосинтеза коллагена и неофибриллогенеза), иммунные нарушения (снижение уровня Т-супрессоров при нормальном содержании В-лимфоцитов в крови, появление антител к коллагену, иногда антинуклеарных антител) и поражение микроциркуляторного русла (цитотоксические лимфоциты повреждают эндотелий, что сопровождается адгезией и агрегацией тромбоцитов, активацией коагуляции, высвобождением медиаторов воспаления, увеличением проницаемости сосудистой стенки с плазматическим ее пропитыванием и отложением фибрина).
Клинические симптомы системной склеродермии
Острое течение — быстрое (уже в течение года) развитие диффузной симптоматики, неуклонное прогрессирование поражения внутренних органов, нарастающий фиброз органов и тканей, развитие склеродермической почки. При подостром течении имеет место развернутая клиника заболевания с поражением кожи, суставов, мышц, внутренних органов на фоне нерезко выраженных вазомоторных трофических нарушений. Хроническое течение — выраженные сосудистые и трофические нарушения (синдром Рейно), уплотнение кожи, периарти-кулярной ткани с образованием контрактур, остеолизом, медленно развивающиеся поражения пищевода, легких, сердца. Типичные изменения кожи могут носить очаговый (локальный) характер и долго оставаться единственным проявлением болезни.
Начальная (1) стадия склеродермии проявляется синдромом Рейно, артралгией, тахикардией, частыми инфекциями дыхательных путей, зябкостью. Комплексное лечение в этой стадии приводит к длительной ремиссии и даже выздоровлению.
Генерализованная (II) стадия протекает со всеми ранее приведенными симптомами, развернутой картиной болезни.
Терминальная (III) стадия — стадия далеко зашедших изменений сопровождается выраженной потерей массы тела и недостаточностью функций одного или нескольких органов. Лечение в этой стадии не дает эффекта.
Степени активности скл ер одер м и и: минимальная (I) степень— вазоспастические и трофические нарушения, СОЭ менее 20 мм/ч; умеренная (II) степень — артралгии, артриты, адгезивный плеврит, кардиосклероз, СОЭ в пределах 20— 35 мм/ч, высокая (III) степень — лихорадка, полиартрит, мио-кардоз, нефропатия, СОЭ более 35 мм/ч.
Яндекс.Директ
Диагностические признаки системной склеродермии (Н. Г. Гусева, 1975) Основные (большие) критерии 1. Склеродермическое поражение кожи, проходящее последовательно стадии «плотного» отека, индурации и атрофии с преимущественной локализацией на лице (маскообразность) и з области кистей (склеродактилия), возможно тотальное поражение. Обычно кожный синдром сочетается с пигментацией. 2. Синдром Рейно. 3. Суставно-мышечный синдром с развитием стойких контрактур, в основе которого — ревматоидноподобный артрит, периартикулярные изменения и фиброзирующий миозит. 4. Остеолиз ногтевых, а иногда средних и основных фаланг пальцев рук, реже — ног, что проявляется укорочением и деформацией пальцев. 5. Синдром Тибьержа — Вейссенбаха — отложение солей кальция преимущественно в области пальцев рук и периартикулярно — вокруг локтевых, плечевых и тазобедренных суставов, в подкожной клетчатке, иногда по ходу фасций и сухожилий мышц. 6. Поражение пищеварительного тракта (склеродермический эзофагит с дисфагией, дилатация пищевода, гастрит, дуоденит, нарушение моторики кишечника вплоть до кишечной непроходимости, развитие синдрома мальабсорбции). 7. Поражение сердца по типу первичного крупноочагового кардиосклероза. 8. Поражение легких по типу базального пнев-москлероза, кистозного легкого (на рентгенограмме — медовые соты). 9. Истинная склеродермическая почка, диагностируется клинически на основании внезапного повышения артериального давления и развития острой почечной недостаточности. Дополнительные (малые) критерии 1. Периферические: гиперпигментация кожи, телеангиэкта-зии, трофические нарушения, синдром Шегрена, полиартралгии, полимиалгии, полимиозит. 2. Висцеральные: лимфаденопатия, полисерозит (чаще адгезивный), диффузный и очаговый нефрит, полиневрит, поражение ЦНС. 3. Общие: потеря массы (более 10 кг), лихорадка (чаще субфебрильная). 4. Лабораторные: увеличение СОЭ (более 20 мм/ч), гиперпротеинемия (более 85 г/л), гипергаммаглобулинемия (более 23 %), антитела к ДНК или АНФ, РФ, увеличение уровня оксипролина плазмы и мочи. Наличия любых 3 основных критериев или одного из основных, если им является склеродермическое поражение кожи, остеолиз ногтевых фаланг или характерное поражение пищеварительного тракта, в сочетании с 3 и более вспомогательными критериями достаточно для достоверного диагноза ССД. При меньшем числе симптомов ставят лишь «вероятный» диагноз. Диагностические критерии системной склеродермии Американской ревматологической ассоциации (1980) «Большой» критерий: склеродермическое поражение кожи туловища (проксимальная склеродермия). «Малые» критерии: склеродактилия, рубцы на подушечках пальцев, симметричный базальный пневмосклероз. Диагноз ССД достоверен при наличии одного «большого» и двух «малых» критериев. |
Date: 2015-05-22; view: 1052; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |