
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Ионный обмен
Ионообменная очистка применяется для извлечения из сточных вод металлов (цинка, меди, хрома, никеля, свинца, ртути, кадмия, ванадия, марганца и др.), а также соединений мышьяка, фосфора, цианистых соединений и радиоактивных веществ. Метод позволяет рекуперировать ценные вещества при высокой степени очистки воды. Ионный обмен широко распространен при обессоливании в процессе водоподготовки.
Сущность ионного обмена. Ионный обмен представляет собой процесс взаимодействия раствора с твердой фазой, обладающей свойствами обменивать ионы, содержащиеся в ней, на другие ионы, присутствующие в растворе. Вещества, составляющие эту твердую фазу, носят название ионитов. Они практически не растворимы в воде. Те из них, которые способны поглощать из растворов электролитов положительные ионы, называются катионитами, отрицательные ионы—анионитами. Первые обладают кислотными свойствами, вторые—основными. Если иониты обменивают и катионы, и анионы, их называют амфотерными.
Поглотительная способность ионитов характеризуется обменной емкостью, которая определяется числом эквивалентов ионов, поглощаемых единицей массы или объема ионита. Различают полную, статическую и динамическую обменные емкости. Полная емкость—это количество поглощаемого вещества при полном насыщении единицы объема или массы ионита. Статическая емкость—это обменная емкость ионита при равновесии в данных рабочих условиях. Статическая обменная емкость обычно меньше полной. Динамическая обменная емкость—это емкость ионита до “проскока” ионов в фильтрат, определяемая в условиях фильтрации. Динамическая емкость меньше статической.
Природные и синтетические иониты. Иониты (катиониты и аниониты) бывают неорганические (минеральные) и органические. Это могут быть природные вещества или вещества, полученные искусственно.
К неорганическим природным ионитам относятся цеолиты, глинистые минералы, полевые шпаты, различные слюды и др. Катионообменные свойства их обусловлены содержанием алюмосиликатов типа Nа20•Аl203•nSiO2•mН20. Ионообменными свойствами обладает также фторапатит [Са5(Р04)3]F и гидросидапатит [Са5(Р04)3]ОН. К неорганическим синтетическим ионитам относятся силикагели, пермутиты, труднорастворимые оксиды и гидроксиды некоторых металлов (алюминия, хрома, циркония и др.). Катионообменные свойства, например, силикагеля, обусловлены обменом ионов водорода гидрооксидных групп на катионы металлов, проявляющиеся в щелочной среде. Катионообменными свойствами обладают и пермутиты, получаемые сплавлением соединений, содержащих алюминий и кремний.
Органические природные иониты—это гуминовые кислоты почв и углей. Они проявляют слабокислотные свойства. Для усиления кислотных свойств и обменной емкости угли измельчают и сульфируют в избытке олеума. Сульфоугли являются дешевыми полиэлектролитами, содержащими сильно- и слабо - кислотные группы. К недостаткам таких ионитов следует отнести их малые химическую стойкость и механическую прочность зерен, а также небольшую обменную емкость, особенно в нейтральных средах.
К органическим искусственным ионитам относятся ионообменные смолы с развитой поверхностью. Они-то и приобрели наибольшее практическое значение для очистки сточных вод. Синтетические ионообменные смолы представляют собой высокомолекулярные соединения, углеводородные радикалы которых образуют пространственную сетку с фиксированными на ней ионообменными функциональными группами. Пространственная углеводородная сетка (каркас) называется матрицей, а обменивающиеся ионы—противоионами. Каждый противоион соединен с противоположно заряженными ионами, называемыми фиксированными, или анкерными. Полимерные углеводородные цепи, являющиеся основой матрицы, связаны (сшиты) между собой поперечными связями, что придает прочность каркасу.
При сокращенном написании ионита матрицу обозначают в общем виде (К), а активную группу указывают полностью. Например, сульфокатиониты записывают как RSОзН. Здесь К—матрица, Н—противоион, SOз—анкерный ион. Иониты получают методом сополимеризации или сополиконденсации с последующим сшиванием образующихся цепей. В конденсационных ионитах сшивание — образование поперечных связей — осуществляется за счет метиленовых (—СН2—) или метиловых (=СН—) мостиков, а также азотсодержащих группировок, в полимеризационных—чаще всего при помощи п-ди-винилбензола и его изомеров. Число таких поперечных связей определяет размер ячеек сетки и жесткость матрицы.
В зависимости от степени диссоциации Катионообменные смолы бывают
сильно- и слабокислотные, а анионообменные — сильно - и слабоосновные К сильнокислотным относят катиониты, содержащие сульфогруппы (S03Н) или фосфорнокислые группы [РО(ОН)2]. К слабокислотным—карбоксильные (СООН) и фенольные (С6Н5ОН) группы. Сильноосновные иониты содержат четвертичные аммониевые основания (R3NОН), слабоосновные—аминогруппы различной степени замещения (—NН2, =NН; =N).
Иониты, содержащие одинаковые активные группы, называются монофункциональными, а иониты, которые содержат функциональные группы различной химической природы,—полифункциональными. Они могут обладать смешанными сильно и слабоосновными свойствами.
Катиониты в качестве противоионов могут содержать не ионы водорода, а ионы металлов, т. е. находиться в солевой форме. Точно также и аниониты могут находиться в солевой форме, если в качестве противоионов они содержат не ионы гидрооксида, а ионы тех или иных кислот.
При нагревании ионитов в воде и на воздухе возможно разрушение их зерен, отщепление активных групп, что приводит к уменьшению емкости. Для каждой смолы имеется температурный предел, выше которого ее использовать нельзя. В общем случае термическая устойчивость анионитов ниже, чем катионитов.
Величина рН сточной воды, при которой происходит обмен ионами, зависит от константы диссоциации ионообменных групп смолы. Сильнокислотные катиониты позволяют проводить процесс в любых средах, а слабокислотные—в щелочных и нейтральных. Так, катиониты с карбоксильными группами обмениваются ионами при рН>7, а с фенольными группами при рН>8.
Иониты в контакте с водой не растворяются, но поглощают некоторое количество воды и набухают, являясь гелями с ограниченной набухаемостью. При набухании ионитов размер микропор возрастает от 0,5—1,0 нм (5—10 А) до 4 нм (40 А), а размер микропор составляет 70—130 нм (700—1300 А). При этом объем ионитов увеличивается в 1,5—3 раза. Степень набухания зависит от строения смолы, природы противоионов, от состава раствора. Набухание влияет на скорость и полноту обмена ионов, а также на селективность ионита. Оно прекращается после того, как разность осмотических давлений до и после обмена уравновесится упругими силами растяжения и сжатия ионита.
Сильно набухающие смолы, называемые гелеобразными, имеют удельную обменную поверхность 0,1—0,2 м2/г. Макропористые иониты обладают развитой обменной поверхностью, равной 60—80 м2/г. Синтетические иониты набухают в воде больше и имеют большую обменную емкость, чем природные. Срок службы синтетических катионитов значительно больше, чем анионитов. Это объясняется низкой стабильностью групп, которые в анионитах выполняют роль фиксированных ионов.
Селективность обмена зависит от величины давления набухания в порах смолы и от размера пор ионита. При малом размере пор большие ионы не могут достичь внутренних активных групп. В целях повышения селективности ионитов к определенным металлам в состав смолы вводят вещества, способные образовывать с ионами этих металлов внутрикомплексные соединения (хелаты). Установлены ряды ионов по энергии их вытеснения из сильно и слабокислотных катионов. Например, для сильнокислого сульфокатиона КУ-2 получен следующий ряд H+<Na+<NH4+<Zn2+<Co2+<Cu2+<Cd2+<Ni2+<Ca2+<Sr2+<Pb2+<Ba2+. Для слабокислотного катионита КБ-4: Mg2+<Ca2+<Ni2+<Co2+<Cu2+.
Иониты выпускают в виде порошка (размер частиц 0,04—0,07 мм), зерен (0,3—2,0 мм), волокнистого материала, листов и плиток. Крупнозернистые иониты предназначены для работы в фильтрах со слоями значительной высоты (1—3 м), порошкообразные—со слоями высотой 3—10 мм. Размер частиц ионита влияет на перепад давления в фильтрах: с уменьшением размера частиц перепад давления в слое увеличивается. Исходя из этого, измельчение ионитов в процессе очистки нежелательно. Это приводит не только к росту сопротивления фильтра, но и к неравномерному распределению скоростей потока сточной воды по сечению фильтра.
В результате столкновения зерен ионита друг с другом, а также ударов о стенки аппаратуры происходит истирание ионитов. Механически прочными принято считать иониты, степень истираемости которых не превышает 0,5%. Иониты должны быть также химически и термически стойкими. Химическая стойкость оценивается по изменению полной обменной емкости и изменению массы ионита.
Ряд смол, выпускаемых в СССР, имеет произвольное назначение (Н, НО, ВС). Некоторые названия отражают состав смол: СДВ—стиролдивинилбензол; ЭДЭ—этилендиаминэтиленхлоргидрин; МСФ—моносульфат и др. В последнее время в маркировке смол для катионитов употребляют букву К, для обозначения анионитов — А. Буква В—(после А) записывается для высокоосновных анионитов, буква Н — для низкоосновных анионитов. Числовое обозначение указывает порядковый номер производственной серии. Например, КУ—катионит универсальный; КФ—катионит фосфорнокислый; АВ — анионит высокоосновный: АН — анионит низкоосновной.
Смолы зарубежных стран часто имеют названия фирм изготовителей.
Отечественная промышленность выпускает ряд катионитов и анионитов (табл. 11,9 и 11,10). Ниже приведены некоторые марки ионитов и их зарубежных аналогов:
| Отечественные иониты | Зарубежные аналоги |
| КУ-2-8 КУ-23 КБ-2, КБ-2-4 КБ-2-7П, КБ-2-10П КБ-4, КБ-4П-2 АВ-17-8 АВ-29-12П АН-22-8 КУ-1 ЭДЭ-10П АН-2ФН | Амберлит IR-120, дауэкс-50, диайон, SK-1A, зеролит 225, имак C-12, леватит S-100, вофатит KRS-200, варион KS, дуолайт C-20, алласьон СS, кастель C-300Р, катекс-5 Леватит SP-120, кастель С-300Р, амберлит 15А. варион KSM Варион KSM, вофатит СР, дуолайт СС-3, йонайк С-270, пермутит H-70, пермутит С Варион КSМ, дуолайт С-464, имак 2-5 Амберлит IRА-50, варион СР, зеролит 226, цео-карб 226 Амберлит IRА-400, дауэкс-1, зеролит FF, дуолит А-101D, кастель А-500, диайон SА-10А, вофатит SBW, леватит М-500, варион АТ-660 Дуолайт А-162, варион AMD, диайон РА-404, леватит МР-600, амберлит А-29, амберлит IRA-910, релит 2АS Варион AED Амберлит IRA-100, йонайк С-200, вофатит К Дуолайт А-30, кастель А-100, вофатит L-150, вофатит L-160, вофатит L-165 Амберлит IR-4В |
Таблица II.9. Характеристика основных масок катионитов. выпускаемых в СССР для нужд водоподготовки
| Катионит Смола | Основа Матрицы | Смеши- вающий агент | Функци- ональная Группа | Ионная форма | Кислот- ность | Полная обменная емкость СОЕ | Насыпная плотность т/ м3 | Влаж- ность % | Макс. рабочая темпера- тура, С0 | Зерне- ние мм. | |||||
| Марка | Тип | екв/т | екв/м3 | ||||||||||||
| КУ-2 | Полиме- Ризаци- Онная | Полисти- Рол | Дивинил бензол, 8— 10% | S0зН | Н+, Na+ | Сильно- Кисло- тный — 5100 | 4700 - | 0,7-0,9 | 50-60 | 120- | 0,3-1,5 | ||||
| КУ-2-8 | То же | То же | То же | S0зН | Н+, Na+ | То же | 0,7-0,9 | 50-60 | 120- | 0,3-1,5 | |||||
| КУ-2-12П | Полиме- Ризаци- Онная ма- Кропори- Стая | >> | >> | S0зН | Н+, Na+ | >> | - | - | - | 0,5-1,5 | |||||
| КУ-1 | Конденса- Ционная | Фенолофо- Рмальдегид | - | S0зН | Н+ | >> | 0,6-0,75 | 30,50 | 0,3-2,0 | ||||||
| КФ-1 | Полиме- Ризирова- Нная | Полистирол | - | PO(OH)2 | Na+ | Средне- Кисло- Тный (рК=3,5 рК=7) | 0,7 | - | - | - | |||||
| КФ-2 | То же | То же | - | CH2[PO- (OH)]2 | Na+ | То же | 0,7 | - | - | - | |||||
| КБ-1 | >> | Метакри- Ловая ки- Слота | - | COOH | Na+ | Слабо- Кисло- Тный | 0,55-0,6 | - | 0,3-1,5 | ||||||
| КБ-4 | >> | То же | Дивинил- Бензол 10% | COOH | Na+ | То Же | 0,55-0,6 | 150-180 | 0,3-0,2 | ||||||
| КБ-4-10П | Полиме- Ризацио- Нная ма- Кропори- Стая | >> | То же | COOH | Na+ | >> | - | 0,62-0,68 | - | 0,25- 1,0 | |||||
Основы процесса ионного обмена. Реакция ионного обмена протекает следующим образом:
при контакте с катионитом
 (11.81)
(11.81)
при контакте с анионитом
 (11.82)
(11.82)
Ионный обмен происходит в эквивалентных отношениях и в большинстве случаев является эбратиш-гм. Реакции ионного обмена протекают вследствие разности химических потенциалов обменивающихся ионов. В общем виде эти реакции можно представить следующим образом:
 (11.83)
(11.83)
Реакция идет до установления ионообменного равновесия. Скорость установления равновесия зависит от внешних и внутренних факторов: гидродинамического режима жидкости; концентрации обменивающихся ионов, структуры зерен ионита, его
проницаемости для ионов. Имеются разные точки зрения на механизм ионного обмена.
Процесс переноса вещества может быть представлен в виде нескольких стадий: 1) перенос ионов А из ядра потока жидкости к внешней поверхности пограничной жидкой пленки, окружающей зерно ионита; 2) диффузия ионов через пограничный слой; 3) переход иона через границу раздела фаз в зерно смолы; 4) диффузия ионов А внутри зерна смолы к ионообменным функциональным группам; 5) собственно химическая реакция двойного обмена ионов Л и В; 6) диффузия ионов В внутри зерна ионита к границе раздела фаз; 7) переход ионов В через границу раздела фаз на внутреннюю поверхность пленки жидкости; 8) диффузия ионов В через пленку; 9) диффузия ионов В в ядро потока жидкости.
Скорость ионного обмена определяется самой медленной из этих стадий — диффузией в пленке жидкости либо диффузией в зерне ионита. Химическая реакция ионного обмена происходит быстро и не определяет суммарную скорость процесса.
Ионообменное равновесие. Функциональную зависимость противоионного состава ионита от противоионного состава внешнего
Таблица 11.10 Характеристика основнах марок анионитов, выускаемых в СССР для нужд водоподготовки.
| Анионит | Основа матрицы | Сшиваю- щий агент | Функци- ональная Группа | Основно- Сть | Полная Обменная Емкость | Насыпная Плотно- Сть т/м3 | Вла- Жно- Сть, % | Зер- Не- Ние, мм | |||
| марка | тип | экв/т | Екв/м3 | Исхо Дного | Набу- Хшего | ||||||
| АВ-17 (АВ-17Х8) | Полимери- Зационный | Полистирол | Дивинил- Бензол,8% | R3N+ | Сильно- Основный | 3800-4500 | 1300- | 0.66-0.74 | 0.33-0.35 | 40-65 | 0.4- 1.2 |
| ЭДЭ-10Д | То Же | Эпоксипо- Лнамин | - | RNH,R2N R3N+,(10- 20%) | Промежу- Точно ос- Новный | 9000- | - | 0.6-0.72 | - | 10-15 | 0.4- 1.8 |
| АВ-16 | >> | - | - | RNH,R2N R3N+ | То же | 9800- | 0.68-0.82 | - | 0.3- 1.8 | ||
| АН-22 | >> | Полистирол | Дивинил- Бензол | NH2,RNH | Слабоос- Новный рК=3-4 | 2100- | 0.6-0.8 | 0.36 | 40-60 | 0.25- 1.0 | |
| АН-31 | Конденса- Ционный | Полиэти- Ленполи- Амин | Эпихлор- Гидрин | RNH,R2N | рК=3-3,5 | 9000- | 4050- | 0.66 | 0.45 | 0.3- 2.0 | |
| АН-2Ф | То же | То же | - | RNH,R2N | Слабоос- Новный | 9000- | 0.7-0.9 | - | 0.3- 2.0 |
раствора при постоянных температуре и давлении называют изотермой ионного обмена. Изотермы изображаются графически в безразмерных координатах a i — аi:
 (11.84)
(11.84)
где a i и ai — эквивалентные доли i-го иона соответственно в фазе ионита и в растворе; ci и ci — концентрация (i-го иона в ионите и растворе в условиях равновесия системы, моль ионов на 1 г ионита; zi — заряд i-го иона.
Величины a i и ai изменяются в интервале от 0 до 1, следовательно изотермы обмена a i =f( ai ) изображаются в квадрате, сторона которого равна единице.
Отношение a i/ai называют коэффициентом распределения i -го иона при сорбции Кpi. Этот коэффициент является мерой обогащения или обеднения ионита данным веществом. При Кpi <1 ионит обеднен, а при Кpi >1обогащен компонентом i по сравнению с равновесным раствором.
Если в растворе содержится не один, а несколько ионов, например Л и В, то селективность ионита оценивается коэффициентом селективности (избирательности) Кa,в, равным отношению коэффициентов распределения конкурирующих ионов:
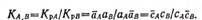 (11.85)
(11.85)
При Кa,в>1 ионит селективен к иону А; при Кa,в <1 избирательно сорбируется ион В; при Кa,в= 1 ионит не проявляет селективности ни к одному из ионов.
Если обменная реакция описывается в общем виде уравнением (11.83), то равновесие ионообменных процессов можно выразить следующей формулой:
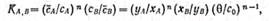 (11.86)
(11.86)
где Кa,в— константа равновесия; с—концентрация ионов в твердой фазе:
с —концентрация ионов в жидкой фазе; х=c/c0— безразмерная концентрация в жидкой фазе; у=c/0— безразмерная концентрация в твердой фазе; c0 — общая «эквивалентная» концентрация ионов в жидкости; 0 — обменная емкость смолы (значение 0 находится в пределах m и 1).
Форма изотермы зависит от величины Ка,в: при ка,в>1 изотерма выпуклая, при Ка,в<1— вогнутая, а при Ка,в =1—линейна и совпадают с диагональю.
При концентрации вещества в сточных водах менее 0,003 моль/л, или, точнее, при Вi<<1, скорость обмена определяется диффузией ионов через пленку жидкости (пленочная кинетика). При концентрации 0,1 моль/л (или Вi>>1) скорость процесса определяется диффузией ионов внутри зерна (гелевая кинетика). В области концентраций 0,003—0,1 моль/л определяющими являются оба вида диффузии. Здесь Вi=brо/(КrD) число Био; b—коэффициент массоотдачи; rо—радиус зерна
иона; Кг— константа Генри; D—коэффициент массопроводности.
Коэффициенты диффузии различных ионов в смоле имеют порядок 10-6—10-9 см2/с, а в воде 10-4—10-5 см2/с. Коэффициент диффузии снижается при увеличении размера гидратированных ионов в растворе и росте заряда обменивающихся противоионов смолы.
Для внешнедиффузионной области при значениях числа ReЭ ют 2 до 30 для расчета коэффициента массоотдачи может быть использована следующая зависимость:
 (11.87)
(11.87)
где NuЭ==bdЭ/D—число Нуссельта;, ReЭ=wdЭ/v—число Рейнольдса; РгD=v/D — число Прандтля.
Регенерация ионитов. Катиониты регенерируют 2—8%-ми растворами кислот. При этом они переходят в Н-форму. Регенерационные растворы—элюаты содержат катионы. Затем после взрыхления и промывки катиониты заряжаются, например в Na-форму, путем пропускания через них раствора поваренной соли. Тогда Н-функциональные группы, получающиеся при регенерации катионита кислотой, заменяются на Na-группу, а используемый для зарядки раствор поваренной соли подкисляется до соляной кислоты.
Отработанные аниониты регенерируют 2—6%-ми растворами щелочи. Аниониты при этом переходят в ОН-форму.
Элюаты содержат в сконцентрированном виде все извлеченные из сточных вод анионы. При необходимости регенерируемый анионит из ОН-формы можно перевести в Cl-форму, пропуская раствор NaCl. В отработанном заряжающем растворе накапли вается едкий натр. Элюаты, представляющие собой растворы кислот и щелочей, нейтрализуют или обрабатывают с целью рекуперации ценных продуктов. Нейтрализацию проводят смешением кислых и щелочных элюатов, а также дополнительным введением кислоты или щелочи.
Степень регенерации (в %) определяют по формуле
 (11.88)
(11.88)
:где qв—восстановленная обменная емкость; qп—полная обменная емкость.
На степень регенерации влияет тип ионита, состав насыщенного слоя, природа, концентрация и расход регенерирующего вещества, температура, время контакта и расход реагентов.
Схемы ионообменных установок. Процессы ионообменной очистки сточных вод проводят на установках периодического и непрерывного действия. Первые состоят из аппаратов (фильтров или колонн) периодического действия, насосов, емкостей и контрольно-измерительных приборов.

Рис. 11-31. Схемы ионообменных установок периодического действия:
•а — с проточной регенерацией: б—с оборотом части регенерата: а — с фракционирова нием регенерата; г — с «плавающим» фильтром; 1 — фильтры; 2 — эжектор; 3 — емкости для регенерата; 4 — емкости для промывных вод
Схемы установок с одним аппаратом приведены на рис. 11-31. Они отличаются системой регенерации ионита. По схеме в регенерирующий раствор готовят непрерывно при подаче в эжектор воды и концентрированного раствора кислоты или щелочи. Подачу кислоты или щелочи прекращают после пропускания через ионит заданного объема регенерационного раствора. Однако подачу воды продолжают для отмывки ионита от регенерационного раствора. Элюат и промывные воды после нейтрализации сбрасывают в канализацию.
По схеме б регенерирующий раствор готовится в специальной емкости. В этом случае достигается сокращение расхода регенерирующего агента и объема регенератора, так как регенерационный раствор готовят путем добавления к первой порции промывной воды концентрированного реагента. В результате часть реагента находится в обороте.



Рис. 11-32. Схемы ионообменных установок
а —периодического действия: 1— кол 2 - 3 — слой ионита; 4—6— распределитель нерирующим раствором; 8 — насос; б—с намывным фильтром: 1—корпус, 2- щий элемент; 3— емкость для приготовления..;ионита: 4 — насос; 5— сборник отработанного воздуха; в— с движущимся слоем смолы: 1—корпус; 2—разделительная зона; 3 — слой смолы; 4— тарелка; 5- лифт
Наименьший расход реагентов достигается в схеме с фракционированием регенерата (схема в). Регенерат разделяют на отдельные фракции и собирают в емкости. Первую фракцию, более концентрированную, направляют на переработку. Промывную воду собирают также в две емкости. При следующей регенерации в качестве первой фракции регенерационного раствора используют вторую фракцию от предыдущей регенерации, доукрепленную до заданной концентрации реагентом.
В схеме г с «плавающим» фильтром получают более концентрированные регенераты. Очищаемую воду последовательно пропускают через два фильтра. При начале проскока во втором фильтре подключают отрегенерированный третий фильтр, а первый по ходу воды выводят на регенерацию и т.д. Регенерацию отработанного фильтра можно производить по описанным выше вариантам.
Режим работы периодической установки (рис. 11-32, а) сводится к следующему. Сточная вода поступает внутрь аппарата, проходит слой ионита и выходит через распределитель. Далее подают промывную воду, а затем регенерирующий раствор. Таким образом, цикл работы аппарата состоит из следующих стадий: 1) ионообмен; 2) отмывка ионита от механических примесей; 3) регенерация ионита; 4) отмывка ионита от регенерирующего раствора.
Работа установки может быть интенсифицирована путем использования аппаратов с кипящим слоем ионита. Скорость процесса в этом случае увеличивается в 2—3 раза. Взвешенный слой имеет меньшее гидравлическое сопротивление.
Для глубокой финишной доочистки воды присоединяют установки со смешанным слоем анионитов и катионитов. В них иониты используют однократно или с внутренней или выносной регенерацией. Схема установки с намывным фильтром показана на рис. 11-32,6. Приготовленную в емкости суспензию ионита в воде насосом направляют на циркуляцию через фильтр до тех пор пока на фильтрующих элементах не образуется плотный слой ионитов толщиной 5—10 мм. После этого подают на очистку сточную воду. Отработанный ионит удаляют из фильтра воздухом на регенерацию. После намывки нового слоя ионита цикл повторяют. Такие установки целесообразно использовать при очень малом содержании солей в сточной воде.
Недостатки установок периодического действия: большие объемы аппаратов, значительный расход реагентов, большая единовременная загрузка сорбента, сложность автоматизации процесса. Непрерывный ионообмен дает возможность уменьшить затраты смолы, реагентов для регенерации, промывной воды, а также применять более компактное оборудование по сравнению с периодическим ионообменником. Колонны непрерывного действия могут работать как с движущимся слоем смолы, так и с кипящим слоем. Установки непрерывного действия содержат несколько ионообменных аппаратов с катионитом и анионитом.
Ионообменный аппарат должен удовлетворять следующим требованиям: иметь необходимый рабочий объем; обеспечивать определенный гидродинамический режим движения взаимодействующих фаз; требуемый уровень насыщения ионообменной смолы, небольшое гидравлическое сопротивление; капитальные и эксплуатационные затраты должны быть минимально возможными.
Аппараты для ионного обмена классифицируются по разным признакам:1) по организации процесса—на аппараты непрерывного, полунепрерывного и периодического действия; 2) по гидродинамическому режиму—на аппараты вытеснения, смешения и промежуточного типа; 3) по состоянию слоя ионита с неподвижным, движущимся, пульсирующим, перемешиваемым и циркулирующим слоем; 4) по организации контакта взаимодействующих фаз—с непрерывным и ступенчатым контактом фаз; 5) по организации взаимного направления движения фаз—на прямоточные, противоточные и со смешанным током; 6) по конструкции—на колонные и емкостные; 7) по способу подвода энергии—без подвода энергии извне (с гравитационным движением твердой фазы) и с подводом энергии извне (принудительное движение твердой фазы).
Ниже приведены схемы некоторых аппаратов. Схема колонны с движущимся слоем смолы показана на рис. 11-32, в. Сточную воду подают снизу, а смолу сверху. Колонна имеет сравнительно небольшую удельную производительность—1—5 м3/м2ч), малоэффективна из-за сильного перемешивания фаз и неравномерного распределения смолы по сечению колонны.

Рис. 11-33.
Колонны для ионообменной очистки: а—с тарелками провального типа: 1 — корпус; 2 — разделительная зона; 3—тарелки; 4— эрлифт; б — регенерационная пневмопульсационная: 1—колонна; 2—решетка; 3—труба; 4— распределитель раствора
Для увеличения эффективности процесса используют колонну с псевдосжиженным слоем или пульсацией. Колонна с тарелками провального типа (рис. 11-33, о) имеет удельную производительность 30—45 м3/(м2*ч). Тарелки с лопатками расположены под углом 30°. Лопатхи двух соседних тарелок направлены в разные стороны. Это обеспечивает спиральное противоточное движение сорбента и раствора.
Для регенерации смолы используют колонны с движущимся слоем, или
:пневмопульсационные (рис. 11-33,6). Сорбент подают через коническую трубу. При подаче воздуха смола в рабочем объеме аппарата движется навстречу раствору и удаляется сверху; столб смолы в трубе действует как обратный клапан. Можно проводить процесс регенерации при малой разности плотностей раствора и сорбента.
Примеры ионообменной очистки. Извлечение ионов металлов зависит от концентрации их в воде, рН, общей минерализации воды, а также от наличия и концентрации ионов кальция и железа. Для рекуперации металлов используют катиониты как сильнокислотные (в водородной форме), так и слабокислотные (в натриевой форме).
Ионы цинка извлекают на сильнокислотном сульфокатионите КУ-2Х8 в Н-форме или на карбоксильном катионите КБ-4 в Na-форме. Динамическая обменная емкость по Zn2+ катионита КУ-2 равна 2—3, а КБ-4 —5 мг-экв/г. Сильнокислотные катиониты извлекают ионы цинка в широком •диапазоне значений рН. Карбоксильные катиониты применяют при очистке нейтральных или слабощелочных сточных вод.
Регенерацию сульфокатионитов производят 10%-м раствором серной кислоты; карбоксильные катиониты регенерируют 5%-м раствором Na2SO4. Концентрация цинка в элюатах составляет 6—9 г/л. Ионы меди извлекают из сточных вод катионитом КУ-1 при рН=12—12,4. Сорбционная емкость их равна 37—50 г на 1 л набухшей смолы. "Регенерацию проводят 5%-м раствором НС1. Концентрация меди в элюатах достигает 15—17 г/л. Из кислых сточных вод медь извлекают сильнокислотными катионитами. Их регенерируют 10—20%-м раствором серной кислоты. Ионы никеля извлекают из воды на катионите КЧ-2Х8, динамическая обменная емкость которого равна 63—70 г/кг катионита. Скорость фильтрования сточных вод 12—15 м/ч. Регенерацию проводят 20%-м раствором серной кислоты со скоростью 0,5 м/ч. Полученные при регенерации элюаты содержат 95 г/л никеля и их можно использовать при никелировании. Для удаления из сточных вод катионов трехвалентного хрома Cr3+ применяют Н-катиониты, а хромат-ионы СrO42- и бихромат-ионы Сr2O7 2- извлекают на анионитах АВ-17, АН-18П, АН-25. Емкость анионитов по хрому не зависит от величины рН в пределах от 1 до 6 и значительно снижается
•с увеличением рН>6. При концентрации Сr6+ в сточной воде от 800 до
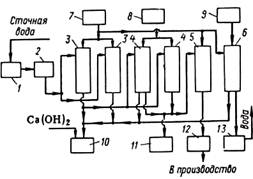
Рис. 11-34. Схема установки для очистки хромсодержащих промывных вод и хромового электролита: 1 — усреднитель; 2 — фильтр; 3 — катионитовые фильтры; 4 — анионитовые фильтры; 5 — катионитовый фильтр для превращения регенерата анионита в оксид хрома (III); 6— катионитовый фильтр для очистки электролита от ионов Fe3+ и Cr3+; 7 — емкость для кислоты; 8 — емкость для щелочи; 9— емкость для отработанного электролита; 10— нейтрализатор; 11—сборник очищенной воды; 12— сборник оксида хрома (111); 13 ~ сборник очищенного электролита
1400 моль экв/л обменная емкость анионита АВ-17-8 составляет 270— 376 моль экв/м3. Скорость фильтрования принимают равной 10—15 м/ч.
Регенерацию сильноосновных анионитов проводят 8—10%-ным раствором едкого натра. Элюаты, содержащие 40—50 г/л шестивалентного хрома, могут быть рекуперированы. Скорость регенерации составляет 1—1,5 м/ч.
Схема установки для очистки хромсодержащих промывных вод и хромового электролита представлена на рис. 11-34. Производительность установки по очищенной воде 2—3 м3/ч, по электролиту 0,2—0,3 м3/ч. Очищенный электролит возвращают в производство. Элюат после фильтра нейтрализуют известковым раствором.
При наличии в сточной воде нескольких катионов объем катионита рассчитывают по наименее сорбируемому иону. Расчетную концентрацию принимают равной сумме концентраций всех удаляемых катионов. Регенерируют катионит раствором серной кислоты или сульфата натрия. При высоком содержании в сточной воде ионов кальция во избежание загипсовывания слоя катионита для регенерации применяют соляную кислоту или хлорид-натрия.
Элюаты от регенерации катионитов представляют собой кислые растворы смеси солей различных металлов. Переработка таких элюатов для выделения металлов трудоемка.
Простые и комплексные цианиды извлекаются на анионитах. Цианиды — соли цианистоводородной кислоты. В сточных водах присутствуют в виде простых (CN-) и комплексных Me(CN)n\m- анионов (Me — катион меди, цинка, кадмия, золота, серебра и др.; п — число цианид. ионов, равное 2, 3, 4...; т— валентность комплексного аниона, равная —1,-2, -3...).
Сточные воды с щелочной реакцией обрабатывают анионитами в солевой
-форме, нейтральные и кислые сточные воды — ионитами в гидроксидной в солевой форме. Поглощение цианидов из щелочных сточных вод анионитами в солевой форме (например, в хлор-форме) происходит по следующим реакциям обмена:

| (11.89) (11.90) (11.91) |
Сорбция цианидов из нейтральных и кислых сред анионитами в солевой форме происходит в соответствии с уравнениями (11.90) и (11.91).
Поглощение цианидов анионитами в гидроксильной форме происходит по уравнениям:

| (11.92) (11.93) |
При сорбции цианидов смолами в солевой форме из нейтральных или слабокислых стоков одним из продуктов реакции обмена является синильная кислота: RCl+HCN<-->RCN+HCl, которая полностью сдвигает равновесие обмена влево и взаимодействия между анионитом и синильной кислотой не происходит. В то же время сорбция цианидов из нейтральных или слабокислых сред анионитами в гидроксидной форме идет с образованием воды, поэтому емкость анионитов в гидроксильной форме выше, чем в солевой. При высоком значении рН исходную сточную воду перед подачей на анионит подвергают Н-катионированию.
Сильноосновный анионит регенерируют 5—10%-ным раствором едкого натра или хлоридом натрия. Регенерация происходит не полностью (простые цианиды десорбируются на 80—90%, комплексные на 42—78%). Для более полной регенерации требуется значительный расход регенерирующих растворов.
Из сточных вод фенолы можно извлекать анионитами (в ОН-форме) или катионитами. Катиониты применяют для обработки минерализованных кислых и нейтральных сточных вод, аниониты — для обесфеноливания слабоминерализованных сточных вод. Рекомендованные для очистки марки иони-тов указаны в табл. 11,11.
Скорость фильтрования сточных вод принимают 8—10 м/ч при концентрации фенола до 1 г/л и 2—3 м/ч—при 3—15 г/л.
Регенерацию анионитов производят 4—10%-м водным или водно-спиртовым (метанольным) растворами едкого натра при скорости фильтрования 0,5—0,8 м/ч. Концентрация фенола в элюате достигает 5% (об.). Элюаты используют в производстве сырого фенола. Для извлечения фенола на 60% при регенерации анионита ЭДЭ-10П требуется 10-кратный расход, а АВ-17— 2,5-кратный расход NаОН по сравнению с теоретическим.
Катиониты регенерируют метанолом при скорости фильтрования 0,3— 0,5 м/ч Расход метанола зависит от исходной концентрации фенола и составляет 15—20 л на 1 кг извлеченного фенола. Расход воды на отмывку после регенерации равен 0,4—0,6 объема на 1 объем катионита. После ректификации метанол используют повторно для регенерации катионитов, а фенолят натрия — для получения фенола.
Таблица 11,11. Марки ионитов
| Марка | Емкость, мг/г | рН | ||
| в статических условиях | В динамических условиях до проскока до насыщения | |||
| до проскока | до насыщения | |||
| Сульфоуголь | 37—40 | 90-100 | - | |
| КУ-1 | - | - | 70-90 | - |
| ЭДЭ-10П | 54-55 | 54-68 | 8,5 | |
| АВ-17 | 85-89 | 90-95 | 6-12 |
| <== предыдущая | | | следующая ==> |
| Проблема системной организации в биологии. Организованность и целостность живых систем (по работам а.а. Богданова, в.и. Вернадского, Берталанфи, Беклемишева) | | |
Date: 2015-05-22; view: 3604; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |