
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Состояние и термы
Спин-орбитальное взаимодействие
Взаимодействие спиново-углового момента электрона и его орбитально-углового момента, которое осуществляется посредствам соответствующих магнитных моментов, называется спин-орбитальным взаимодействием. Электрон – заряженная частица, и его движение в пространстве может вызывать его угловой момент, а угловой момент заряженной частицы вызывает магнитный момент. Спиновое движение всегда сопровождается возникновением магнитного момента.
Тут пара формул важна: гиромагнитное соотношение, магнетон бора.
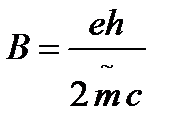 ;
; 
Спин-орбитальное взаимодействие зависит от заряда ядра, пропорционально ему примерно в четвёртой степени. Для тяжёлых атомов оно сравнимо с межэлектронным отталкиванием (по величине, что ли?).
Состояние и термы
Терм – значок, в котором зашифрованы основные свойства электронного состояния атома. Дохрена правил определения терма, главное что помнить – это таблица, которую пилил Сева у доски ещё на квантах Матулиса.
Правила Хунда (напишу одно) (в скобках – то, что соотв. наименьшей энергии):
Для одной и той же электронной конфигурации, мультиплетности (больше), L (больше), наименьшая энергия будет соответствовать уровню с наименьшей/наибольшей j если оболочка заполнена меньше/больше чем наполовину. Например, 3P0 – самый низкий по энергии терм.
2. Спектры атома водорода, щелочных и щелочно-земельных элементов.
Сперва нужно определить, какие термы есть у атома водорода и элементов.
У щелочных: 2S1/2, 2P3/2, 2P1/2, 2D3/2, 2D1/2.
У земельных: 1S0, 1P1, 1D2, 3S1, 3P0, 3P1, 3P2, 3D3, 3D2, 3D1.
Надо помнить правило отбора: L=+-1, спин не изменяется, j=+- 1.
т.е. электрон с S-орбитали может перейти только на P-орбиталь. с Р-орбитали либо на S-орбиталь либо на D-орбиталь
что касается j. к примеру электрон может переместиться с P1/2 на D3/2, но не может переместиться на D5/2
уточню: j может изменяться на -1 и +1 или не измениться. но если j = 0, то он не может перейти на другой терм где j=0
j - суммарный спиновый и орбитальный момент
3. Нормальный и аномальный эффект Зеемана. Эффект Пашена-Бака.
Эффекты Зеемана – расщепление энергетического уровня атомов и молекул под действием внешнего магнитного поля. Как следствие, в спектрах линии тоже расщепляются.
Общая формула эффекта зеемана: Eз=-|N|*|B|cos(a) – хурма в модуле с векторами. N – магнитный момент атома, B – вектор индукции внешнего магнитного поля.
Ещё важная формула:  , где v – энергия между уровнями, Bz – внешнее магнитное поле, Вe – магнетон Бора (9,24 *10^(-24), h – постоянная Планка, с – скорость света
, где v – энергия между уровнями, Bz – внешнее магнитное поле, Вe – магнетон Бора (9,24 *10^(-24), h – постоянная Планка, с – скорость света
Нормальный эффект Зеемана: для атомов в синглетном состоянии. Это если отсутствует спин-орбитальное взаимодействие и каждое состояние характеризуется одним термом в отсутствие внешнего магнитного поля. Расщепление линии идёт на три.
Аномальный: для атомов в несинглетном основном состоянии. Спиновый угловой момент не равен нулю, и возможно спин-орбитальное взаимодействие. Расщепление идёт больше, чем на три линии. Его формула: 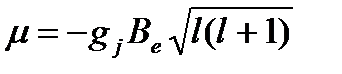 (вместо l может быть S)
(вместо l может быть S)
Отличие между эффектами в том, что у них разный g-фактор.
g-фактор – это безразмерная величина, которая была введена чтобы привести в соответствие то значение спинового магнитного момента, которое наблюдается на практике, и то, которое было рассчитано с помощью законов классической электродинамики. Для нормального эффекта равно 2,0023, для аномального считается по формуле:
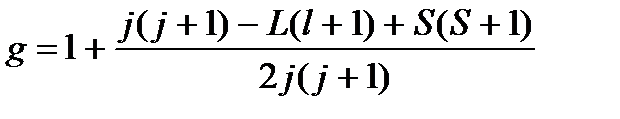 где все эти буквы – квантовые числа, берутся из терма.
где все эти буквы – квантовые числа, берутся из терма.
В принципе всё.
Эффект Пашена — Бака состоит в том, что в сильных магнитных полях аномальное зеемановское расщепление переходит в нормальное.
4. Приближение Борна-Оппенгеймера. Электронное строение молекул в простом методе МОЛКАО. Диаграммы орбитальных энергий и термы состояний двухатомных молекул
Всё это связано с электронным строение молекул. В молекуле много электронов, и необходимо учитывать межэлектронное отталкивание, взаимодействие ядер между собой, ядер и электронов и пр. чушь.
Приближение Борна-Оппенгеймера. Суть такова: ядра намного тяжелее чем электроны => движутся с меньшими скоростями => можно рассматривать движение электронов при покоящихся ядрах и движение ядер в поле, создаваемом быстродвижущимися электронами.
Дальше идёт хренова туча формул.
Но вообще суть такова. Вычисление энергии реальной молекулы сложно, поэтому прибегают к приближению Борна-Оппенгеймера в котором энергию ядра принимают постоянной, а остальное изменяется. потом кучка формул которое это показывает в итоге получается ядерное уравнение Шрёдингера.
Затем описывается что молекулярные орбитали принимают как ЛКАО (линейная комбинационная атомная орбиталь) и с помощью метода Ритца получают гамильтонианы для кулоновского, резонансного и интеграла перекрывания. И с помощью этих интегралов (кулоновский и резонансный) из вековых уравнений получают энергии разрыхляющей и связывающей орбитали.
МО ЛКАО (Линейная Комбинация Атомных Орбиталей) - простейший метод определения волновых функций молекулярных орбиталей. Рассматривает волновые функции молекулярных орбиталей как линейные комбинации волновых функций атомных орбиталей. Для точного определения волновой функции молекулярной орбитали необходимо решить сложную даже для простейших молекул задачу о движении одного электрона в самосогласованном поле, создаваемым атомными ядрами и остальными электронами всех атомов, входящих в молекулу. Поэтому в методе МО ЛКАО используются упрощающие исходную задачу предположения.
5. Симметрия молекул. Точечные группы симметрии. Таблица характеров. Применение симметрии для классификации молекулярных орбиталей
Симметрия – если у молекулы есть более чем одна ориентация в пространстве, неотличимая от исходной, то молекула обладает симметрией. Перевод молекулы из исходной ориентации в пространстве в другую, неотличимую, - операция симметрии.
Ось, точка и плоскость симметрии – элементы симметрии.
Точечная группа симметрии – когда операции симметрии выполняются с сохранением неподвижной одной точки в пространстве и это центр тяжести молекулы.
Всего пять элементов симметрии: ось, плоскость симметрии, зеркально-поворотная ось, центр инверсии и идентичность (идентичностью обладают все молекулы).
Совокупность всех операций симметрии, которые можно провести с молекулой, и являются точечной группой симметрии.
Таблица характеров показывает результат проведения операций симметрии с элементами пространства. Указываются характеры неприводимых представлений. Каждый характер – результат проведения операции симметрии.
Неприводимые представления – строчка в таблице характеров, которая состоит из сумм диагональных элементов подматриц, полученных при исчерпывающем преобразовании подобия. (сам ни хрена не понял).
6. Электронное строение многоатомных молекул. Канонические и локализованные МО. Термы состояний.
Начнём с того, что такое групповые орбитали. А это совокупность атомных орбиталей одного типа, но принадлежащих разным атомам.
Принцип суперпозиции: если орбитали имеют одинаковые энергии, то их легко можно комбинировать. Если орбитали одного атома имеют равные энергии, то и линейные комбинации имели бы ту же самую энергию.
Гибридизация – математический приём, который заключается во взятии линейной комбинации атомных орибатлей одного и того же атома, но имеющих разную симметрию. С помощью гибридизации достигается наглядность в построении молекулярных орбиталей.
В принципе это основа построения электронного строения. Суть такова: две ординаты E, слева один атом, справа – другой. На ординатах их электронные уровни. Ну и размещаем на этих электронных уровнях сами электроны.
Локализованные орбитали. У молекулы могут быть одноэлектронные свойства, которые зависят от свойств конкретной орбитали. Пример такого свойства: потенциал ионизации. Многоэлектронные свойства зависят от электронного состояния молекул.
Польза локализованных орбиталей: для химических реакций (ведь даже в сложных молекулах реакция идёт лишь на одном её участке).
Термы состояния многоатомных молекул определяются на основании тех неприводимых представлений, по которым преобразуются заполненные орбитали данной молекулы. Заполненные оболочки для определения термов многоатомной молекулы не надо учитывать, т.к. они всегда дают полусимметричные представления.
7. Геометрия молекул. Гибридизация и валентные углы. Концепция ОЭПВО.
Концепция ОЭПВО. ОЭПВО – теория отталкивания электронных пар валентных оболочек. Позволяет достаточно хорошо определить точечную группу любой молекулы, если она не содержит атомы переходных элементов (где нет d-валентной оболочки). Её предсказание несколько отличается от истины. Так, каждая молекула разбивается на участки. В каждом есть центральный атом и несколько присоединённых к нему атомов.
Гибридизация и валентные углы.
Гибридизация – математический приём, который заключается во взятии линейной комбинации атомных орибатлей одного и того же атома, но имеющих разную симметрию. С помощью гибридизации достигается наглядность в построении молекулярных орбиталей.
Принцип максимального перекрывания атомных орбиталей: химическая связь образуется в том направлении, в котором перекрывание между атомными орбиталями максимально. Угол между гибридами = угол между p-орбиталями, которые образуют гибридизацию.
По валентному углу можно определить тип гибридизации. Формула:
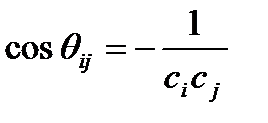 - знать бы ещё, что такое C.
- знать бы ещё, что такое C.
Формула пригодна при углах >90 градусов.
8. Применение квантовохимических представлений для описания реакционной способности молекул.
Механизм реакции – последовательность элементарных стадий, которые проходят от исходных веществ к продуктам реакции. Природа каждой стадии, число стадий, стереохимия, стехиометрия – для описания этого используют кинетику.
На основании различных корреляционных соотношений определяется стереохимия реакции. Скорость реакции определяется энергетическим барьером молекулы продукта и исходных веществ => для её определения можно решить уравнение Шрёдингера.
Для решения строят ППЭ (поверхность потенциальной энергии). ППЭ = f (координаты всех атомов, участвующих в реакции). ПОВЕРХНОСТЬ ПОТЕНЦИАЛЬНОЙ ЭНЕРГИИ (ППЭ), потенциальная функция (потенциал) взаимодействия атомных ядер в изолированной молекуле или химической системе, состоящей из взаимодействующих атомов и (или) молекул. Фактически является потенциальной энергией в уравнении Шрёдингера.
Вводится понятие «координаты реакции» - путь реакции.
Потом снова идёт хренова туча формул.
9. Принцип сохранения орбитальной симметрии. Электроциклические реакции.
Принцип сохранения орбитальной симметр ии. Если в реагирующей системе имеется элемент симметрии, который сохраняется на всём пути реакции, то классифицируя молекулярные орбитали по симметрии относительно этого элемента можно проследить путь реакции, поскольку симметрия этих орбиталей относительно этого элемента останется прежней.
В разных путях и механизмах реакции сохраняются разные элементы симметрии.
Электроциклические реакции. Они протекают в одну стадию через образование циклического переходного состояния. Это реакции циклизации (замыкание/размыкание цикла), реакции циклоприсоединения и циклодимеризации.
Есть два пути реализации реакций: контротаторный и дисротаторный, которые определяют стереохимическое направления и предпочтительные условия реакций. В случае дисротаторного пути сохраняется плоскость симметрии. Это не всегда выгодно.
10. Принцип сохранения орбитальной симметрии. Реакции циклоприсоединения.
Принцип сохранения орбитальной симметрии. Если в реагирующей системе имеется элемент симметрии, который сохраняется на всём пути реакции, то классифицируя молекулярные орбитали по симметрии относительно этого элемента можно проследить путь реакции, поскольку симметрия этих орбиталей относительно этого элемента останется прежней.
В разных путях и механизмах реакции сохраняются разные элементы симметрии.
Циклоприсоединение. Это, например, димеризация этилена в циклобутадиен. По логике должна идти со свистом, но не идёт: термически не выгодно. Фотохимически реакция идёт, но с маленьким выходом.
11. Строение комплексов переходных элементов. Теория кристаллического поля (ТКП). Энергия стабилизации кристаллическим полем. Эффект Яна-Теллера.
Строение координационных соединений.
Первая теория – теория Вернера. Введены понятия (тип, комплексообразователь).
Вторая теория – валентных связей. Привлекались орбитальные представления для описания координационного соединения. Почему координационное число одних соединений больше, а других – меньше (зависит от числа электронных пар).
Ещё есть теория кристаллического поля, теория поля лигандов.
Теория кристаллического поля — квантовохимическая модель, в которой электронная конфигурация соединений переходных металлов описывается как состояние иона либо атома, находящегося в электростатическом поле, создаваемым окружающими его ионами, атомами или молекулами.
Теория кристаллического поля позволяет предсказать или интерпретировать оптические спектры поглощения и спектры электронного парамагнитного резонанса кристаллов и комплексных соединений, а также энтальпий гидратации и устойчивости в растворах комплексов переходных металлов.
Согласно ТКП, взаимодействие между переходным металлом и лигандами возникает вследствие притяжения между положительно заряженным катионом металла и отрицательным зарядом электронов на несвязывающих орбиталях лиганда. Теория рассматривает изменение энергии пяти вырожденных d-орбиталей в окружении точечных зарядов лигандов. По мере приближения лиганда к иону металла, электроны лиганда становятся ближе к некоторым d-орбиталям, чем к другим, вызывая потерю вырожденности. Электроны d-орбиталей и лигандов отталкиваются друг от друга как заряды с одинаковым знаком. Таким образом, энергия тех d-электронов, которые ближе к лигандам, становится выше, чем тех, которые дальше, что приводит к расщеплению уровней энергии d-орбиталей.
На расщепление влияют следующие факторы:
Природа иона металла.
Степень окисления металла. Чем выше степень окисления, тем выше энергия расщепления.
Расположение лигандов вокруг иона металла.
Природа лигандов, окружающих ион металла. Чем сильнее эффект от лигандов, тем больше разность между высоким и низким уровнем энергии.
ТКП. 3 положения:
1.Все взаимодействия между ионом комплексообразователя и лигандом являются чисто электростатическими.
2. Лиганды располагаются вокруг комплексообразователя не зависимо от размера и природы.
3. Электронная конфигурация внешней электронной оболочки ионного комплексообразователя рассматривается в рамках квантовой механики.
Большинство комплексов переходных элементов имеют 6 лигандов и конфигурацию октаэдра. Лиганды расположены на одинаковом расстоянии от комплексообразователя. Есть экваториальные и аксиальные лиганды. Внешняя оболочка – d-оболочка.
Окраска комплексов часто обусловлена переходами d-электронов из одной точечной группы в другую с поглощением и испусканием квантов энергии.
Эффект Яна-Теллера: любая нелинейная вырожденная система является неустойчивой, в ней всегда возникают силы, стремящиеся понизить её симметрию и снять вырождение. Вырождение – одинаковость какого-либо свойства системы. Чем выше симметрия, тем оно больше.
12. Магнитные и спектральные свойства комплексов в теории кристаллического поля.
Магнитные свойства комплексов определяются в магнитном поле. формула аналогична Зеемановской: u=g*Be*(j(j+1))^0,5
Диаграммы распределения d-электронов позволяют предсказать магнитные свойства координационных соединений. Комплексы с непарными электронами являются парамагнитными и притягиваются магнитным полем, а без — диамагнитными и слабо отталкиваются.
Спектральные свойства обусловлены возбуждением электронов и переходом их на более высокие энергетические подуровни. зависит от электронного строения и типа лиганд. Зачастую электронными переходами d-электронов обусловлена окраска комплексов.
13. Теория поля лигандов (ТПЛ) для октаэдрических комплексов. п-Взаимодействия в комплексах переходных элементов.
Теория поля лигандов по сути дела применение теории молекулярных орбиталей к комплексным соединениям. Необходимо учитывать не только орбитали комплексообразователей, но и орбитали лигандов. Учитываются те орбитали, которые непосредственно участвуют в образовании связи Me-Li. Орбитали, на которых есть неподелённая электронная пара.
14. Электрический дипольный момент и его роль в теории строения молекул. Определение дипольных моментов молекул.
Основные свойства:
1. Электрический дипольный момент. Два противоположных, но одинаковых, заряда на фиксированном расстоянии. Произведение абсолютной величины такого заряда на расстояние – электрический дипольный момент. Если у молекулы центры тяжести зарядов не совпадают, то у молекулы имеется дипольный момент.
Как найти «центры тяжести»:
Дипольный момент – векторная сумма произведений всех радиус-векторов, проведённых из произвольно выбранного начала координат в точку расположения зарядов (ri), на эти заряды (qi). Если сумма qi=0, то молекула обязана быть нейтральной.
Единица измерения электрического ДМ – кулон*метр.
ДМ связан с симметрией молекулы:
1) Если у молекулы есть несколько осей симметрии, то у неё нет дипольного момента.
2) Если у молекулы 1 ось симметрии, ДМ есть и направлен вдоль этой оси.
3) Если несколько вертикальных плоскостей, то ДМ направлен вдоль линии их пересечения.
4) Если горизонтальная плоскость симметрии – ДМ нету.
5) Если есть центр инверсии – ДМ нету.
6) Если одна плоскость симметрии – ДМ лежит в этой плоскости.
15. Деформация молекул во внешнем электрическом поле. Индуцируемый дипольный момент и поляризуемость. Определение поляризуемости.
Второе основное свойство молекулы – поляризуемость. Если к молекуле приложить электрическое поле напряжённостью е, то даже у неполярной молекулы возникает дипольный момент (который называется индуцированным).
Поляризуемость – способность молекулы реагировать на внешнее электрическое поле. Это коэфициент, который показывает величину индуцированного дипольного момента. Если молекула в пространстве фиксирована, то поляризуемость – анизотропная величина.
Методы измерения поляризуемости: в газовой фазе основанный на методе Штока и метод дебая.
Метод Дебая: мольная поляризация.
16. Уравнение Ланжевена-Дебая. Уравнение Лорентца-Лоренца. Мольная рефракция и её применение.
Уравнение Ланжевена-Дебая. Если отнести поляризацию к единице объёма моля вещества – это мольная поляризация. Формула:
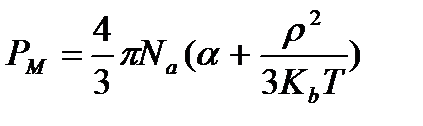 - тут есть постоянная авогадро, константа больцмана, температура, плотность.
- тут есть постоянная авогадро, константа больцмана, температура, плотность.
Решается задача графическим способом. Производится измерение мольной поляризации при различных температурах. Строится график зависимости.
Недостаток уравнения: диэлектрик нужно растворять в растворителе, причём не полярном. В результате нужно делать поправки в величину дипольного момента.
Мольная рефракция – макроскопический аналог поляризуемости. Меряется в тех же единицах, что и поляризуемость. Рефракцию можно использовать чтобы идентифицировать вещество (показатель преломления).
17. Составляющее полной энергии молекул. Характеристика электронных, колебательных и вращательных состояний молекул. Относительная заселённость различных состояний.
Составляющие полной энергии молекул:
Вращение и вращательные спектры молекул.
Чтобы получить вращательный спектр двухядерная молекула должна состоять из двух разных атомов. У молекулы с одинаковыми атомами нет дипольного момента.
Здесь нужно решать задачу о жёстком ротаторе. Снова хренова туча формул.
Условия получения вращательных спектров при подаче электромагнитного излучения:
1) Образец находится в разреженном газообразном состоянии
2) Молекула имела постоянный дипольный момент
Относительная заселённость любого энергетического уровня определяется формулой Больцмана:
 где N0 – общее число молекул в образце, gm – кратность вырождения данного уровня атома, Кb – константа больцмана, Т – температура.
где N0 – общее число молекул в образце, gm – кратность вырождения данного уровня атома, Кb – константа больцмана, Т – температура.
Вращательный спектр – серия линий, расстояние между которыми одинаково и равно удвоенному вращательному расстоянию.
Колебания и колебательные спектры.
Если молекула не обладает дипольным моментом, то он не меняется при колебании и спектра мы не получим. Молекула должна быть гетероядерной.
Смещение атома относительно положения равновесия – естественные колебания координат.
Когда рассматривают колебания молекул, их принимают гармоническими осцилляторами. Реальная молекула таким осциллятором не является, потому что в конечном итоге при таких колебаниях атомы разойдутся и связь разорвётся.
Вопрос нужно значительно дополнить, может даже переписать.
18. Взаимодействие электромагнитного излучения с молекулами. Условия поглощения электромагнитного излучения.
Взаимодействие электромагнитного излучения с веществом не всегда проявляется в поглощении квантов энергии и переходе молекулы на новый квантованный энергетический уровень. Другие эффекты наблюдаются, когда частота облучающего электромагнитного излучения значительно отличается от частоты электронного перехода в спектре данного вещества.
19. Вращение молекул. Вращательные состояния и вращательные спектры двухатомных молекул и их применение.
Вращение и вращательные спектры молекул.
Чтобы получить вращательный спектр двухядерная молекула должна состоять из двух разных атомов. У молекулы с одинаковыми атомами нет дипольного момента.
Здесь нужно решать задачу о жёстком ротаторе. Снова хренова туча формул.
Условия получения вращательных спектров при подаче электромагнитного излучения:
1) Образец находится в разреженном газообразном состоянии
2) Молекула имела постоянный дипольный момент
Относительная заселённость любого энергетического уровня определяется формулой Больцмана:
 где N0 – общее число молекул в образце, gm – кратность вырождения данного уровня атома, Кb – константа больцмана, Т – температура.
где N0 – общее число молекул в образце, gm – кратность вырождения данного уровня атома, Кb – константа больцмана, Т – температура.
Вращательный спектр – серия линий, расстояние между которыми одинаково и равно удвоенному вращательному расстоянию.
20. Вращательные состояния и вращательные спектры молекул. Определение межатомных расстояний и валентных углов.
Вращение и вращательные спектры молекул.
Чтобы получить вращательный спектр двухядерная молекула должна состоять из двух разных атомов. У молекулы с одинаковыми атомами нет дипольного момента.
Здесь нужно решать задачу о жёстком ротаторе. Снова хренова туча формул.
Условия получения вращательных спектров при подаче электромагнитного излучения:
1) Образец находится в разреженном газообразном состоянии
2) Молекула имела постоянный дипольный момент
Относительная заселённость любого энергетического уровня определяется формулой Больцмана:
 где N0 – общее число молекул в образце, gm – кратность вырождения данного уровня атома, Кb – константа больцмана, Т – температура.
где N0 – общее число молекул в образце, gm – кратность вырождения данного уровня атома, Кb – константа больцмана, Т – температура.
Вращательный спектр – серия линий, расстояние между которыми одинаково и равно удвоенному вращательному расстоянию.
Определить межатомные расстояния и валентные углы можно через ИК-спектры. Важнейшие методы определения межатомных расстояний в молекулах основаны на дифракции рентгеновых лучей и электронных волн. В результате применения рентгено - и электроно-графического методов исследования в настоящее время установлена структура большого числа молекул, в том числе и весьма сложных.
21. Колебания молекул. Колебательные состояния и колебательные спектры двухатомных молекул.
Молекулярные колебания - один из трёх типов молекулярного движения. Бывают симметричные, антисимметричные, ножничные, веерные, маятниковые, крутильные колебания.
Если молекула не обладает дипольным моментом, то он не меняется при колебании => колебательного спектра мы не получим. Молекула должна быть гетероядерной. Рассматриваются колебательные движения молекул с допущением, что молекула является гармоническим осциллятором (на деле не является).
Многоатомная молекула и её колебания. Есть 3 поступательные, 3 вращательные степени свободной для нелинейной и 2 вращательные степени для линейной.
Колебания атомов в молекуле – смещение относительно положения равновесия. Нормальные колебания – независимые повторяющиеся движения атомов в молекуле, при которых не происходит смещения центра тяжести и не возникает вращательного момента. Каждое нормальное колебание характеризуется определённой симметрией.
22. Колебательно-вращательные спектры двухатомных молекул
Колебательно-вращательный спектр – это ИК-спектр.
Общее правило отбора любой спектроскопии: волновые функции основного и конечного состояний, а также дипольный момент не должны быть равны нулю. В ИК-спектроскопии используется колебательная волновая функция.
ИК-спектр делится на области обертонов, функциональных групп и «отпечатков пальцев».
Теоретически, число полос в колебательном спектре должно совпадать с числом нормальных колебаний. Но некоторые колебания будут запрещены по симметрии и не проявляться в спектре. Они могут оказаться вырожденными. Многие колебания выходят за пределы диапазона обнаружения прибора.
Могут также наблюдаться лишние (паразитные) полосы. Это, например:
1) Обертоны, которые появляются на частоте в 2 раза больше, чем частота функциональной полосы
2) Полосы с составными частотами (на молекулу упал квант света такой частоты, что его хватило на возбуждение сразу двух колебаний)
3) Полосы с разностными частотами (молекула в возбуждённом состоянии, когда на неё упал квант света, но его не хватает на переход в другое состояние)
4) Резонанс Ферм – раздвоение полос в спектре, когда частота нормального колебания совпадает с частотой обертона другого колебания => они резонируют.
Паразитные полосы имеют малую интенсивность.
23. Колебания двухатомных молекул. Нормальные координаты и нормальные колебания
Двухатомная молекула. Колебания возбуждаются квантами света в ИК-области. Если молекула не обладает дипольным моментом, то он не меняется при колебании => спектра мы не получим. Молекула должна быть гетероядерной.
Пользуются приближением гармонического осциллятора:
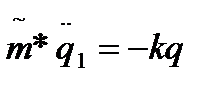 , где q1 – вторая производная по времени (ускорение), k – силовая константа, показывает насколько химическая связь реагирует на колебания. Чем больше k, тем более прочная связь и тем меньше её колебания.
, где q1 – вторая производная по времени (ускорение), k – силовая константа, показывает насколько химическая связь реагирует на колебания. Чем больше k, тем более прочная связь и тем меньше её колебания.
Частота колебаний: 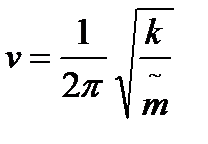
Нормальные колебания, собственные колебания или моды — набор характерных для колебательной системы типов гармонических колебаний. Каждое из нормальных колебаний физической системы, например, колебаний атомов в молекулах, характеризуется своей частотой. Такая частота называется нормальная частота. Набор частот нормальных колебаний составляет колебательный спектр.
Некоторые колебания нельзя остановить, они присутствуют всегда. Они характеризуются нулевой энергией: E0=hv/2
24. Явление комбинационного рассеяния и его применение для определения структуры молекул. КР-спектроскопия.
Комб. рассеяние. На образец намеренно подаётся электромагнитное излучение, которое не удовлетворяет условию Бора. Оно не поглощается. В итоге по логике спектр не будет нести никакой информации.
Электронная оболочка молекулы совершает колебания такой же частоты, что и излучение. Уравнение классической периодической волны:
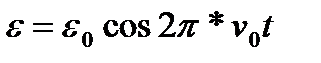
Может случиться так, что молекула, перейдя в метастабильное состояние, будет возбудима данным излучением. В итоге в спектре мы можем получить полосы, самые интенсивные из которых - релеевская, стоксова и антистоксова. Измеряем при этом стоксовы.
На образец под прямым углом действуют ЭМИ, а наблюдают под прямым углом рассеяние.
Дальше начинается математика, море формул и выводов.
Суть такова, что изменение поляризуемости при измерении не должно равняться нулю. Иначе ничего не увидим. Это – правило отбора спектроскопии комбинационного рассеяния.
Штука такая. Если молекула симметрична, то в ИК-спектре мы можем ничего не увидеть. И если в спектрах КР и ИК нет одинаковых полос, то молекула обладает центром инверсии.
Преимущества сектра КР:
+ Позволяет получать информацию о тех колебаниях, которых не видно в ИК-спектре
+ Использует излучение видимой области => можно использовать в качестве растворителя воду
+ Спектр КР чище, в нём реже встречаются паразитные волны
+ Интенсивность полосы логарифмически связана с концентрацией (колич. анализ)
25. Правила отбора в колебательной спектроскопии. Использование симметрии
Общее правило отбора любой спектроскопии: волновые функции основного и конечного состояний, а также дипольный момент не должны быть равны нулю. В колебательной спектроскопии используется колебательная волновая функция.
Теоретически, число полос в колебательном спектре должно совпадать с числом нормальных колебаний. Но некоторые колебания будут запрещены по симметрии и не проявляться в спектре. Они могут оказаться вырожденными.
Тут дописать надо чего-нибудь ещё.
26. Приближение групповых колебаний. Его обоснование и ограничения. Использование в ИК-спектроскопии.
В основе метода лежит длинноволновое поглощение, связанное с возбуждением колебаний атомов, входящих в состав молекул. Указанные колебания возникают по причине наличия упругих связей в молекуле.
Три типа колебательных движений:
-сжатие связей; -растяжение связей; -изменение валентного угла
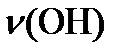
|

|
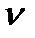 . (δ) - деформационными.
. (δ) - деформационными.
Это обстоятельство послужило основой для концепции групповых колебаний, лежащих в основе интерпретации спектров органических соединений. В основе данной концепции лежит представление о том, что связанные между собой осциллирующие элементы, колеблющиеся при разных частотах, можно считать независимыми. Если атомы имеют близкие массы и связаны между собой связями сопоставимой длины, то такие осцилляторы начинают взаимодействовать.
Ограничения концепции групповых орбиталей:
1) взаимодействие осцилляторов: если атомы в колеблющихся группировках имеют близкие массы и связи внутри группировок и между группировкой и остальной молекулой имеют сопоставимую длину, то осцилляторы начинают взаимодействовать и частота колебаний молекулы перестает быть характеристической величиной.
2) эффекты сопряжения: карбонильные группы в кетонах проявляются в области 1700 – 1750 см-1, сопряжение (например, в амидах) приводит к сдвигу частоты колебания до 1650 см-1.
3) ещё более ярко проявляются эффекты внутри- и межмолекулярного взаимодействия, включая эффекты ассоциации. Наибольшее значение в этом случае играют наиболее высокоэнергетичные взаимодействия, к которым относится водородная связь.
27. Электронная спектроскопия. Электронные состояния молекул и электронные переходы. Классификация электронных переходов.
Электронная спектроскопия является очень чувствительным и удобным методом для определения спектров поглощения, пропускания или отражения, изучения кинетики реакции, сопровождающейся спектральными изменениями.
В обычных условиях спектры имеют диффузный характер, что ограничивает их применение веществами, имеющими хромофорные группы (ароматические циклы, кратные связи и т. п.). Эти спектры позволяют устанавливать наличие тех или иных групп в молекуле, то есть осуществлять групповой анализ, изучать влияние заместителей на электронные спектры и строение молекул, исследовать таутомерию и другие превращения.
Виды электронной спектроскопии:
Фотоэлектронная спектроскопия
Оже-спектроскопия
Рентгеноспектральный микроанализ
Спектроскопия характеристических потерь энергии электронами
А суть электронной спектроскопии такова, что электронные переходы происходят под действием излучения видимой и УФ-области.
Для описания переходов достаточно использовать характеристики орбиталей. За один акт поглощения переносится 1 электрон. Приближённо можно считать, что остальные электроны остаются на своих местах. Переход осуществляется между орбиталями.
Электронные спектры почти никогда не применяются для качественного анализа.
28. Правила отбора в электронных спектрах и интенсивность полос поглощения. Использование симметрии в правилах отбора.
Правило такое: электронная, колебательная и спиновая волновые функции не равны нулю. При этом вращательная волновая функция всегда равна 1.
Кроме того, при электронном переходе спин меняться не должен.
Также оказывает на это всё влияние симметрия. Полосы в спектре могут быть запрещены по симметрии. При этом они остаются в спектре, но сигнал их крайне мал.
Мало. Нужно дописать.
29. Принцип Франка-Кондова и колебательная структура полос в электронных спектрах.
Электронный переход осуществляется за очень короткое время (10-15 с). Ядра же колеблются с периодом 10-12c. Значит, за время электронного перехода ядра не успевают сместиться, и ядерное расстояние остаётся прежним. В результате создаётся возбуждённоэлектронное состояние, при этом ядра остаются на прежних местах.
1. Когда при электронном переходе молекула не очень сильно изменяются энергетическеие параметры.
Если 1 из электронов окажется на разрыхляющей орбитали, энергия не сильно изменится, не сильно изменится при этом и спектр поглощения. Молекула слабее в возбуждённом состоянии, чем в основном.
Тонкая структура – расщепление линий спектра атома.
Колебательная тонкая структура проявляется не всегда. Она исчезает в нежёстких молекулах, т.к. некоторые колебания отдельных частей молекулы друг относительно друга смазываются. Хорошо она выражена у бензола, при этом у дифенила её нет вообще.
Кроме того, колебательная тонкая структура может исчезнуть из-за межмолекулярных взаимодействий. Она проявляется лучше при низких температурах и неполярных растворителях.
30. Связь электронных спектров со структурой молекул. Хромофоры и акусохромы. Сопряжённые и ароматические системы.
Ауксохромы - группы атомов (—ОН, —NH2, —SH и др.), сообщающие окрашенному веществу способность закрепляться на тканях, усиливающие и часто углубляющие цвет красящего вещества.
Хромофоры - группы атомов (—СН=СН—, —CH=N—, —N=N—, =С=О и др.), сообщающие окрашенность органическому веществу.
31. Структурные и сольватационные эффекты в электронной спектроскопии поглощения.
Вообще это сольватохромный эффект. Но нужно его адекватно объяснить. А этого я сделать не смогу, пользуясь лишь конспектом и гуглом…
это связано с полярностью растворителя и вещества (подобное растворяется в подобном). чем лучше сольватация тем меньше энергия, тем выше длина волны перехода
структурные: это правила Скотта и Вудварда-Физера. предсказывание длины волны в зависимости от структуры молекул
Правила Вудварда-Физера – правила для расчёта максимальной длины волны в спектре полиенов
32. Фотофизические процессы, сопровождающие поглощение электромагнитного излучения УФ и видимой области (диаграмма Яблонского)
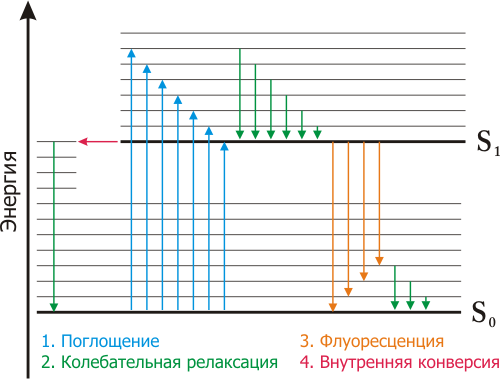
Это диаграмма Яблонского. В принципе тут показаны основные процессы, сопровождающие поглощение ЭМ-излучения… ну почти. Полный список процессов:
1) Поглощение (Absorption)
2) Релаксация (Relaxation)
3) Внутренняя конверсия (Internal Conversion)
4) Интеркомбинационная конверсия
5) Флуоресценция
6) Фосфоресценция
33. Магнитные моменты ядер. Взаимодействие спиновых состояний систем с внешним магнитным полем. Условия наблюдения ядерного магнитного резонанса (ЯМР)
В ЯМР изучаются переходы между спиновыми состояниями магнитных ядер, расщеплённых внешним магнитным полем под действием внешнего электромагнитного излучения радиочастотной области.
Магнитные ядра обладают спинами, а следовательно и магнитными моментами. Не обладают магнитными моментами ядра, имеющие чётное зарядовое число (сера, кислород, углерод).
Ядерный магнетон: 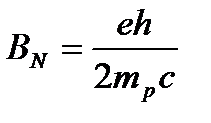 ;
;
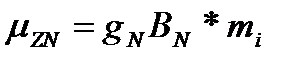
Под действием внешнего магнитного поля происходят электронные переходы и излучается электромагнитная энергия. Обусловлено это дело переориентацией магнитных моментов ядер. Но если подать слишком сильное излучение, то никакого перехода не будет.
34. Химический сдвиг в ЯМР и факторы, определяющие его величину.
Химический сдвиг – изменение резонансных условий магнитных ядер под влиянием электронного окружения. Ядра, находящиеся в одинаковом электронном окружении – химически эквивалентны. Дают один и тот же сигнал при одинаковых условиях. Химический сдвиг измеряется относительно эталонного вещества (тетраметилсилан), химический сдвиг которого принимается равным нулю.
Относительный химический сдвиг измеряют в миллионных долях относительно ТМС.
Природа химического сдвига и факторы, влияющие на него:
1) Локальное диамагнитное экранирование
2) Локальное парамагнитное экранирование
3) Экранирование за счёт анизотропии соседней группы
4) Межатомные кольцевые токи
35. Спин-Спиновое взаимодействие в ЯМР и его проявление. Понятие о спектрах первого порядка и спектрах высших порядков.
Спин-спиновое взаимодействие – взаимодействие между спиновыми угловыми моментами магнитных ядер, которое может приводить к расщеплению сигналов в спектрах ЯМР в так называемые спиновые мультиплеты. Это взаимодействие может быть прямым (векторное) и непрямым (скалярное)
Прямое ССВ – взаимодействуют как 2 магнитных момента, только при условии, что 2 ядра находятся близко друг к другу.
В растворах прямое ССВ усредняется до нуля, т.к. молекулы всё время движутся. Оно может наблюдаться в жёстких молекулах. Основной вид, дающий информацию о структуре, - скалярное взаимодействие. Оно передаётся не через пространство, а через электроны химических связей, независимо от поля. С ростом числа химических связей, отделяющих 2 протона, оно ослабевает. Не передаётся больше, чем через 3 простые связи.
Если разница между химическими сдвигами отсутствует, то не будет происходить расщепление. Химический эквивалент ядра не даёт расщепления.
Спектры высших порядков – спектры, которые не подчиняются правилу, приведённому выше.
Спектры расшифровываются с помощью правила треугольника Паскаля.
36. Понятие о спектроскопии ЭПР и области её применения.
Спектроскопия ЭПР – метод, применимый для обнаружения только систем с ненулевым суммарным электронным спиновым моментом. Он основан на явлении электронного парамагнитного резонанса. В ЭПР регистрируются сигналы неспаренных электронов. В ЭПР можно наблюдать свободные радикалы, ионные радикалы, частицы в триплетном состоянии, а также парамагнитные ионы переходных и редкоземельных металлов.
Метод ЭПР даёт уникальную информацию о парамагнитных центрах. Он однозначно различает примесные ионы, изоморфно входящие в решётку от микровключений. При этом получается полная информация о данном ионе в кристалле: валентность, координация, локальная симметрия, гибридизация электронов, сколько и в какие структурные положения электронов входит, ориентирование осей кристаллического поля в месте расположения этого иона, полная характеристика кристаллического поля и детальные сведения о химической связи. И, что очень важно, метод позволяет определить концентрацию парамагнитных центров в областях кристалла с разной структурой.
Но спектр ЭПР это не только характеристика иона в кристалле, но и самого кристалла, особенностей распределения электронной плотности, кристаллического поля, ионности-ковалентности в кристалле и наконец просто диагностическая характеристика минерала, так как каждый ион в каждом минерале имеет свои уникальные параметры. В этом случае парамагнитный центр является своеобразным зондом, дающим спектроскопические и структурные характеристики своего микроокружения.
| <== предыдущая | | | следующая ==> |
| Аберрации оптических систем | | | добрых дел к 70-летию Победы - девиз волонтеров Донского техникума кулинарного искусства и бизнеса |
Date: 2015-05-19; view: 1451; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |