
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Теоретичні відомості. Атом водню. Водень – основний будівельний матеріал Всесвіту
Атом водню. Водень – основний будівельний матеріал Всесвіту. Це самий розповсюджений елемент, і усі елементи утворюються з нього у результаті термоядерних та ядерних реакцій. Атом водню складається з позитивно зарядженого ядра (одного протона) та негативно зарядженого електрона, який рухається навколо нього (рис. 1).
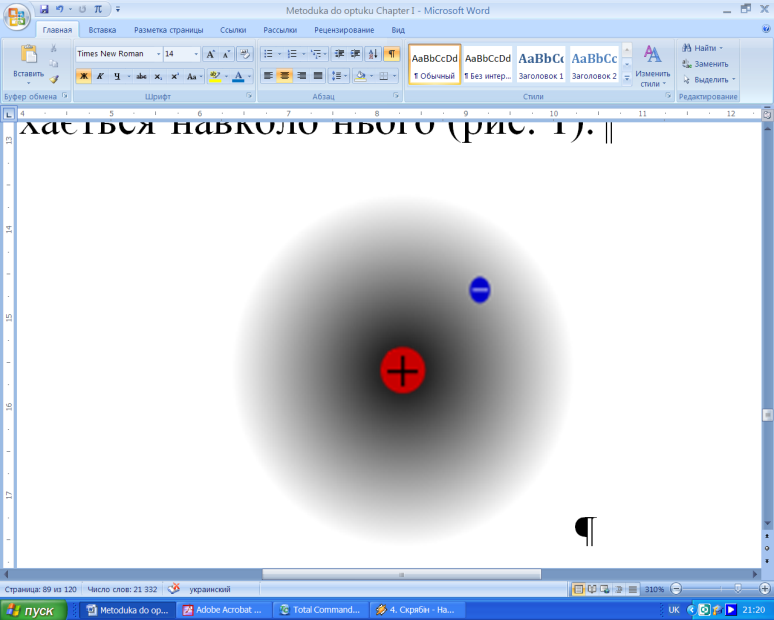
Рисунок 1 – Схематичне зображення атома водню.
При дослідженні оптичних спектрів атомів перед дослідниками постала задача побудови такої моделі атома, яка б змогла пояснити закономірності у них. Природно, що побудову такої моделі слід було починати для найпростішого атома – атома водню. Перед описом моделі атома водню розглянемо спектри його випромінювання. У спектрі випромінювання атому водню дослідниками були зафіксовані сукупності спектральних ліній, які отримали назву спектральних серій. Ці серії називалися іменами вчених, які їх досліджували. Історично першою була серія Бальмера (1885 рік). Лінії цієї серії спостерігаються у видимій і ближній ультрафіолетовій області, тому найбільш доступні для досліджень.
| (1) |
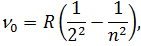
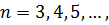
де 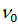 – хвильове число.
– хвильове число.
Пізніше було зафіксовано і досліджено серії в ультрафіолетовій (вакуумний ультрафіолет) та інфрачервоній областях спектру:
серія Лаймана (1906 рік)
| (2) |
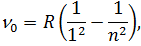
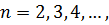
серія Пашена (1908 рік)
| (3) |
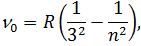
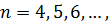
серія Брекета (1922 рік)
| (4) |
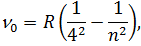
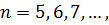
серія Пфунда (1924 рік)
| (5) |

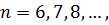
серія Хемфрі (1953 рік)
| (6) |
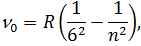
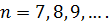
Перша лінія кожної серії відповідає мінімальному значенню 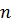 і має мінімальну частоту. При збільшені
і має мінімальну частоту. При збільшені 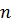 лінії кожної спектральної серії згущуються, а їх частота збільшується (рис. 2). Границі кожної серії відповідає
лінії кожної спектральної серії згущуються, а їх частота збільшується (рис. 2). Границі кожної серії відповідає 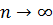 . З короткохвильового боку до границі кожної спектральної серії примикає суцільний спектр. Інтенсивність суцільного спектру максимальна коло границі серії, а потім поступово падає до нуля.
. З короткохвильового боку до границі кожної спектральної серії примикає суцільний спектр. Інтенсивність суцільного спектру максимальна коло границі серії, а потім поступово падає до нуля.
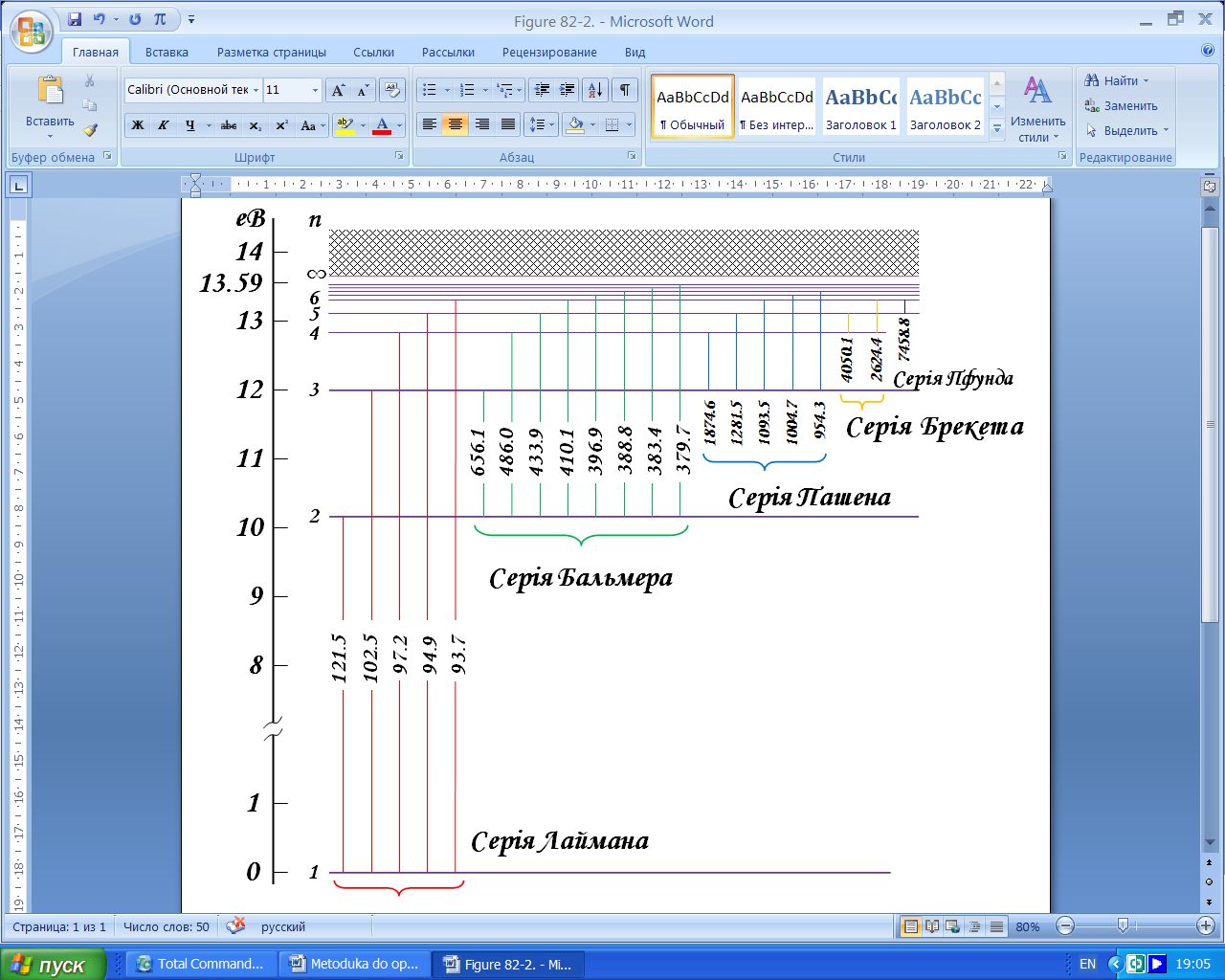
Рисунок 2 – Спектральні серії атома водню. Довжини хвиль вказано у нанометрах.
Узагальнена формула Бальмера для різних спектральних серій водню має вигляд:
| (7) |
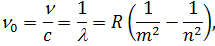
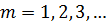
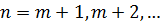
де 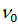 – хвильове число;
– хвильове число;
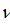 – частота електромагнітної хвилі;
– частота електромагнітної хвилі;
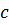 – швидкість світла у вакуумі;
– швидкість світла у вакуумі;
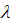 – довжина електромагнітної хвилі;
– довжина електромагнітної хвилі;
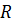 – стала Рідберга,
– стала Рідберга, 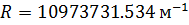 .
.
Число 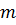 зберігає постійне значення у межах однієї серії і змінюється при переході від однієї серії до іншої. Наведена формула для опису спектральних серій атома водню підібрана емпірично і довший час не мала теоретичного обґрунтування.
зберігає постійне значення у межах однієї серії і змінюється при переході від однієї серії до іншої. Наведена формула для опису спектральних серій атома водню підібрана емпірично і довший час не мала теоретичного обґрунтування.
Атом водню у теорії Бора. Модель Бора атома водню – перша успішна модель атома водню побудована на основі планетарної моделі Резерфорда. Сьогодні модель Бора втратила своє наукове значення, але її необхідно вивчити, щоб було зрозумілим перехід до більш строгих, але й більш абстрактних понять квантової механіки. Модель Бора базується на двох постулатах:
– в атома водню є тільки такі стаціонарні орбіти електрона, для яких момент імпульсу електора
| (8) |
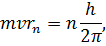
причому, знаходячись на стаціонарній орбіті, електрон не випромінює електромагнітного випромінювання;
– квант світла випромінюється атомом водню при переході електрона з однієї стаціонарної орбіти на іншу. Енергія кванта визначається співвідношенням:
| (9) |
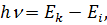
де 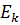 і
і 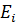 – повна енергія електрона до і після випромінювання фотона.
– повна енергія електрона до і після випромінювання фотона.
На основі цих постулатів була побудована перша успішна модель атома водню. У ній розрахунки проводили для колових орбіт.
Оскільки маса електрона, який обертається навколо ядра, значно (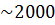 разів) менша маси ядра атома водню (протона), то можна вважати ядро нерухомим. Розмістимо ядро атома в початку системи координат. Енергію електрона на нескінченно великій віддалі від ядра вважаємо рівною нулю. За таких умов повна енергія електрона на віддалі
разів) менша маси ядра атома водню (протона), то можна вважати ядро нерухомим. Розмістимо ядро атома в початку системи координат. Енергію електрона на нескінченно великій віддалі від ядра вважаємо рівною нулю. За таких умов повна енергія електрона на віддалі 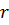 від ядра з зарядом
від ядра з зарядом 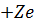 становить:
становить:
| (10) |
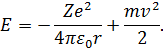
Оскільки припускали, що електрон обертається навколо ядра по коловій орбіті, то кулонівська сила притягання є доцентровою, і для неї можна записати:
| (11) |
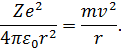
Звідси
| (12) |
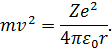
Підставимо вираз (12) у (10). Маємо:
| (13) |
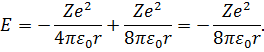
Помножимо ліву і праву частини (11) на 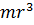 , отримаємо:
, отримаємо:
| (14) |
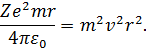
Права частина (14) є квадрат моменту імпульсу, тому на основі (8) можемо записати:
| (15) |
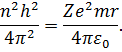
Перемноживши відповідно ліві і праві частини рівностей (13) і (15), отримаємо значення енергії електрона, який обертається навколо ядра з зарядом 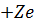 :
:
| (16) |
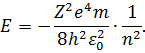
Повна енергія електрона залежить від квантового числа 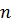 , яке набуває значень
, яке набуває значень 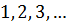 . Використовуючи другий постулат Бора, запишемо для енергії кванта світла:
. Використовуючи другий постулат Бора, запишемо для енергії кванта світла:
| (17) |
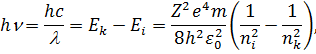
де: 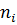 та
та 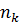 – квантові числа, які відповідають верхньому
– квантові числа, які відповідають верхньому 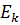 та нижньому
та нижньому 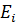 рівням енергії. Виведена формула співпадає з формулою отриманою з аналізу спектрів атома водню. З (7) та (17) отримаємо формулу для знаходження сталої Рідберга:
рівням енергії. Виведена формула співпадає з формулою отриманою з аналізу спектрів атома водню. З (7) та (17) отримаємо формулу для знаходження сталої Рідберга:
| (18) |
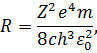
в якій треба записати 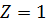 . Обчислене за цією формулою значення сталої Рідберга співпало зі значенням, визначеним спектроскопічними методами. Це був безперечний успіх теорії Бора. Теорія не тільки дозволила отримати узагальнену формулу Бальмера, але й незалежним шляхом визначити сталу Рідберга. Більше того, оскільки точність визначення
. Обчислене за цією формулою значення сталої Рідберга співпало зі значенням, визначеним спектроскопічними методами. Це був безперечний успіх теорії Бора. Теорія не тільки дозволила отримати узагальнену формулу Бальмера, але й незалежним шляхом визначити сталу Рідберга. Більше того, оскільки точність визначення 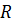 із спектроскопічних даних виявилася вищою, чим точність для значень
із спектроскопічних даних виявилася вищою, чим точність для значень 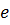 ,
, 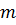 ,
, 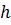 , то з’явилася можливість уточнити останні, використавши спектроскопічне значення
, то з’явилася можливість уточнити останні, використавши спектроскопічне значення 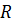 і формулу (18). Теорія Бора дала можливість визначити радіуси дозволених орбіт. З формули (15) отримаємо:
і формулу (18). Теорія Бора дала можливість визначити радіуси дозволених орбіт. З формули (15) отримаємо:
| (19) |
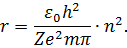
Для отримання мінімального значення радіусу орбіти електрона в атомі водню покладемо 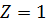 ,
, 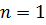 і отримаємо
і отримаємо 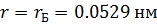 – борівський радіус.
– борівський радіус.
Однак не зважаючи на такі успіхи теорії Бора виникали серйозні труднощі при обчисленні інтенсивності спектральних ліній і їх поляризації. Невдачею закінчились спроби побудувати модель для атома гелію. Постулат Бора про існування стаціонарних орбіт суперечив законам класичної електродинаміки. Згідно цих законів будь-яка заряджена частинка, в якої вектор швидкості не є сталою величиною, повинен випромінювати електромагнітне випромінювання. Електрон, який обертається навколо ядра, повинен втрачати енергію за рахунок випромінювання електромагнітних хвиль і у кінцевому впасти на ядро. Не були з’ясовані фізичні причини стійкості орбіт.
Не дивлячись на вказані недоліки, теорія Бора відіграла позитивну роль у розвитку науки. Вона сприяла ломці старих і формуванню нових фізичних уявлень.
Квантово-механічний опис атома водню. Сучасні уявлення про будову атомів базуються на результатах застосування рівняння Шредінгера – фундаментального лінійного диференціального рівняння квантової механіки.
Загальне рівняння Шредінгера (рівняння Шредінгера, яке залежить від часу):
| (20) |
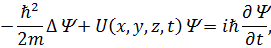
де 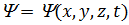 – хвильова функція, що описує стан частинки;
– хвильова функція, що описує стан частинки;
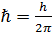 – стала Планка;
– стала Планка; 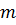 – маса частинки;
– маса частинки;
 – оператор Лапласа
– оператор Лапласа 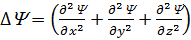 ;
;
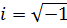 – уявна одиниця;
– уявна одиниця;  – потенціальна енергія частинки у силовому полі в якому вона рухається.
– потенціальна енергія частинки у силовому полі в якому вона рухається.
Рівняння Шредінгера для стаціонарних станів записується:
| (21) |
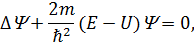
де  – координатна (амплітудна) частина хвильової функції,
– координатна (амплітудна) частина хвильової функції, 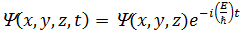 ;
;
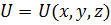 – потенціальна енергія частинки;
– потенціальна енергія частинки;
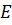 – повна енергія частинки.
– повна енергія частинки.
Хвильова функція, яка визначається з рівняння Шредінгера, має статистичний зміст: квадрат її модуля, помножений на елемент об’єму, визначає імовірність перебування у цьому об’ємі частинки. Диференціальні рівняння типу рівняння Шредінгера (при вимозі однозначності, скінченності та неперервності хвильової функції) мають розв’язки (власні функції) тільки при певних значеннях параметра 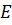 (власні значення
(власні значення 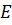 ). Отже, з рівняння Шредінгера автоматично випливає квантування основних параметрів мікросистеми.
). Отже, з рівняння Шредінгера автоматично випливає квантування основних параметрів мікросистеми.
Для атома водню рівняння Шредінгера набуде вигляду:
| (22) |
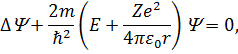
де враховано, що потенціальна енергія електрона у полі ядра дорівнює 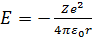 . Розв’язком даного рівняння у сферичній системі координат буде функція, яка залежить від трьох квантових чисел
. Розв’язком даного рівняння у сферичній системі координат буде функція, яка залежить від трьох квантових чисел 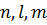 :
:
| (23) |
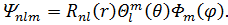
Квантове число 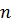 називається головним квантовим числом і однозначно визначає енергію електрона в атомі водню, яка є однією з найбільш важливих фізичних параметрів.
називається головним квантовим числом і однозначно визначає енергію електрона в атомі водню, яка є однією з найбільш важливих фізичних параметрів. 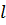 – називається орбітальним квантовим числом, і визначає значення орбітального моменту імпульсу.
– називається орбітальним квантовим числом, і визначає значення орбітального моменту імпульсу. 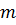 – магнітне квантове число – визначає орбітальний магнітний момент. Крім цих трьох квантових чисел є ще спінове квантове число
– магнітне квантове число – визначає орбітальний магнітний момент. Крім цих трьох квантових чисел є ще спінове квантове число 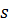 – визначає наявність власного магнітного моменту (спіну) частинки. Ці числа можуть приймати наступні значення:
– визначає наявність власного магнітного моменту (спіну) частинки. Ці числа можуть приймати наступні значення:
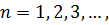
| (24) |
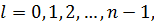
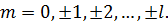
На рис. 3 показано розподіл густини електронної хмари в залежності від кута 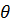 . Там вказані також позначення, які широко використовують у спектроскопії. Кожному значенню
. Там вказані також позначення, які широко використовують у спектроскопії. Кожному значенню 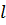 відповідає буква латинського алфавіту:
відповідає буква латинського алфавіту:
| (25) |
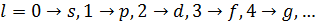
Стан з квантовими числами, наприклад, 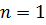 ,
, 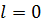 ;
; 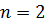 ,
, 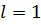 ;
; 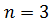 ,
, 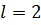 і т. д. позначаються відповідно
і т. д. позначаються відповідно 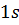 ,
, 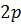 ,
, 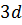 , ….
, ….
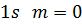
|
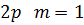
|
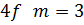
|
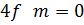
|
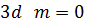
|
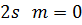
|
Рисунок 3 – Розподіл густини електронної хмари у атомі водню.
Date: 2015-05-18; view: 904; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |