
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Н3С- СН2-СН-СН3- изо-алкан. 4 page
Способы нанесения грунтовых и покровных эмалей: пневматический без подогрева, пневматический с подогревом, безвоздушный и в электрическом поле. Простейшим и вместе с тем наименее экономичным, с точки зрения расхода ЛКМ, является пневматический способ без подогрева при помощи пульверизаторов различной конструкции (пистолетов-краскораспылителей). При подогреве красок вязкость их снижается, поэтому расход растворителей резко уменьшается. Так, при подогреве нитроэмалей до температуры 55...60°С расход растворителя снижается на 20...30%, а синтетических эмалей - на 30...40% (при их подогреве до* 70°С). Распылением в подогретом состоянии с помощью специальных установок, выпускаемых отечественной промышленностью, можно наносить все виды эмалей.
Способ безвоздушного распыления, который чаще всего производится с подогревом, основан на перепаде давления создаваемого насосом установки на выходе эмалей из сопла распылителя. При этом потери эмалей на туманообразование сокращаются в 2...4 раза по сравнению с пневматическим распылением.
Наиболее совершенным, в отношении потерь ЛКМ, является способ нанесения покрытий в электрическом поле, где распыленные частицы эмалей получают отрицательный заряд и притягиваются к противоположно заряженной окрашиваемой поверхности. Этот способ снижает расход эмалей на 30...50% и увеличивает производительность в 2...3 раза по сравнению с другими способами нанесения ЛКМ. Однако, окраска в электрическом поле целесообразна лишь при больших объемах работ, т.к. достаточно энергоемка и требует сложного и дорогостоящего оборудования.
Приведенные способы нанесения ЛКМ относятся к грунтовым и покровным эмалям. При местном шпатлевани, когда устраняются отдельные шероховатости, шпатлевку наносят вручную – шпателем. При шпатлевании более значительных площадей изделия используют грунты - шпатлевки в виде жидкостей, которые наносят на окрашиваемую поверхность пневматическим способом.
Долговечность лакокрасочных покрытий во многом зависит от принятого способа сушки. Различают естественный, конвекционный и терморадиационный способы сушки. Естественный способ сушки используют, как правило, для нитроэмалей. Необходимая температура сушки создается подогревом воздуха (конвекционный способ) или лучистой энергией (терморадиационный способ). Для алкидных эмалей можно использовать все названные виды сушки, а для меламиноалкидной - терморадиационный. При терморадиационном способе инфракрасные лучи проходят через лакокрасочное покрытие и нагревают поверхность изделия, отчего сушка начинается не с поверхности, как это имеет место при естественном и конвекционном способах, а изнутри, способствуя беспрепятственному улетучиванию растворителя и исключая образование дефектов (воздушных пузырьков и различного рода включений) в подповерхностном слое покрытия.
ЦЕПНЫЕ РЕАКЦИИ
Цепные реакции протекают при воспламенении топлив в камере сгорания и крекинге нефти. Последовательность периодически повторяющихся и протекающих с образованием активных частиц реакций называют цепными реакциями.
Активные частицы – радикалы, свободные атомы, атомы со свободной валентностью, частицы с ненасыщенной валентной связью: H·, О·, R· = CH3·, C2H5·.
· – это, как правило, означает, что частицы содержат неспаренный электрон.
Цепные реакции делят на неразветвляющиеся (неразветвленные) и разветвляющиеся (разветвленные). Есть также реакции с редко-разветвленной цепью.
РАЗВЕТВЛЯЮЩИЕСЯ (РАЗВЕТВЛЕННЫЕ) ЦЕПНЫЕ РЕАКЦИИ
Горение водорода: 2H2 + O2 → 2H2O
Стадия
O2® O· + O·, (Р, t) зарождение цепи
H2 ® H· + H·, (Р, t)
Стадия
O· + H2 → OH· + H·
OH· + H· → H2O
OH· + O· → HO2· развитие цепи
HO2· + H· → H2O2
Стадия
ОН·+Н2 → H2O+ H·
H·+ O2 → OH· + O· разветвление цепи
O·+H2 ® OH· + H·
S------------------------
OH·+ 2H2+ O2+® 2OH· + H·+Н2
Стадия
O· + O· → O2 обрыв цепи
H· + H· → H2
РЕАКЦИИ С ВЫРОЖДЕНИЕМ РАЗВЕТВЛЕНИЯ ЦЕПИ
Н
ê
(CH3 – CH2 – CH2 – CH2) – С ¾ Н н- алкан (углеводород)
-------------------------------------------- ê
ß Н
R
Н
ê
R –– С ¾ Н + O2 → CO2 + H2O- реакция горения углеводорода
ê
Н
Стадия
O2 ® O· + O· (Р, t) зарождение цепи
------------------------
Стадия
Н
ê
R –– С ¾ Н + O· → R –– С· ¾ Н + OH·
ê ê
Н Н
|
ê ê
Н Н
R –– С· + O· → R –– С· + ОН·
ê
Н
R –– С· + O· → R· + СО
СО + О·® СО2
R· + О·® R О·
R О· + О· ® RO2·-пероксидный радикал
RС· – H + O· → RС· + OH
RO· + OH· → ROOH – продукты (кетоны, кислоты)- вырождение цепи.
ОН· + OH· → H2O + O·
***********************
Стадия
ROOH· → R· + OH· - разветвление цепи.
Стадия
O· + O· → O2 обрыв цепи
Наличие продуктов, обладающих энергией, превосходящей энергию распада исходного вещества, приводит к разветвлению цепи. Реакции, в которых распад исходных веществ на радикалы идет за счет богатых энергией продуктов, называются автокаталитическими.
ДИНАМИЧЕСКАЯ КОНСТАНТА СКОРОСТИ ЦЕПНОЙ РЕАКЦИИ
Введение этой константы в общепринятые представления связано с тем, что не всякая энергия активной частицы может привести к ее взаимодействию с другой активной частицей. Динамическая константа скорости цепной реакции
Dq – время, в течение которого богатая энергией частица удерживает свою энергию от рассеивания.
Dq – низкая величина в случае наличия у частиц кинетической энергии, которая быстро рассеивается. Цепей практически нет.
Dq – высокая величина – это соответствует колебательной энергии, энергии электронного возбуждения частиц, химической энергии атомов, радикалов.
Dq – самое высокое значение в радикалах и соединений пероксидной группы (H2O2, RO2·, ROOH).
ДИНАМИКА ТЕЧЕНИЯ ЦЕПНЫХ РЕАКЦИЙ
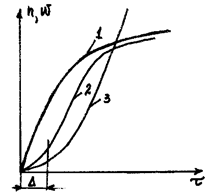 n- число активных частиц; w- скорость реакции
n- число активных частиц; w- скорость реакции
t- время.
1- неразветвляющиеся цепные реакции;
2- реальное течение цепной реакции;
1, 3- разветвляющиеся цепные реакции;
На участке D скорость цепной реакции низкая. Это соответствует процессу зарождения цепи и образованию радикалов. Время D получило название время (период) индукции цепной реакции. Это время связано со временем задержки воспламенения дизельного топлива и углом опережения зажигания бензина. Время индукции цепной реакции при сгорании бензина D ≈ 10-6 сек, при сгорании водорода D ≈ 10-9 сек.
ПРИЧИНЫ ОБРЫВА ЦЕПЕЙ
Цепь обрывается из-за:
1. удара активных частиц о стенку цилиндра (происходит дезактивация);
2. наличия в системе тройных соударений активных частиц:



3. присутствия в системе примесей, которые дезактивируют активные частицы;
4. образования при взаимодействии активных частиц малоактивных радикалов (HO2·).
ПРИЧИНЫ ВОЗНИКНОВЕНИЯ ДЕТОНАЦИИ
Причины возникновения детонации можно разделить на физические и химические.
К физическим причинам относятся бесконечное увеличение числа активных частиц, большое число разветвлений цепи (цепной взрыв), а также плохой отвод тепла при протекании экзотермической реакции (тепловой взрыв).
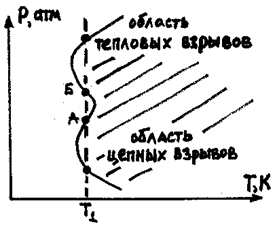
К химическим причинам относятся образование пероксидных радикалов (RO2·), гидроперекиси ROOH и перекиси водорода H2O2. Эти вещества, будучи нестойкими и реакционно-способными, при критической концентрации воспламеняются мгновенно (со взрывом), что вызывает детонацию рабочей смеси в камере сгорания. Причем соединения перекисной группы образуются не во всем объеме камеры сгорания, а в некоторых его участках (зоне наиболее нагретой части камеры сгорания, например, у выпускного клапана).
Механизм действия антидетонаторов
Антидетонаторы можно условно разделить на две группы:
1. Аналоги ТЭС (ТЭС, оксалат железа, оксиды марганца);
2. аналоги бензола (МТБЭ, этанол, анилин, ДАКС, самин).
Аналоги ТЭС и сам тетраэтилсвинец хорошо окисляются. Это приводит к тому, что кислород, необходимый для образования соединений перекисной группы, идет, в первую очередь, на окисление ТЭС и его аналогов.
Бензол и его аналоги имеют длинный период индукции и короткую цепь, а следовательно, механизм действия их как антидетонаторов заключается в обрыве цепей основных реакций в результате тройных соударений.
Date: 2015-05-09; view: 779; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |