
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Реальные газы. Уравнение Ван-дер-Вальса. Критическое состояние. Эффект Джоуля-Томсона
Модель идеального газа позволяет описывать поведение разрежённых реальных газов при достаточно высоких темп-рах и низких давлениях.При выводе уравнения состояния идеального газа размерами молекул и их взаимодействием друг с другом пренебрегают. Повышение давления приводит к уменьшению среднего расстояния между молекулами, поэтому необходимо учитывать объём молекул и взаимодействие между ними. При высоких давлениях и низких темп-рах указанная модель идеального газа непригодна.При увеличении плотности (давления) поведение газа все сильнее отличается от поведения идеального газа.Для реальных газов давление должно резко возрастать при конечном объеме, равном по порядку величины объему всех частиц газа. Обозначим этот конечный объем для одного моля через – b, тогда давление газа может быть записано в виде  , n =
, n = 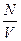 , а, учитывая, что давление само пропорционально концентрации, то n2=
, а, учитывая, что давление само пропорционально концентрации, то n2= 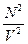 . Учитывая это можно прийти к соотношению P =
. Учитывая это можно прийти к соотношению P = 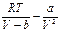 ,которое в форме
,которое в форме 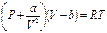 называется уравнением Ван-дер-Ваальса (для одного моля газа). Для произвольного количества вещества v газа (v=m/M) с учетом того, что V=vV m, уравнение Ван-дер-Ваальса примет вид
называется уравнением Ван-дер-Ваальса (для одного моля газа). Для произвольного количества вещества v газа (v=m/M) с учетом того, что V=vV m, уравнение Ван-дер-Ваальса примет вид 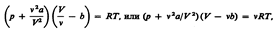 Поправки a и b- постоянные Ван-дер-Ваальса-
Поправки a и b- постоянные Ван-дер-Ваальса- 
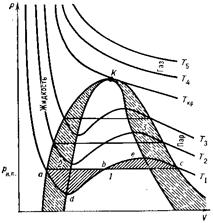
Возможны 3 случая решения уравнения Ван-дер-Ваальса: 1) все три корня действительные и равны между собой этот случай соответствует критическому состоянию (изотерма Tкр); 2) все три корня действительные и разл-е(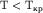 ); 3) два корня мнимые, не имеющие физического смысла, один корень действительный(
); 3) два корня мнимые, не имеющие физического смысла, один корень действительный(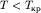 ). Эффе́ктом Джо́уля-То́мсона называется измен-е темп-ры газа при адиабатическом протекании газа под действием постоянного перепада давлений сквозь пористую перегородку. Данный эффект является одним из методов получения низких температур. Измен-е энергии газа в ходе этого процесс будет равно работе: E2 − E1 = P1V1 − P2V2.
). Эффе́ктом Джо́уля-То́мсона называется измен-е темп-ры газа при адиабатическом протекании газа под действием постоянного перепада давлений сквозь пористую перегородку. Данный эффект является одним из методов получения низких температур. Измен-е энергии газа в ходе этого процесс будет равно работе: E2 − E1 = P1V1 − P2V2.
Date: 2015-05-09; view: 850; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |