
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Водяной пар
Основные понятия и определения
Наибольшее распространение в промышленности получил пар, являющийся рабочим телом в паровых турбинах, в атомных установках, теплоносителем в различных теплообменниках и т. п.
Процесс превращения вещества из жидкого состояния в газообразное называется парообразованием. Испарением называется парообразование, которое происходит всегда при любой температуре со свободной поверхности жидкости или твердого тела. Интенсивность испарения возрастает с увеличением температуры жидкости.
Процесс кипения заключается в том, что если к жидкости подвести теплоту, то при некоторой температуре, зависящей от физических свойств рабочего тела и давления, наступает процесс парообразования как на свободной поверхности жидкости, так и внутри нее.
Переход вещества из газообразного состояния в жидкое или твердое называется конденсацией. Жидкость, полученная при конденсации пара называется конденсатом.
Процесс перехода твердого вещества непосредственно в пар называется сублимацией. Обратный переход называется десублимацией.
Если парообразование жидкости происходит в неограниченном пространстве, то вся она может превратиться в пар. Если же парообразование протекает в закрытом сосуде, то пар принимает максимальную плотность при данной температуре и называется насыщенным, т.е. это пар, соприкасающийся с жидкостью и находящийся с ней в термическом равновесии. С изменением температуры жидкости равновесие нарушается, вызывая соответствующее изменение плотности и давления насыщенного пара.
Насыщенный пар, в котором отсутствуют взвешенные высокодисперсные частицы жидкой фазы, называется сухим насыщенным паром. Состояние сухого насыщенного пара определяется только одним параметром – или давлением, или удельным объемом, или температурой.
Насыщенный пар, в котором содержатся взвешенные высокодисперсные частицы жидкой фазы, равномерно распределенные по всей массе сухого насыщенного пара, называется влажным насыщенным паром.
Отношение массы сухого насыщенного пара к массе суммарной влажного насыщенного пара называется степенью сухости пара или паросодержанием (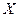 ).
).
Массовая доля кипящей жидкости во влажном паре, равная ( ), называется степенью влажности пара. Для кипящей жидкости при температуре насыщения
), называется степенью влажности пара. Для кипящей жидкости при температуре насыщения  , а для сухого насыщенного пара
, а для сухого насыщенного пара  , следовательно, степень сухости может меняться в пределах от 0 до 1. Таким образом, состояние влажного пара определяется двумя величинами: температурой и давлением или температурой и степенью сухости пара.
, следовательно, степень сухости может меняться в пределах от 0 до 1. Таким образом, состояние влажного пара определяется двумя величинами: температурой и давлением или температурой и степенью сухости пара.
Если сухому насыщенному пару сообщить некоторое количество теплоты при постоянном давлении, то его температура будет возрастать. Пар, получаемый в этом процессе, называется перегретым. Перегретый пар имеет при данном давлении более высокую температуру и удельный объем, чем сухой насыщенный пар. Перегретый пар над поверхностью жидкости получить нельзя. Температура перегретого пара, так же как и газа, является функцией объема и давления.
Перегретый пар является ненасыщенным, так как при данном давлении удельный объем перегретого пара больше удельного объема сухого насыщенного пара, а плотность меньше. Он по своим физическим свойствам приближается к газу и тем ближе, чем выше степень перегрева.
33 PV -диаграмма водяного пара
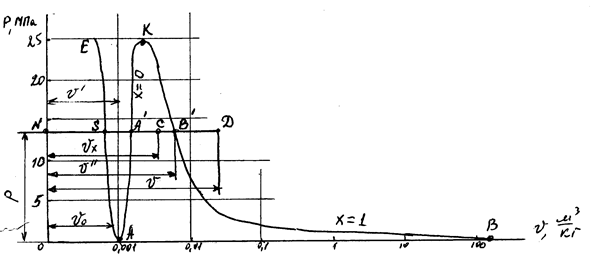
Рисунок 10 – PV -диаграмма водяного пара
Фазовая PV -диаграмма системы, состоящей из жидкости фара, представляет собой график зависимости удельных объемов воды и пара от давления.
Пусть вода при температуре 0 ºС и некотором давлении занимает удельный объем  (отрезок NS). Вся кривая АЕ выражает зависимость удельного объема воды от давления при температуре 0 ºС. Так как вода – вещество почти несжимаемое, то кривая АЕ почти параллельна оси ординат. Если при постоянном давлении сообщать воде теплоту, то ее температура будет повышаться и удельный объем увеличиваться. При некоторой температуре
(отрезок NS). Вся кривая АЕ выражает зависимость удельного объема воды от давления при температуре 0 ºС. Так как вода – вещество почти несжимаемое, то кривая АЕ почти параллельна оси ординат. Если при постоянном давлении сообщать воде теплоту, то ее температура будет повышаться и удельный объем увеличиваться. При некоторой температуре  вода закипает, а ее удельный объем
вода закипает, а ее удельный объем  в точке
в точке 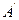 достигает при данном давлении максимального значения. С увеличением давления растет температура кипящей жидкости
достигает при данном давлении максимального значения. С увеличением давления растет температура кипящей жидкости  и
и  также увеличивается.
также увеличивается.
График зависимости  от давления представлен кривой АК, которая называется пограничной кривой жидкости. Характеристикой кривой АК является степень сухости
от давления представлен кривой АК, которая называется пограничной кривой жидкости. Характеристикой кривой АК является степень сухости  .
.
В случае дальнейшего подвода теплоты при постоянном давлении начинается процесс парообразования. При этом количество воды уменьшается, а количество пара увеличивается.
В момент окончания парообразования в точке  пар будет сухим насыщенным. Удельный объем сухого насыщенного пара обозначается
пар будет сухим насыщенным. Удельный объем сухого насыщенного пара обозначается  .
.
При постоянстве давления температура не изменяется и процесс  является одновременно изобарным и изотермическим. В точках
является одновременно изобарным и изотермическим. В точках 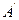 и
и  вещество находится в однофазном состоянии. В промежуточных точках вещество состоит из смеси воды и пара. Такую смесь называют двухфазной системой.
вещество находится в однофазном состоянии. В промежуточных точках вещество состоит из смеси воды и пара. Такую смесь называют двухфазной системой.
График зависимости удельного объема  от давления представлен кривой
от давления представлен кривой  , которая называется пограничной кривой пара, для нее
, которая называется пограничной кривой пара, для нее  .
.
Точка  соответствует состоянию кипящей жидкости в тройной точке (t 0 ºС), а изобара
соответствует состоянию кипящей жидкости в тройной точке (t 0 ºС), а изобара  соответствует состояниям равновесия всех трех фаз. Эта изобара при выбранном масштабе изображения кривых практически совпадает с осью абсцисс.
соответствует состояниям равновесия всех трех фаз. Эта изобара при выбранном масштабе изображения кривых практически совпадает с осью абсцисс.
Если к сухому насыщенному пару подводить теплоту при постоянном давлении, то его температура и объем будут увеличиваться и пар из сухого насыщенного перейдет в перегретый (точка 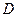 ).
).
Обе кривые 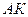 и
и 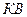 делят диаграмму на три части. Влево от
делят диаграмму на три части. Влево от 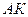 располагается область жидкости, между – двухфазная система, вправо от
располагается область жидкости, между – двухфазная система, вправо от 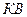 и вверх от точки
и вверх от точки 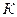 располагается область перегретого пара или газообразного состояния тела. Точка
располагается область перегретого пара или газообразного состояния тела. Точка 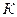 называется критической точкой. Критическая точка является конечной точкой фазового перехода жидкость – пар. Выше точки
называется критической точкой. Критическая точка является конечной точкой фазового перехода жидкость – пар. Выше точки 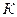 существование вещества в двухфазном состоянии невозможно. Никаким давлением нельзя перевести газ в жидкое состояние при температурах выше критической.
существование вещества в двухфазном состоянии невозможно. Никаким давлением нельзя перевести газ в жидкое состояние при температурах выше критической.
В точке 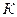 для воды:
для воды:  = 374,12 º С;
= 374,12 º С; 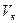 = 0,003147 м3/кг;
= 0,003147 м3/кг; 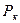 = 22,115 МПа;
= 22,115 МПа; 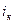 = 2095,2 кДж/кг;
= 2095,2 кДж/кг; 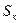 = 4,424 кДж/(кгК).
= 4,424 кДж/(кгК).
При температуре 0 ºС область между линией  и осью ординат – равновесное сосуществование жидкой и твердой фаз. Основные параметры жидкости, сухого и влажного насыщенного пара при 0 ºС и различных давлениях можно приближенно принимать
и осью ординат – равновесное сосуществование жидкой и твердой фаз. Основные параметры жидкости, сухого и влажного насыщенного пара при 0 ºС и различных давлениях можно приближенно принимать  = 0,001 м3/кг.
= 0,001 м3/кг.
Удельное количество теплоты, расходуемое на нагревание воды от 0 ºС до температуры кипения при соответствующем давлении, определяется по уравнению:
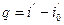 , (107)
, (107)
где:  – удельная энтальпия кипящей жидкости, Дж/кг;
– удельная энтальпия кипящей жидкости, Дж/кг;
 – удельная энтальпия воды при 0 ºС, Дж/кг.
– удельная энтальпия воды при 0 ºС, Дж/кг.
В термодинамике удельные энтальпию и энтропию воды в состоянии соответствующем тройной точке, принимают 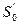 = 0 кДж/(кгК);
= 0 кДж/(кгК);  = 0 Дж/кг.
= 0 Дж/кг.
Удельную внутреннюю энергию воды в этой же точке при 0 ºС также принимают равной нулю. Удельная внутренняя энергия кипящей жидкости определяется из общей формулы, используемой для определения удельной энтальпии:
 или
или 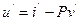 . (108)
. (108)
Энтальпию кипящей жидкости берут из таблиц.
Количество теплоты, затраченное на парообразование 1 кг воды при температуре кипения до сухого насыщенного пара, называется удельной теплотой парообразования и обозначается 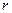 . С возрастанием давления и температуры
. С возрастанием давления и температуры 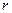 уменьшается и в критической точке
уменьшается и в критической точке 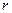 =0. Удельная теплота парообразования расходуется на изменение внутренней потенциальной энергии или на работу дисгрегации (разъединения) и работу расширения.
=0. Удельная теплота парообразования расходуется на изменение внутренней потенциальной энергии или на работу дисгрегации (разъединения) и работу расширения.
Удельная энтальпия сухого насыщенного пара определяется по формуле:
 , (109)
, (109)
а удельная внутренняя энергия:
 . (110)
. (110)
Температура влажного пара равна температуре кипения жидкости при данном давлении. Удельный объем влажного пара  определяется как объем смеси, состоящей из сухого пара и воды:
определяется как объем смеси, состоящей из сухого пара и воды:
 . (111)
. (111)
Удельная энтальпия влажного пара определяется по формуле:
 , (112)
, (112)
где 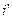 – удельная энтальпия жидкости,
– удельная энтальпия жидкости,  ;
;
 – количество теплоты для испарения х -й доли воды.
– количество теплоты для испарения х -й доли воды.
Удельная внутренняя энергия влажного пара:
 . (113)
. (113)
Перегретым называют пар, имеющий при данном давлении более высокую температуру, чем сухой насыщенный пар.
Удельной теплотой перегрева принято называть то количество теплоты, которое необходимо затратить на перегрев 1 кг сухого пара до требуемой температуры при постоянном давлении. Свойства перегретого пара приближаются к свойствам газа.
34 ТS -диаграмма водяного пара

Рисунок 11 – ТS -диаграмма водяного пара
Графически на ТS -диаграмме произвольный процесс нагрева жидкости, парообразования и перегрева пара при постоянном давлении изображается кривой  . Если нанести на диаграмме ряд таких изобарных процессов и соединить характерные точки, то получим пограничные кривые кипящей жидкости АК (х=0) и сухого пара КВ (х=1), которые сходятся в критической точке К.
. Если нанести на диаграмме ряд таких изобарных процессов и соединить характерные точки, то получим пограничные кривые кипящей жидкости АК (х=0) и сухого пара КВ (х=1), которые сходятся в критической точке К.
Пограничные кривые делят диаграмму на три части: влево от АК – область жидкости, между кривыми АК и КВ – область влажного пара, вправо от КБ и вверх от точки К – область перегретого пара.
На диаграмму наносят изобары, линии постоянных удельных объемов, а в области влажного пара – линии равных степеней сухости. Область диаграммы, лежащая ниже изобары тройной точки (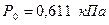 ), изображает различные состояния смеси пар+лед.
), изображает различные состояния смеси пар+лед.
На TS -диаграмме площадь, заключенная между линией обратимого процесса и осью абсцисс (например, 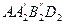 ), изображает удельное количество теплоты, сообщаемое рабочему телу, для превращения воды в перегретый пар. Удельная работа любого обратимого цикла изображается на ТS -диаграмме площадью цикла. С помощью ТS -диаграммы легко определить термический КПД обратимого цикла.
), изображает удельное количество теплоты, сообщаемое рабочему телу, для превращения воды в перегретый пар. Удельная работа любого обратимого цикла изображается на ТS -диаграмме площадью цикла. С помощью ТS -диаграммы легко определить термический КПД обратимого цикла.
Недостатком диаграммы является то, что при определении количества теплоты приходится измерять соответствующие площади, что усложняет определение необходимых величин.
35IS -диаграмма водяного пара

Рисунок 12 – IS -диаграмма водяного пара
IS -диаграмма для водяного пара впервые была предложена Молье в 1904 г. и обладает определенными преимуществами при расчетах по сравнению с ТS -диаграммой.
Большим достоинством IS -диаграммы является то, что техническая работа и количество теплоты, участвующие в процессах, изображаются отрезками линий, а не площадями, как в ТS -диаграмме.
По оси ординат откладывается удельная энтальпия пара, а по оси абсцисс – удельная энтропия. За начало координат принято состояние воды в тройной точке, где энтропия и энтальпия воды равны нолю.
Пользуясь данными таблиц водяного пара, на диаграмме, прежде всего, наносят пограничные кривые жидкости и пара, сходящиеся в критической точке К. Пограничная кривая жидкости выходит из начала координат, так как в этой точке энтальпию и энтропию принимают равной нулю. Состояние воды изображается точками на соответствующих изобарах, которые практически сливаются с пограничной кривой жидкости. Линии изобар в области влажного пара являются прямыми наклонными линиями, расходящимися веером от пограничной кривой, жидкости. В изобарном процессе:
 (115)
(115)
 . (116)
. (116)
Угловой коэффициент наклона изобары к оси абсцисс в каждой точке диаграммы численно равен абсолютной температуре данного состояния. Так как в области влажного пара изобара совпадает с изотермой, то согласно последнему уравнению изобары влажного пара являются прямыми линиями: 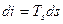 , а это и есть уравнение прямой лини.
, а это и есть уравнение прямой лини.
В области перегретого пара изобары имеют кривизну с выпуклостью, обращенной вниз. Изобара АВ соответствует давлению в тройной точке.
В области влажного пара наносится сетка линий постоянной сухости пара (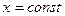 ), которые сходятся в критической точке К. Изотермы в области влажного пара совпадают с изобарами. В области перегретого пара они расходятся: изобары поднимаются вверх, а изотермы представляют собой кривые линии, обращенные выпуклостью вверх. При низких давлениях изотермы весьма близки к горизонтальным прямым, с повышением давления кривизна изотерм увеличивается. На диаграмму наносится сетка изохор, которые имеют вид кривых, поднимающихся более круто вверх по сравнению с изобарами.
), которые сходятся в критической точке К. Изотермы в области влажного пара совпадают с изобарами. В области перегретого пара они расходятся: изобары поднимаются вверх, а изотермы представляют собой кривые линии, обращенные выпуклостью вверх. При низких давлениях изотермы весьма близки к горизонтальным прямым, с повышением давления кривизна изотерм увеличивается. На диаграмму наносится сетка изохор, которые имеют вид кривых, поднимающихся более круто вверх по сравнению с изобарами.
Обратимый адиабатный процесс в IS -диаграмме изображается вертикальной прямой. Поэтому все вертикальные прямые представляют собой адиабаты. Область диаграммы, лежащая ниже изобары тройной точки, изображает различные состояния смеси пар+лед.
Date: 2015-05-09; view: 1922; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |