
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Примеры расчетов рН и концентрации растворов веществ
Пример1. Определить рН 0,05 М H2SO4 серной кислоты.
Решение: 1 2
1. Напишем уравнение диссоциации кислоты H2SO4 Û 2H++ SO42-
0,05 х
Считая степень диссоциации кислоты 100 %, находим, что из одной молекулы (моля) кислоты при диссоциации образуются 2 иона (моля) Н+.
2. Следовательно, что из 0,05 молей ее образуется х = 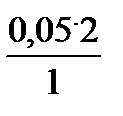 = 0.1 молей Н+, т.е. [H+] = 10-1 моль/л Þ pH = -lg[H+] = -lg10-1 = 1
= 0.1 молей Н+, т.е. [H+] = 10-1 моль/л Þ pH = -lg[H+] = -lg10-1 = 1
Решение:
1. Напишем уравнение диссоциации NH4OH Û NH4++OH-
ß
2. Из уравнения видно, что из одной молекулы основания при диссоциации образуется один гидроксид-ион. Однако степень диссоциации основания – 1 %, поэтому при составлении пропорции по уравнению диссоциации необходимо найти концентрацию основания, которая подвергается диссоциации:
0,01 моль/л (общая конц-я) принимаем за 100 %
х (искомая конц-я) // ------ //------- // ------// -- 1 %
х = 10-4 моль/л NH4OH – концентрация, которая подвергается распаду.
3. Найдем концентрацию гидроксид-иона на основе уравнения диссоциации:
1 моль NH4OH при распаде дает 1 моль ОН-
10-4 моль/л --//------- //------- //------х моль/л [OH-]
х = 10-4 моль/л концентрация гидроксид-иона
4. Из выражения ионного произведения воды, находим концентрацию ионов водорода:
[H+] = 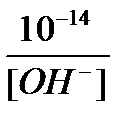 =
= 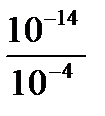 = 10-10 Þ pH = -lg[H+] = -lg10-10 = 10.
= 10-10 Þ pH = -lg[H+] = -lg10-10 = 10.
Пример 3. Вычислить молярную концентрацию раствора H2SO4 c pH=4.
1 2
Решение: 1. Напишем уравнение диссоциации кислоты H2SO4Û2H++ SO42-
х(См) 10-4
Из уравнения видно, что из одной молекулы кислоты при диссоциации образуются 2 иона Н+. Если рН = 4 Þ [H+] = 10-pH = 10-4 моль/л
2. Считая, что каждая молекула распадается на ионы (a=100%) составим пропорцию по уравнению диссоциации:
1моль H2SO4 распадается на 2 моля Н+
х (См) -//------- //-------//------- //-10-4 моль/л [H+]
х (См) = 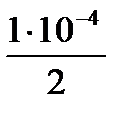 =5. 10-5 моль/л [H2SO4].
=5. 10-5 моль/л [H2SO4].
Date: 2015-05-09; view: 663; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |