
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Закон Майера. Энтропия идеального газа
Идеальные газы подчиняются уравнению состояния Клапейрона 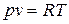 и закону Джоуля, согласно которому удельная внутренняя энергия идеального газа зависит только от температуры
и закону Джоуля, согласно которому удельная внутренняя энергия идеального газа зависит только от температуры
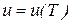 . (64)
. (64)
Совместное использование уравнения Клапейрона и закона Джоуля приводит к выводу о том, что удельная энтальпия идеального газа также являются функциями только температуры
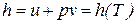 . (65)
. (65)
С учетом законов идеальных газов и исходя из соотношений (55), (56), изменение внутренней энергии 1 кг идеального газа в элементарном и конечном (1-2) процессах находится по следующим формулам:
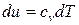 ;
; 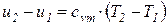 , (66)
, (66)
а изменение энтальпии 1 кг идеального газа в элементарном и конечном (1-2) процессах определяется по следующим зависимостям:
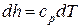 ;
; 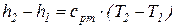 . (67)
. (67)
После подстановки соотношений (66) и (67) в выражение первого начала термодинамики для простых тел (48), (49) получаем уравнение первого начала термодинамики для идеального газа по балансу рабочего тела в дифференциальной и интегральной формах:
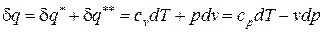 ; (68)
; (68)
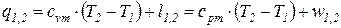 . . (69)
. . (69)
Из уравнения первого начала термодинамики для идеального газа (68) можно получить следующее выражение:
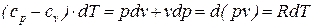 , (70)
, (70)
из которого следует, что разность истинных теплоемкостей идеального газа при постоянном давлении и при постоянном объеме равна величине характеристической газовой постоянной
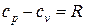 . (71)
. (71)
Это выражение (71) впервые было получено Р. Майером (1842 г.) и называется законом Майера.
Уравнение (71) может быть записано и для одного кмоля газа
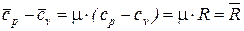 . (72)
. (72)
Разделив уравнение (68) на абсолютную температуру T, получим
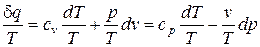 . (73)
. (73)
С учетом того, что для идеального газа, исходя из уравнения Клапейрона, справедливы равенства: 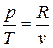 ;
; 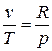 получим
получим
 . (74)
. (74)
Правая часть уравнения (74) представляет собой сумму полных дифференциалов. Это значит, что и соотношение 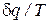 есть полный дифференциал некоторой функции состояния идеального газа (s), называемой удельной энтропией.
есть полный дифференциал некоторой функции состояния идеального газа (s), называемой удельной энтропией.
Изменение удельной энтропии в элементарном процессе представляет собой полный дифференциал и определяется соотношением
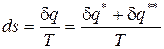 . (75)
. (75)
Из уравнения (74) после интегрирования получим, что изменение удельной энтропии идеального газа в процессе (1-2) может быть найдено из соотношения
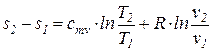 =
= 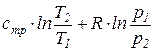 . (76)
. (76)
Теплоемкости 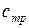 и
и  называются вторыми средними теплоемкостями и находятся путем осреднения по логарифму абсолютных температур
называются вторыми средними теплоемкостями и находятся путем осреднения по логарифму абсолютных температур
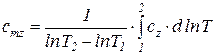 . (77)
. (77)
Если принять, что истинная теплоемкость является линейной функцией температуры 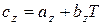 , то
, то
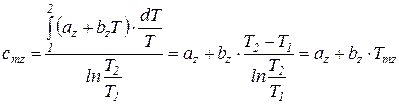 . (78)
. (78)
Таким образом, первая средняя теплоемкость равна истинной теплоемкости при средней арифметической температуре процесса (Tma), а вторая – при средней логарифмической температуре процесса (Tmz). В случае, если 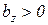 , то первая средняя теплоемкость численно несколько больше второй.
, то первая средняя теплоемкость численно несколько больше второй.
5. Процессы изменения состояния термодинамических систем
Date: 2015-05-09; view: 657; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |