
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Реальный газ
Газ, свойства которого (в отличие от идеального газа) зависят от взаимодействия молекул, называется реальным. Реальные газы хорошо описываются моделью классического идеального газа, если они достаточно разреженные (давления малые) и имеют высокую температуру.
Молекулы реального газа имеют собственный объем, за счет чего фактический свободный объем, в котором могут двигаться молекулы, равен V - b, где b - объем, который занимают собственно молекулы. Кроме того, действие сил притяжения вызывает увеличение давления на величину p¢ = а/V 2, где a - константа. Таким образом, уравнение состояния реального газа (уравнение Ван дер Ваальса) для одного моля имеет вид:
(р + р¢)(V - b) = RT. (7.29)
Типичные значения констант а и b для некоторых газов приведены в табл. 7.1.
Табл. 7.1 –Константы Ван дер Ваальса для некоторых газов
| Газ | а ×10-1, м4×Н/моль | b ×10-3, м3/моль |
| Кислород О2 | 1,36 | 0,0318 |
| Двуокись углерода СО2 | 3,59 | 0,0427 |
| Хлор Сl2 | 6,51 | 0,0562 |
| Гелий Не | 0,034 | 0,0237 |
| Водород Н2 | 0,244 | 0,0266 |
| Метан СН4 | 2,25 | 0,0428 |
| Азот N2 | 1,39 | 0,0391 |
Примечание: 1 м4×Н/моль = 1 Дж×м3/моль2 =10 л×бар/моль2; 1 м3/моль = 103 л/моль
| Иоганн Ван дер ВААЛЬС (1837-1923) Голландский ученый, известный как автор уравнения состояния реальных газов и жидкостей. За эти исследования получил Нобелевскую премию 1910 года. Был первым, кто понял необходимость учета объема молекул и межмолекулярных сил во время установления соотношений между давлением, объемом и температурой газов и жидкостей. | 
|
Изотермы реального газа приведены на рис. 7.6. В случае высоких температур изотерма реального газа не отличается от изотермы идеального газа. При определенной температуре Ткр (критическая температура) на изотерме наблюдается перегиб. Под пунктирной линией расположена область двухфазных состояний Ж+П (жидкость и насыщенный пар), слева от нее находится область жидкого состояния Ж, а справа – область пара П. Пар отличается от других газообразных состояний Г тем, что во время изотермического сжатия претерпевает процесс сжижения. Газ Г при температуре, большей критической, не может быть преобразован в жидкость.
Изохорный переход из точки А в точку В и далее изобарный переход из точки В в точку С дают возможность получить жидкость из газа. На этом основан принцип сжижения газов.
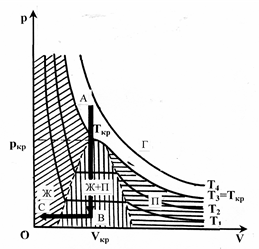
| Рис. 7.6. Изотермы реального газа (пояснения в тексте) |
Пример
Один моль двуокиси углерода при температуре 293 К занимает объем 2 л. Определить давление, создаваемое газом, при помощи уравнений состояния идеального и реального газов.
Date: 2015-05-09; view: 683; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |