
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Смеси идеальных газов
Все зависимости, полученные выше для идеальных газов, справедливы и для их смесей, если в них подставлять газовую постоянную, молекулярную массу и теплоемкость смеси.
Закон Дальтона. В инженерной практике часто приходится иметь дело с газообразными веществами, близкими по свойствам к идеальным газам и представляющими собой механическую смесь отдельных компонентов различных газов, химически не реагирующих между собой. Это так называемые газовые смеси. В качестве примера можно назвать продукты сгорания топлива в двигателях внутреннего сгорания, топках печей и паровых котлов, влажный воздух в сушильных установках и т.д.
Основным законом, определяющим поведение газовой смеси, является закон Дальтона: полное давление смеси идеальных газов равно сумме парциальных давлений всех входящих в нее компонентов:
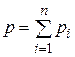 . (4.17)
. (4.17)
Парциальное давление pi – давление, которое имел бы газ, если бы он один при той же температуре занимал весь объем, занимаемый смесью.
Способы задания смеси. Состав смеси может быть задан массовыми, объемными или мольными долями.
Массовой долей называется отношение массы отдельного компонента Мi к массе смеси М:
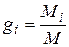 . (4.18)
. (4.18)
Очевидно, что 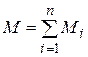 и
и 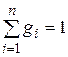 .
.
Массовые доли часто задаются в процентах. Например, для сухого воздуха 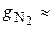 77 %;
77 %; 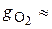 23 %.
23 %.
Объемная доля представляет собой отношение приведенного объема газа Vi к полному объему смеси V:
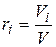 . (4.19)
. (4.19)
Приведенным называется объем, который занимал бы данный газ, если бы его давление и температура равнялись давлению и температуре смеси.
Для вычисления приведенного объема Vi запишем два уравнения состояния для i -го компонента:
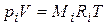 ; (4.20)
; (4.20)
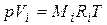 . (4.21)
. (4.21)
Первое уравнение относится к состоянию компонента газа в смеси, когда он имеет парциальное давление pi и занимает полный объем смеси, а второе уравнение – к приведенному состоянию, когда давление и температура компонента равны, как и для смеси, р и Т. Из уравнений следует, что
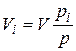 . (4.22)
. (4.22)
Просуммировав соотношения (4.22) для всех компонентов смеси, с учетом закона Дальтона 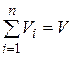 получим
получим 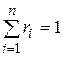 . Объемные доли также часто задаются в процентах. Для воздуха
. Объемные доли также часто задаются в процентах. Для воздуха 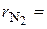 79 %,
79 %, 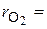 21 %.
21 %.
Иногда бывает удобнее задать состав смеси мольными долями. Мольной долей называется отношение количества молей Ni рассматриваемого компонента к общему количеству молей смеси N.
Пусть газовая смесь состоит из N 1 молей первого компонента, N 2 молей второго компонента и т.д. Число молей смеси 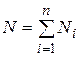 , а мольная доля компонента будет равна
, а мольная доля компонента будет равна 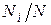 .
.
В соответствии с законом Авогадро объемы моля любого газа при одинаковых р и Т, в идеально газовом состоянии одинаковы. Поэтому приведенный объем любого компонента может быть вычислен как произведение объема моля V m на число молей этого компонента, т.е. 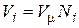 , а объем смеси – по формуле
, а объем смеси – по формуле 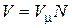 . Тогда
. Тогда 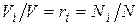 и, следовательно, задание смеси идеальных газов мольными долями равнозначно заданию ее объемными долями.
и, следовательно, задание смеси идеальных газов мольными долями равнозначно заданию ее объемными долями.
Газовая постоянная смеси газов. Просуммировав левые и правые части уравнения 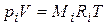 (4.20) для всех компонентов смеси и имея в виду, что
(4.20) для всех компонентов смеси и имея в виду, что 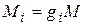 , получим
, получим 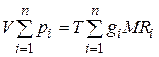 . Учитывая, что
. Учитывая, что 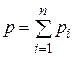 (4.17), можно записать
(4.17), можно записать
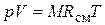 , (4.23)
, (4.23)
где
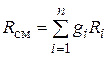 . (4.24)
. (4.24)
Из уравнения (4.23) следует, что смесь идеальных газов также подчиняется уравнению Клапейрона.
Поскольку в соответствии с (1.6) 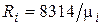 , то из (4.24) следует, что газовая постоянная смеси [Дж/(кг×К)] равна
, то из (4.24) следует, что газовая постоянная смеси [Дж/(кг×К)] равна
 , (4.25)
, (4.25)
где m i выражена в кг/кмоль.
Кажущаяся молекулярная масса смеси. Выразим формально газовую постоянную смеси по формуле (1.6), введя кажущуюся молекулярную массу смеси mсм:
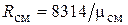 . (4.26)
. (4.26)
Сравнивая правые части соотношений (4.25) и (4.26), найдем
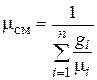 . (4.27)
. (4.27)
Из определения массовых долей следует, что
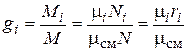 . (4.28)
. (4.28)
Просуммировав это соотношение для всех компонентов и учитывая, что 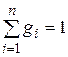 , получим выражение для кажущейся молекулярной массы смеси, заданной объемными долями:
, получим выражение для кажущейся молекулярной массы смеси, заданной объемными долями:
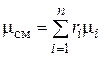 . (4.29)
. (4.29)
Соотношение между объемными и массовыми долями. Подставив (4.29) в (4.28), получаем
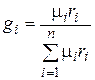 . (4.30)
. (4.30)
Поскольку 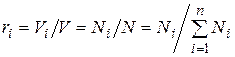 , то
, то
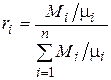 .
.
Разделив числитель и знаменатель этой формулы на массу смеси М, получим
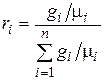 . (4.31)
. (4.31)
Теплоемкость смеси идеальных газов. Если смесь газов задана массовыми долями, то ее массовая теплоемкость с определяется как сумма произведений массовых долей на массовую теплоемкость каждого компонента, т. е.
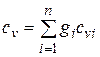 ;
; 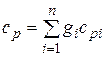 . (4.32)
. (4.32)
При задании смеси объемными долями объемная теплоемкость смеси
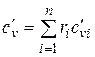 ;
; 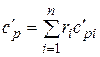 . (4.33)
. (4.33)
Аналогично мольная теплоемкость смеси равна произведению объемных долей на мольные теплоемкости составляющих смесь газов:
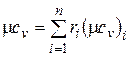 ;
; 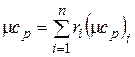 . (4.34)
. (4.34)
Date: 2015-05-09; view: 1064; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |