
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Термодинамика. 1. Задание {{ 1 }} Термодинамика-1
ВЫБОРОЧНОЕ СОДЕРЖАНИЕ ТЕСТОВЫХ МАТЕРИАЛОВ
Термодинамика
1. Задание {{ 1 }} Термодинамика-1
Теплоёмкость это
R Термодинамическая величина, зависящая от процесса.
2. Задание {{ 2 }} Термодинамика-2
Уравнение Гиббса-Дюгема
R 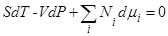
3. Задание {{ 3 }} Термодинамика-3
Принцип Ле-Шателье
R Внешнее воздействие, выводящее тело из равновесия, стимулирует в нём процессы, стремящиеся ослабить результаты этого воздействия.
4. Задание {{ 4 }} Термодинамика-4
Свободная энергия есть
R Величина, определяющая работу в изотермических процессах.
5. Задание {{ 5 }} Термодинамика-5
Каноническими переменными для внутренней энергии системы с постоянным числом частиц являются
R Энтропия и объём
6. Задание {{ 6 }} Термодинамика-6
Каноническими переменными для свободной энергии системы с постоянным числом частиц являются
R Температура и объём
7. Задание {{ 7 }} Термодинамика-7
Каноническими переменными для энтальпии системы с постоянным числом частиц являются
R Энтропия и давление
8. Задание {{ 8 }} Термодинамика-8
Каноническими переменными для термодинамического потенциала Гиббса 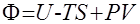 являются
являются
R Температура и давление
9. Задание {{ 9 }} Термодинамика-9
Процесс Джоуля-Томсона протекает при
R Постоянной энтальпии
10. Задание {{ 10 }} Термодинамика-10
Расширение идеального газа в пустоту сопровождается
R Сохранением внутренней энергии
11. Задание {{ 11 }} Термодинамика-11
Пусть 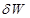 и
и 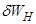 - работа, совершаемая в равновесном и неравновесном процессах, соответственно, а
- работа, совершаемая в равновесном и неравновесном процессах, соответственно, а 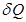 и
и 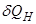 - соответствующие количества тепла. Тогда имеют место неравенства
- соответствующие количества тепла. Тогда имеют место неравенства
R 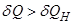 и
и 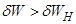
12. Задание {{ 12 }} Термодинамика-12
Второе начало термодинамики для системы с переменным числом частиц
R 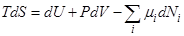
13. Задание {{ 13 }} Термодинамика-13
Уравнение Гиббса-Гельмгольца
R 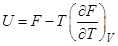
14. Задание {{ 14 }} Термодинамика-14
Из 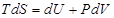 следует, что зависимость энтропии от объёма в изотермических процессах определяется выражением
следует, что зависимость энтропии от объёма в изотермических процессах определяется выражением
R 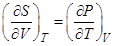
15. Задание {{ 15 }} Термодинамика-15
Из 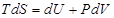 следует, что зависимость энтропии от давления в изотермических процессах определяется выражением
следует, что зависимость энтропии от давления в изотермических процессах определяется выражением
R 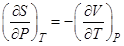
16. Задание {{ 16 }} Термодинамика-16
Второе начало термодинамики позволяет выразить зависимость внутренней энергии от объёма в изотермическом процессе через уравнение состояния в виде
R 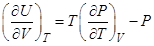
17. Задание {{ 17 }} Термодинамика-17
Второе начало термодинамики позволяет выразить зависимость энтальпии в изотермических процессах от давления через уравнение состояние в виде
R 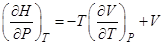
18. Задание {{ 18 }} Термодинамика-18
Выбрать правильное соотношение
R 
19. Задание {{ 19 }} Термодинамика-19
Выбрать правильное соотношение
R 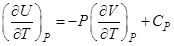
20. Задание {{ 20 }} Термодинамика-20
Выразить зависимость энтальпии от объёма в изотермических процессах через уравнение состояния
R 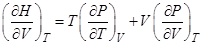
21. Задание {{ 21 }} Термодинамика-21
Выразить зависимость внутренней энергии от давления в изотермических процессах через уравнение состояния
R 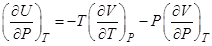
22. Задание {{ 22 }} Термодинамика-22
Выбрать правильное соотношение R 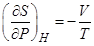
23. Задание {{ 23 }} Термодинамика-23
Изменение свободной энергии системы 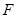 определяется соотношением
определяется соотношением
R 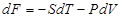
24. Задание {{ 24 }} Термодинамика-24
Изменение внутренней энергии системы 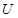 определяется соотношением
определяется соотношением
R 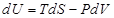
25. Задание {{ 25 }} Термодинамика-25
Изменение термодинамического потенциала Гиббса 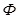 определяется соотношением
определяется соотношением
R 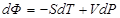
26. Задание {{ 26 }} Термодинамика-26
Свободная энергия равна
R 
27. Задание {{ 27 }} Термодинамика-27
Термодинамического потенциала Гиббса 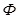 определяется соотношением
определяется соотношением
R 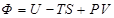
28. Задание {{ 28 }} Термодинамика-28
Энтальпия 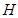 определяется соотношением
определяется соотношением
R 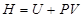
29. Задание {{ 29 }} Термодинамика-29
Большой термодинамический потенциал  определяется соотношением
определяется соотношением
R 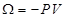
30. Задание {{ 30 }} Термодинамика-30
Выбрать правильное соотношение
R 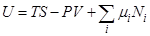
31. Задание {{ 31 }} Термодинамика-31
Каноническими переменными для химического потенциала являются
R Давление и температура
32. Задание {{ 32 }} Термодинамика-32
Химический потенциал однокомпонентной системы есть
R Величина изменения внутренней энергии при изменении числа частиц в адиабатически изолированной системе при постоянном объеме
33. Задание {{ 33 }} Термодинамика-33
Охладить систему до температур близких к абсолютному нулю можно путём
R Последовательных адиабатических расширений и изотермических сжатий.
34. Задание {{ 34 }} Термодинамика-34
Изменение большого термодинамического потенциала  определяется соотношением R
определяется соотношением R 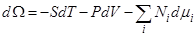
35. Задание {{ 35 }} Термодинамика-35
Уравнение Клапейрона-Клаузиуса для дифференциального уравнения кривой равновесия двух фаз имеет вид
R 
36. Задание {{ 36 }} Термодинамика-36
Энтропия идеального газа
R Логарифмически зависит от температуры
37. Задание {{ 37 }} Термодинамика-37
Энтропия данной массы идеального газа
R Логарифмически зависит от объёма
38. Задание {{ 38 }} Термодинамика-38
Первое начало термодинамики приводит к следующему выражению для теплоёмкости в произвольном процессе
R 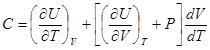
39. Задание {{ 39 }} Термодинамика-39
Отметьте правильный ответ
Второе начало термодинамики приводит к следующему выражению для разности теплоёмкостей 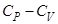 , выраженному через уравнение состояния данной массы вещества
, выраженному через уравнение состояния данной массы вещества
R 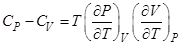
40. Задание {{ 43 }} Термодинамика-40
Теорема Карно утверждает, что
R К.п.д. обратимой тепловой машины не зависит от рабочего тела и определяется только температурами нагревателя и холодильника.
41. Задание {{ 44 }} Термодинамика-41
Третье начало термодинамики
R При стремлении температуры к абсолютному нулю энтропия в изотермических процессах перестаёт зависеть от каких-либо термодинамических параметров состояния.
42. Задание {{ 45 }} Термодинамика-42
Изменение энтропии в равновесных процессах можно вычислить по формуле
R 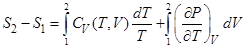
43. Задание {{ 46 }} Термодинамика-43
Пусть 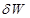 и
и 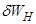 - работа, совершаемая в равновесном и неравновесном процессах, соответственно, а
- работа, совершаемая в равновесном и неравновесном процессах, соответственно, а 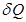 и
и 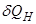 - соответствующие количества тепла. Тогда имеет место
- соответствующие количества тепла. Тогда имеет место
неравенство
R 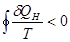
44. Задание {{ 47 }} Термодинамика-44
Из уравнения состояния системы 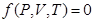 следует, что
следует, что
R 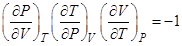
45. Задание {{ 48 }} Термодинамика-45
Вычислить энтропию одного моля идеального газа
R 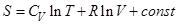
46. Задание {{ 49 }} Термодинамика-46
Уравнение состояния системы определяется выражением
R 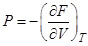 , где
, где 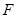 - свободная энергия системы
- свободная энергия системы
47. Задание {{ 50 }} Термодинамика-47
Выделить интенсивные термодинамические величины
R Температура
R Давление
R Химический потенциал
48. Задание {{ 51 }} Термодинамика-48
Отметьте правильный ответ
Выделить экстенсивные термодинамические величины
R Свободная энергия
R Внутренняя энергия
49. Задание {{ 52 }} Термодинамика-49
Вычислить энтропию 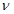 молей идеального газа (ниже величины
молей идеального газа (ниже величины 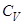 ,
, 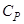 и
и 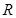 относятся к одному молю,
относятся к одному молю, 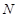 - число атомов газа)
- число атомов газа)
R 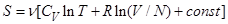
50. Задание {{ 53 }} Термодинамика-50
Вычислить изменение энтропии одного моля идеального газа при изменении его температуры от 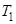 до
до 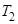 и объёма от
и объёма от 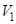 до
до 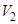 (ниже величины
(ниже величины 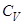 ,
, 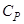 и
и 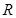 относятся к одному молю)
относятся к одному молю)
R 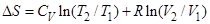
51. Задание {{ 54 }} Термодинамика-51
Вычислить изменение энтропии одного моля идеального газа в изотермическом процессе при изменении его объёма от 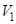 до
до 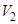 (ниже величины
(ниже величины 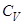 ,
, 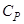 и
и 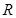 относятся к одному молю)
относятся к одному молю)
R 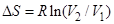
52. Задание {{ 55 }} Термодинамика-52
Вычислить изменение энтропии одного моля идеального газа при изменении его температуры от 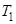 до
до 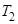 и постоянном объёме (ниже величины
и постоянном объёме (ниже величины 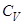 ,
, 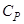 и
и 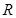 относятся к одному молю)
относятся к одному молю)
R 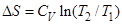
53. Задание {{ 56 }} Термодинамика-53
Один моль идеального газа расширяется изотермически, так что объём его изменяется от 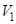 до
до 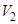 . Найти работу, произведённую при этом (ниже величины
. Найти работу, произведённую при этом (ниже величины 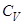 ,
, 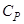 и
и 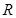 относятся к одному молю)
относятся к одному молю)
R 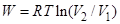
54. Задание {{ 57 }} Термодинамика-54
Один моль идеального газа расширяется изотермически, так что объём его изменяется от 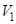 до
до 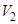 . Найти количество теплоты, поглощаемое (выделяемое) при этом системой (ниже величины
. Найти количество теплоты, поглощаемое (выделяемое) при этом системой (ниже величины 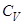 ,
, 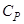 и
и 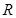 относятся к одному молю)
относятся к одному молю)
R 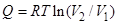
55. Задание {{ 58 }} Термодинамика-55
Идеальный газ изотермически сжимается. При этом энтропия
R Убывает
56. Задание {{ 59 }} Термодинамика-56
Термические коэффициенты определяются как:
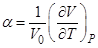 ,
, 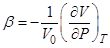 и
и 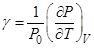
Вывести соотношение, связывающее эти коэффициенты
R 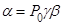
57. Задание {{ 60 }} Термодинамика-57
Термические коэффициенты определяются как:
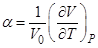 ,
, 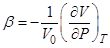 и
и 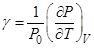
Выразить величину 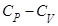 через эти коэффициенты
через эти коэффициенты
R 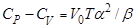
58. Задание {{ 61 }} Термодинамика-58
Пусть 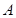 и
и 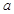 есть обобщённая термодинамическая сила и соответствующий внешний параметр. Выразить разность между теплоёмкостями
есть обобщённая термодинамическая сила и соответствующий внешний параметр. Выразить разность между теплоёмкостями 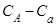 через частные производные от
через частные производные от 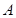 и
и 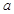 по температуре
по температуре
R 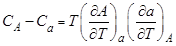
59. Задание {{ 62 }} Термодинамика-59
Термические коэффициенты определяются как:
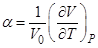 ,
, 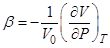 и
и 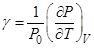
Выразить производную 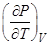 через
через 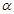 и
и 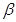
R 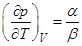
60. Задание {{ 63 }} Термодинамика-60
Исходя из уравнения Клапейрона-Клаузиуса вывести температурную зависимость равновесного давления для системы жидкость – пар, считая последний идеальным газом (ниже везде
 ,
, 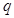 - теплота перехода из жидкого состояния
- теплота перехода из жидкого состояния
 в парообразное)
в парообразное)
R 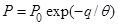
61. Задание {{ 121 }} Термодинамика-121
Цикл Дизеля состоит из
R Двух адиабат, изобары и изохоры.
62. Задание {{ 122 }} Термодинамика-122
Цикл Дизеля проходит так
R Адиабата, изобара, адиабата, изохора
63. Задание {{ 123 }} Термодинамика-123
Цикл Отто состоит из
R Двух адиабат и двух изохор
64. Задание {{ 124 }} Термодинамика-124
Цикл Отто проходит так
R Адиабаты, изохора, адиабата, изохора
65. Задание {{ 164 }} Термодинамика-164
Зависимость энтропии от давления в изотермических процессах определяется выражением
R 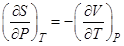
66. Задание {{ 165 }} Термодинамика-165
Зависимость энтропии от объёма в изотермических процессах определяется выражением
R 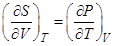
67. Задание {{ 166 }} Термодинамика-166
Зависимость энтропии от давления и объёма в изотермических процессах определяется выражениями
R 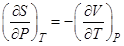 и
и 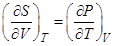
68. Задание {{ 167 }} Термодинамика-167
Зависимость внутренней энергии от объёма в изотермических процессах определяется выражением
R 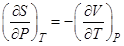
69. Задание {{ 168 }} Термодинамика-168
Средняя энергия одного атома идеального газа равна
R 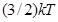
70. Задание {{ 169 }} Термодинамика-169
Средняя внутренняя энергия одного атома идеального газа
R Линейно растет с ростом температуры
71. Задание {{ 170 }} Термодинамика-170
Химический потенциал есть
R Энергия Гиббса 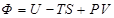 , приходящаяся на одну частицу
, приходящаяся на одну частицу
72. Задание {{ 171 }} Термодинамика-171
Изменение свободной энергии системы 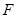 в изотермических процессах определяется соотношением
в изотермических процессах определяется соотношением
R 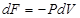
73. Задание {{ 172 }} Термодинамика-172
Изменение свободной энергии системы 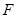 в изохорных процессах определяется соотношением:
в изохорных процессах определяется соотношением:
R 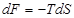
74. Задание {{ 173 }} Термодинамика-173
Изменение внутренней энергии системы 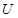 в адиабатных процессах определяется соотношением:
в адиабатных процессах определяется соотношением:
R 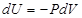
75. Задание {{ 174 }} Термодинамика-174
Изменение внутренней энергии системы 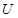 в изохорных процессах определяется соотношением
в изохорных процессах определяется соотношением
R 
76. Задание {{ 175 }} Термодинамика-175
Изменение термодинамического потенциала Гиббса 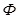 в изотермических процессах определяется соотношением
в изотермических процессах определяется соотношением
R 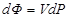
77. Задание {{ 176 }} Термодинамика-176
Изменение термодинамического потенциала Гиббса 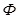 в изобарических процессах определяется соотношением
в изобарических процессах определяется соотношением
R 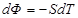
78. Задание {{ 177 }} Термодинамика-177
Изменение энтальпии системы 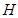 определяется соотношением
определяется соотношением
R 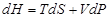
79. Задание {{ 178 }} Термодинамика-178
Изменение энтальпии системы 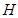 в адиабатических процессах определяется соотношением
в адиабатических процессах определяется соотношением
R 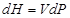
80. Задание {{ 179 }} Термодинамика-179
Изменение энтальпии системы 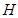 в изобарических процессах определяется соотношением
в изобарических процессах определяется соотношением
R 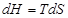
81. Задание {{ 180 }} Термодинамика-180
Внутренняя энергия связана с остальными термодинамическими величинами соотношением
R 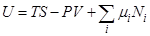
82. Задание {{ 181 }} Термодинамика-181
Изменение внутренней энергии для системы с переменным числом частиц
R 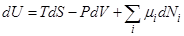
83. Задание {{ 182 }} Термодинамика-182
Изменение химического потенциала в изотермических процессах (ниже 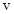 и
и 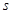 - объём и энтропия, приходящиеся на одну частицу системы)
- объём и энтропия, приходящиеся на одну частицу системы)
R 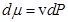
84. Задание {{ 183 }} Термодинамика-183
Изменение химического потенциала в изобарических процессах (ниже 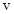 и
и 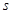 - объём и энтропия, приходящиеся на одну частицу системы)
- объём и энтропия, приходящиеся на одну частицу системы)
R 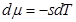
85. Задание {{ 184 }} Термодинамика-184
Выбрать правильное соотношение
R 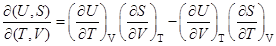
86. Задание {{ 185 }} Термодинамика-185
Выбрать правильное соотношение R 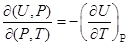
87. Задание {{ 186 }} Термодинамика-186
Внутренняя энергия системы удовлетворяет соотношению (ниже 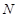 - число частиц в системе,
- число частиц в системе, 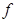 - некоторая функция)
- некоторая функция)
R 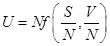
88. Задание {{ 187 }} Термодинамика-187
Свободная энергия системы удовлетворяет соотношению (ниже 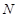 - число частиц в системе,
- число частиц в системе, 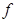 - некоторая функция)
- некоторая функция)
R 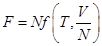
89. Задание {{ 188 }} Термодинамика-188
Энтальпия системы удовлетворяет соотношению (ниже 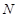 - число частиц в системе,
- число частиц в системе, 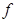 - некоторая функция)
- некоторая функция)
R 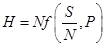
90. Задание {{ 189 }} Термодинамика-189
Потенциал Гиббса системы удовлетворяет соотношению (ниже 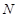 - число частиц в системе,
- число частиц в системе, 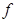 - некоторая функция)
- некоторая функция)
R 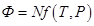
91. Задание {{ 196 }} Термодинамика-196
Вероятность флуктуации термодинамических величин пропорциональна
R 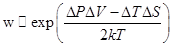
Уникальный идентификатор НТЗ: ID = 687673279
Наименование НТЗ: Термодинамика и статфизика
Расположение НТЗ: \\172.16.24.4\test\физический факультет\кафедра теоретической физики\термодинамика и статфизика_ok.ast
Авторский коллектив НТЗ: Хоконов Мурат Хазреталиевич
Дата создания НТЗ: 01.11.2003
Дата конвертации НТЗ: 25.02.2008
ВЫБОРОЧНОЕ СОДЕРЖАНИЕ ТЕСТОВЫХ МАТЕРИАЛОВ
Date: 2015-05-09; view: 1584; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |