
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Взаимосвязь между DS, DF, DG, DH и направлением процессов в закрытых системах
Изменения трех критериев направления процесса (S, G, F) графически изображены на рис.2. По оси абсцисс отложен путь процесса, под которым обычно понимают изменение какого-либо параметра в процессе химической реакции, например изменение концентрации одного из компонентов. Из рисунка видно, что в состоянии равновесия системы (точка В) все три функции (S, G, F) достигают экстремального значения: энтропия - максимума, а энергии Гиббса и Гельмгольца - минимума. Участок АВ соответствует необратимому самопроизвольному процессу, а участок ВС - несамопроизвольно протекающему процессу, для осуществления которого системе необходимо сообщить энергию извне.
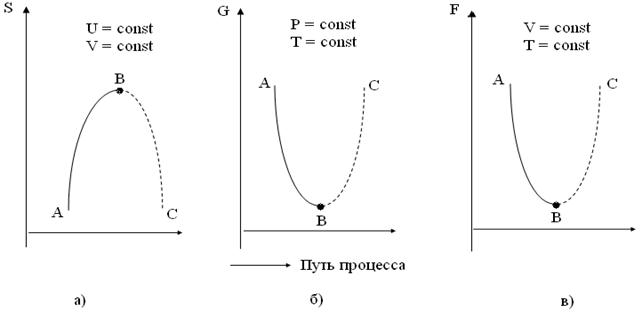
Рис. 2. Изменение энтропии (а), энергии Гиббса (б) и энергии Гельмгольца (в) в термодинамических процессах: АВ - необратимый самопроизвольный процесс; ВС - необратимый несамопроизвольный процесс; В - состояние равновесия
Определить направление протекания самопроизвольных процессов в системе можно, зная знаки DH и DS в уравнении (56). Анализ может быть представлен в виде табл.1.
Таблица 1
Направленность протекания реакций при разных знаках DH и DS
| Знак изменения функции | Возможность самопроизвольного протекания реакции | ||
| DH | DS | DG | |
| - | + | - | Возможно при любых температурах |
| - | - | ± | Возможно при достаточно низких температурах |
| + | + | ± | Возможно при достаточно высоких температурах |
| + | - | + | Невозможно при любых температурах |
· Если в системе протекает экзотермическая реакция (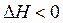 ), а энтропия системы при этом возрастает
), а энтропия системы при этом возрастает 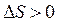 , то из уравнения (56) следует, что при всех температурах
, то из уравнения (56) следует, что при всех температурах 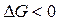 . Это значит, что реакция в системеможет протекать самопроизвольно при любых температурах.
. Это значит, что реакция в системеможет протекать самопроизвольно при любых температурах.
· Если же при экзотермической реакции (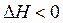 ) энтропия в системе убывает (
) энтропия в системе убывает (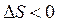 ), то реакция будет протекать самопроизвольно (т.е.
), то реакция будет протекать самопроизвольно (т.е. 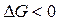 ) в том случае, когда в уравнении (56) DH по абсолютному значению будет больше, чем член TDS
) в том случае, когда в уравнении (56) DH по абсолютному значению будет больше, чем член TDS 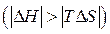 . Это возможно только при низких температурах, т.к. с ростом температуры величина TDS тоже увеличивается.
. Это возможно только при низких температурах, т.к. с ростом температуры величина TDS тоже увеличивается.
· Eсли в системе протекает эндотермическая реакция (тепло поглощается 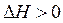 ), сопровождающаяся ростом энтропии (
), сопровождающаяся ростом энтропии ( 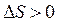 ), то самопроизвольный процесс (
), то самопроизвольный процесс (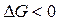 ) будет наблюдаться в том случае, когда
) будет наблюдаться в том случае, когда 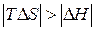 , что возможно при достаточно высоких температурах.
, что возможно при достаточно высоких температурах.
· Если же при эндотермической реакции (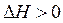 ) энтропия системы убывает (
) энтропия системы убывает (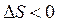 ), то самопроизвольный процесс в этом случае при любых температурах невозможен.
), то самопроизвольный процесс в этом случае при любых температурах невозможен.
Date: 2015-05-09; view: 1476; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |