
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Вычисление энтропии
Изобарный процесс (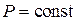 ). Согласно (5)
). Согласно (5) 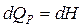 .
.
Т.к. 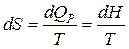 , но
, но 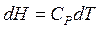 , следовательно,
, следовательно, 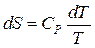 .
.
Интегрируя, получим:
 ,
,  . (36)
. (36)
Под Т1 подразумевается любая температура, меньшая, чем Т2.
Интегрирование левой части уравнения (36) можно осуществлять при разных условиях:
1) если теплоемкость не зависит от температуры, тогда результат интегрирования может быть представлен в виде
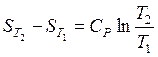 или
или 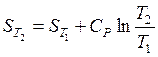 . (37)
. (37)
2) если теплоемкость зависит от температуры и эта зависимость выражается степенным рядом 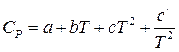 , то результаты интегрирования примут вид:
, то результаты интегрирования примут вид:
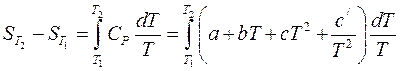 . (38)
. (38)
Согласно постулату Планка энтропия чистых твердых веществ, образующих идеальные кристаллы, при абсолютном нуле, равна нулю. Учитывая этот постулат, можно определить абсолютное значение энтропии химически чистых веществ в любом агрегатном состоянии и при любых температурах по уравнению:
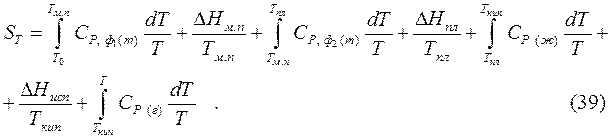
где 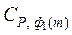 – теплоемкость вещества в первой модификации,
– теплоемкость вещества в первой модификации,
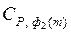 – теплоемкость вещества во второй модификации,
– теплоемкость вещества во второй модификации,
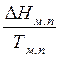 - изменение энтропии при модификационном переходе,
- изменение энтропии при модификационном переходе,
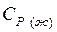 ,
, 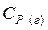 - теплоемкости вещества соответственно в жидком и газообразном состоянии,
- теплоемкости вещества соответственно в жидком и газообразном состоянии,
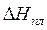 ,
, 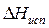 – изменение энтальпии вещества при плавлении и испарении соответственно,
– изменение энтальпии вещества при плавлении и испарении соответственно,
 ,
, 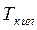 – температуры плавления и кипения вещества.
– температуры плавления и кипения вещества.
В общем виде:
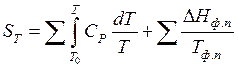 (40)
(40)
где первая сумма выражает изменение энтропии в процессе нагревания, а вторая изменение энтальпии при фазовых и модификационных переходах.
Для практических расчетов пользуются абсолютными значениями энтропии в стандартном состоянии при 298K, вычисленными при помощи постулата Планка.
Такую энтропию называют стандартной и обозначают  . Ее значения приведены в справочнике /5, табл.44; 6, табл.1/. Если T 1 в уравнении (38) равна 298, то оно принимает вид:
. Ее значения приведены в справочнике /5, табл.44; 6, табл.1/. Если T 1 в уравнении (38) равна 298, то оно принимает вид:
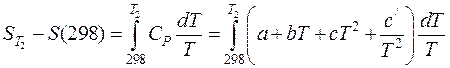 (41)
(41)
Изменение энтропии в химических реакциях рассчитывают, применяя первое следствие закона Гесса. Например, для реакции 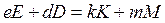 :
:
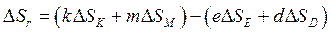 .
.
Пример 1. Рассчитать энтропию реакции при 473К
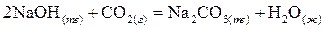
Решение. Для данного расчета, воспользовавшись первым следствием закона Гесса, запишем
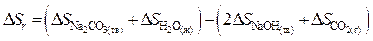
Применяя уравнения (40) и (41), для нашего случая получим:
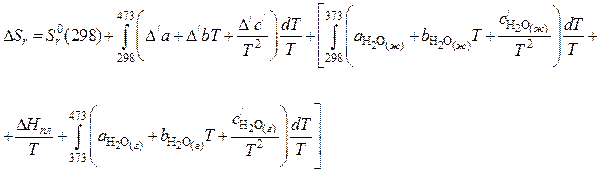
где 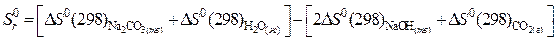 .
.
Значение стандартных энтропий веществ находим в справочнике /5, табл.44/:
а) продукты реакции:
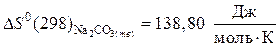 ;
;
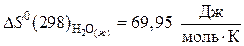 .
.
б) исходные вещества:
 ,
,
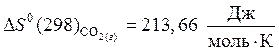 .
.
и определяем стандартную энтропию реакции:
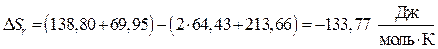 .
.
Вывод: Изменение энтропии в стандартных условиях для данной реакции равно 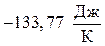 , т.е.
, т.е. 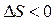 , следовательно в прямом направлении (слева направо) в этих условиях реакция не пойдет.
, следовательно в прямом направлении (слева направо) в этих условиях реакция не пойдет.
Расчет коэффициентов D/а, D/b, D/c/ приведен в примере 2 раздела 1.4.2:
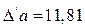 ;
;
 ;
;
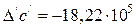 .
.
Изменение энтропии воды, имеющей в предложенном интервале температур фазовый переход при Т = 373К, будем считать отдельно.
Значения коэффициентов а, b, c¢ для воды в жидком и газообразном состоянии находим в справочнике /5, табл.44/:
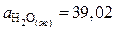 ;
; 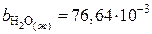 ;
; 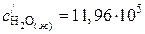 ;
;
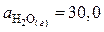 ,
, 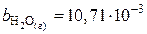 ,
, 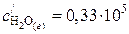 .
.
Подставив полученные данные в уравнение нашего примера, получим:
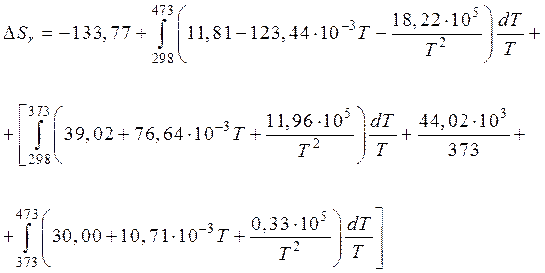
Проинтегрировав, получим

Вывод:  . В нашем примере с повышением температуры энтропия возрастает, но ее значение близко к нулю. Это позволяет предположить, что система находится в состоянии, близком к равновесию.
. В нашем примере с повышением температуры энтропия возрастает, но ее значение близко к нулю. Это позволяет предположить, что система находится в состоянии, близком к равновесию.
· Изохорный процесс (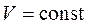 )
)
Расчет энтропии в изохорном процессе проводят аналогично расчету для изобарного процесса, только вместо изобарной теплоемкости используется изохорная теплоемкость CV:
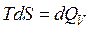 ,
, 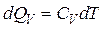 ,
, 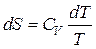 .
.
Интегрируя в интервале температур 298 - T, получаем:
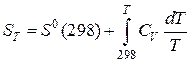 . (42)
. (42)
Если CV не зависит от температуры, то после интегрирования получим:
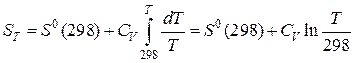 . (43)
. (43)
· Изотермический процесс (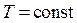 )
)
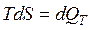 Изотермические превращения происходят без изменения внутренней энергии системы (
Изотермические превращения происходят без изменения внутренней энергии системы (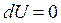 ), тогда из первого закона термодинамики:
), тогда из первого закона термодинамики:
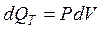 .
.
Если система подчиняется законам идеального газа, то из уравнения состояния идеального газа Клапейрона - Менделеева:
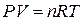 ,
,
где n - количество идеального газа в молях,
R - универсальная газовая постоянная.
В результате подстановки получим:
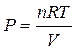 , т.е.
, т.е. 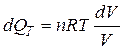 , тогда
, тогда 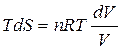
или 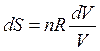 (44)
(44)
Интегрируем полученное выражение в пределах S1 - S2 и V1 - V2:

т.е. 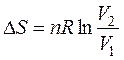 (45)
(45)
или пользуясь законом Бойля – Мариотта, 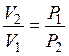 , можно записать:
, можно записать:
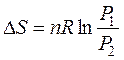 (46)
(46)
Полученными уравнениями (45) и (46) пользуются для решения задач по изотермическому расширению газов, подчиняющихся законам идеального газа.
Пример 2. Вычислить изменение энтропии при изотермическом расширении 1,7 моля идеального газа, если V1 = 0,02м3, V2 = 2м3.
Решение. Для расчета воспользуемся уравнением (45):
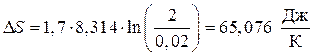 .
.
Вывод. При изотермическом расширении идеального газа в изолированной системе энтропия возрастает.
Если изотермическим превращением является изменение агрегатного или модификационного состояния вещества при постоянном давлении, то изменение энтропии для одного моля соединения определяется по формуле:
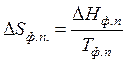 , (47)
, (47)
где 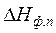 - энтальпия фазового или модификационного перехода,
- энтальпия фазового или модификационного перехода,
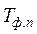 - абсолютная температура фазового или модификационногоперехода.
- абсолютная температура фазового или модификационногоперехода.
Поскольку энтропия является функцией состояния, то изменение энтропии можно определить, если известно значение параметров начального и конечного состояний системы.
Пусть начальное состояние S1 характеризуется параметрами T1 и P1, а состояние S2 - параметрами T2 и P2 (если за независимые переменные выбраны T и P).Так как изменение энтропии не зависит от пути перехода, то удобнее рассмотреть переход из состояния S1 в состояние S2, сначала изменяя температуру от T1 до T2 (при 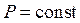 ), а затем изменяя давление от P1 до P2 (при
), а затем изменяя давление от P1 до P2 (при 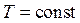 ). Суммируя изменение энтропии по этим двум процессам, получаем уравнение:
). Суммируя изменение энтропии по этим двум процессам, получаем уравнение:
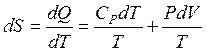 ,
,  .
.
После интегрирования получим для системы, содержащей 1 моль идеального газа:
а) если независимые переменные T и P, то
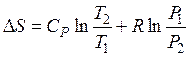 ; (48)
; (48)
б) если независимые переменные T и V, то
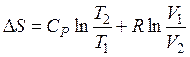 . (49)
. (49)
Пример 3. Найти изменение энтропии при изотермическом сжатии 1 моля паров бензола, при 800С от 0,4053×105 до 1,013×105 Па с последующей конденсацией и охлаждением жидкого бензола до 600С. Нормальная температура кипения бензола 800С; молярная теплота испарения бензола 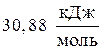 ; удельная теплоемкость жидкого бензола
; удельная теплоемкость жидкого бензола 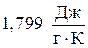 .
.
Решение. Данный процесс состоит из трех стадий:
1) изотермического сжатия паров бензола от 0,4053×105 до 1,013×105 Па;
2) конденсации паров бензола в жидкость при 800С;
3) охлаждения жидкого бензола от 80 до 600С.
Первая стадия. Процесс изотермический. Изменение энтропии рассчитывается по формуле (46)
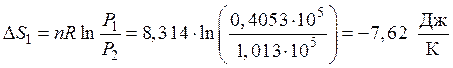 .
.
Вторая стадия. Фазовый переход - тоже изотермический процесс. Изменение энтропии рассчитывается по формуле (47). Для одного моля бензола
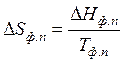 , но
, но 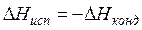 , поэтому
, поэтому
 .
.
Третья стадия. Процесс изобарный. Изменение энтропии рассчитывается по формуле (36). По условию задачи идет процесс охлаждения вещества, поэтому для рассматриваемого случая формула (36) примет вид:
 ,
,
где 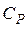 - молярная теплоемкость жидкого бензола.
- молярная теплоемкость жидкого бензола.
В условии задачи дана удельная теплоемкость 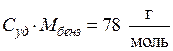 , тогда:
, тогда:
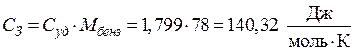 .
.
Предположим, что молярная теплоемкость жидкого бензола в данных условиях не зависит от температуры.
Подставляя полученные значения CP и интегрируя в интервале температур  , получим:
, получим:
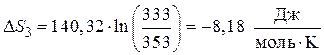 .
.
Общее изменение энтропии в системе составит:
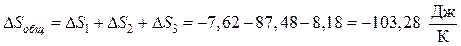
Вывод. Т.к. энтропия убывает, то рассмотренный процесс будет несамопроизвольный, т.е. в изолированной системе он невозможен.
Таким образом, были рассмотрены некоторые уравнения, позволяющие вычислить изменения энтропии по известным изменениям параметров системы и по известным теплоемкостям.
Ранее подчеркивалось, что энтропия применяется как критерий направленности процесса только для изолированных систем, что затрудняет применение её на практике, где многие технологические процессы протекают или при постоянном давлении и температуре в открытых реакторах, или при постоянном объеме и температуре в закрытых реакторах. Однако с помощью энтропии можно вычислить другие функции, которые могут выступить в роли критерия равновесия и направленности процесса. К таким функциям относятся энергия Гельмгольца (изохорно-изотермический потенциал) и энергия Гиббса (изобарно-изотермический потенциал).
Date: 2015-05-09; view: 6399; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |