
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Теплоемкость
В общем случае истинная теплоемкость определяется как отношение бесконечно малого количества теплоты, сообщаемого системе, к тому изменению температуры, которое при этом наблюдается, т.е.
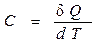 .
.
Из этого уравнения следует, что теплоемкость для разных процессов различна.
Для изохорного процесса - изохорная теплоемкость
 .
.
Для изобарного процесса - изобарная теплоемкость
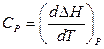 .
.
Уравнения (19) и (20) называют уравнениями Кирхгофа. Оба эти равенства справедливы для любых чистых веществ в любом агрегатном состоянии и для любой гомогенной системы с постоянным составом.
В расчетах CV определяют через CP и наоборот. Для этого необходимо знать соотношение между изобарной (CP) и изохорной (CV) теплоемкостями. Для жидких и твердых веществ эта разность мала, так как их объем почти не зависит от температуры. Для газов же эта разность (CV - CP) достаточно велика.Для идеального газа соотношение между изохорной и изобарной теплоемкостями установить не трудно.
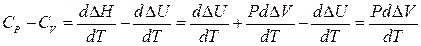 (21)
(21)
т.е. разность между CP и CV выражает работу против сил внешнего давления, производимую газом при нагревании на 10С при постоянном давлении.
Согласно уравнению Менделеева - Клапейрона для 1 моля идеального газ 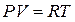 . Следовательно,
. Следовательно,  , т.е. такая работа равна универсальной газовой постоянной (R).
, т.е. такая работа равна универсальной газовой постоянной (R).
Для идеального газа 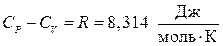 . Для реальных газов
. Для реальных газов  . Чем выше давление газа, тем больше будет разность теплоемкостей отличаться от R.
. Чем выше давление газа, тем больше будет разность теплоемкостей отличаться от R.
Теплоемкости веществ зависят от температуры. Эта зависимость может выражаться по-разному в различных интервалах температур и для различных веществ. Значения их при разных температурах или определяются из опыта, или вычисляются теоретически.
Обычно эта зависимость выражается степенным рядом, коэффициенты которого определяют опытным путем,
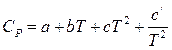 (22)
(22)
Если данное уравнение используют для расчета CP органических веществ, то коэффициент c / равен нулю. При расчете CP неорганических веществ коэффициент c равен нулю.
Это уравнение необходимо рассматривать как эмпирическое, которое справедливо в определенном интервале температур. Значение стандартной теплоемкости (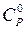 ), а также коэффициенты a, b, c и c/ приведены в справочнике /5, табл.44; 6, табл.1/.
), а также коэффициенты a, b, c и c/ приведены в справочнике /5, табл.44; 6, табл.1/.
Теплоемкость для большинства органических соединений плавно повышается с ростом температуры и для многих из них может быть выражена степенным рядом вида
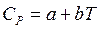 (23)
(23)
Многие органические жидкости существуют в небольшом интервале температур. В этом случае при приближенных расчетах можно не учитывать температурную зависимость теплоемкости и пользоваться стандартной теплоемкостью 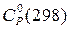 .
.
Теплоемкости чистых неорганических высококипящих жидкостей (например, расплавов BeO, BeCl2, MgBr2 и др.) практически не зависят от температуры. Для них значения CP могут быть рассчитаны по формуле, предложенной Келли, которая может применяться в широком интервале температур:
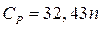 (24)
(24)
где n - число атомов, входящих в молекулу неорганического вещества.
Воспользуемся уравнениями Кирхгофа (19) и (20) и определим зависимость внутренней энергии и энтальпии от температуры. Для этого необходимо проинтегрировать данные уравнения от 0K до T:
при 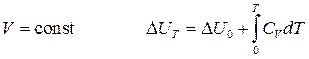 (25)
(25)
при 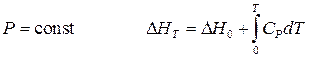 (26)
(26)
Для аналитического вычисления полученных интегралов уравнений (25), (26) необходимо знать:
· изменения внутренней энергии и энтальпии при возможных агрегатных и модификационных переходах,
· зависимость теплоемкости веществ от температуры, выражающуюся степенным рядом (22), который справедлив в определенном интервале температур.
Нижним пределом этого интервала обычно выбирается 298 К:
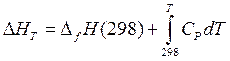 . (27)
. (27)
Уравнения Кирхгофа, проинтегрированные в интервале температур 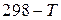 , с учетом модификационных и фазовых переходов приобретают вид:
, с учетом модификационных и фазовых переходов приобретают вид:
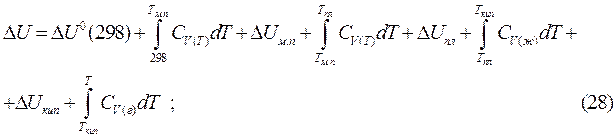
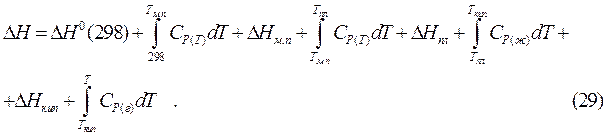
Из уравнений (27), (29) очевидно, что влияние температуры на тепловой эффект зависит от знака величины DCP:
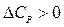 - с увеличением температуры тепловой эффект реакции будет возрастать,
- с увеличением температуры тепловой эффект реакции будет возрастать,
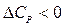 - с увеличением температуры тепловой эффект реакции будет уменьшаться,
- с увеличением температуры тепловой эффект реакции будет уменьшаться,
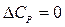 - тепловой эффект реакции не зависит от температуры.
- тепловой эффект реакции не зависит от температуры.
Применение полученных уравнений (28), (29) для расчета тепловых эффектов химических реакций рассмотрим на примере реакции
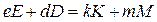 .
.
Пусть реакция протекает в интервале температур, где не происходят модификационные и фазовые переходы. Применяя 1-е следствие закона Гесса, можно записать
 ,
,
где DН(Т) для любого вещества рассчитывают по формуле (27). Учитывая зависимость теплоемкости Ср от температуры, выражающуюся степенным рядом (22), получаем
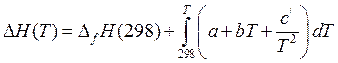 .
.
При расчете теплового эффекта реакции данное уравнение примет вид
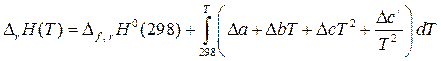 , (30)
, (30)
Dа, Db, Dc, Dc / рассчитывают по 1-му следствию закона Гесса:
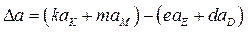 ,
,
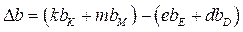 ,
,
 ,
,
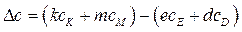 .
.
Значение коэффициентов a, b, c, c / для каждого вещества находят в справочнике /5,табл.44; 6, табл.1/.
После интегрирования получим:
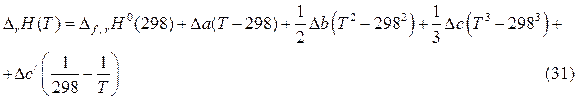
В том случае, когда химический процесс сопровождается фазовыми или модификационными переходами веществ, участвующих в реакции, необходимо учитывать тепловые эффекты этих переходов, используя уравнение (29).
Date: 2015-05-09; view: 2076; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |