
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Техническая термодинамика. основные понятия и исходные положения
основные понятия и исходные положения
ПРЕДМЕТ И МЕТОДЫ ТЕРМОДИНАМИКИ
Термодинамика изучает законы превращения энергии в различных процессах, происходящих в макроскопических системах и сопровождающихся тепловыми эффектами. Макроскопической системой называется любой материальный объект, состоящий из большого числа частиц. Размеры макроскопических систем несоизмеримо больше размеров молекул и атомов.
В зависимости от задач термодинамику разделяют на техническую или химическую термодинамику, термодинамику биологических систем и т, д. Техническая термодинамика изучает закономерности взаимного превращения тепловой и механической энергии и свойства тел, участвующих в этих превращениях. Вместе с теорией теплообмена она является теоретическим фундаментом теплотехники. На ее основе осуществляют расчет и проектирование тепловых двигателей.
Физические свойства макроскопических систем изучаются статистическим и термодинамическим методами. Статистический метод основан на использовании теории вероятностей и определенных моделей строения этих систем и представляет собой содержание статистической физики. Термодинамический метод не требует привлечения модельных представлений о структуре вещества и является феноменологическим (т. е. рассматривает «феномены» — явления в целом). При этом все основные выводы термодинамики можно получить методом дедукции, используя только два основных эмпирических закона (начала) термодинамики,
ТЕРМОДИНАМИЧЕСКАЯ СИСТЕМА
Термодинамическая система представляет собой совокупность материальных тел, находящихся в механическом и тепловом взаимодействиях друг с другом и с окружающими систему внешними телами (внешней средой).
Тела, не входящие в систему, называют окружающей средой. Систему отделяют от окружающей среды контрольной поверхностью (оболочкой). Так, например, для газа, заключенного в цилиндре над поршнем, внешней средой является окружающий воздух, а контрольными поверхностями служат стенки цилиндра, головки и поршня.
При механическом взаимодействии самой системой или над системой совершается работа. В двигателях внутреннего сгорания механическая работа производится при перемещении поршня и сопровождается изменением объема. Тепловое взаимодействие заключается в переходе теплоты между отдельными телами системы и между системой и окружающей средой.
Система может обмениваться со средой и веществом (массообменное взаимодействие). Такая система называется открытой. Потоки газа во впускных и в выпускных трубопроводах - примеры открытых систем. Если вещество не проходит через границы системы, то она называется закрытой.
Термодинамическую систему, которая не может обмениваться теплотой с окружающей средой, называют теплоизолированной или адиабатной. Примером адиабатной системы является газ, находящийся в сосуде, стенки которого покрыты идеальной тепловой изоляцией, исключающей теплообмен между заключенным в сосуде газом и окружающими телами. Такую изоляционную оболочку называют адиабатной. Система, не обменивающаяся с внешней средой ни энергией, ни веществом, называется изолированной (или замкнутой).
Простейшей термодинамической системой является рабочее тело, осуществляющее взаимное превращение теплоты и работы. В двигателе внутреннего сгорания, например, рабочим телом является приготовленная в системе смесеобразования горючая смесь, состоящая из воздуха и паров бензина.
ТЕРМОДИНАМИЧЕСКИЕ ПАРАМЕТРЫ СОСТОЯНИЯ
К термодинамическим параметрам относятся давление, абсолютная температура и удельный объем.
Давление обусловлено взаимодействием молекул рабочего тела с поверхностью и численно равно силе, действующей на единицу площади поверхности тела (р=Р/F). В соответствие с молекулярно-кинетической теорией давление газа определяется соотношением:
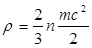 , (1.1)
, (1.1)
где n – число молекул в единице объема;
m – масса молекулы;
c2 – средняя квадратичная скорость поступательного движения молекул.
В Международной системе единиц (СИ) давление выражается в паскалях (1 Па = 1 Н/м2). Поскольку зга единица мала, удобнее использовать 1 кПа = 1000 Па и 1 МПа = 106 Па,
Давление измеряется при помощи манометров, барометров и вакуумметров. Манометры измеряют избыточное давление, представляющее собой разность между полным или абсолютным давлением р измеряемой среды и атмосферным давлением ратм, т. е. pизб = р – ратм.
Приборы для измерения давлений ниже атмосферного называются вакуумметрами; их показания дают значение разрежения (или вакуума): рв= ратм – р, т.е. избыток атмосферного давления над абсолютным.
Следует отметить, что параметром состояния является абсолютное давление. Именно оно входит в термодинамические уравнения.
Температурой называется физическая величина, характеризующая степень нагревания тела. Понятие о температуре вытекает из следующего утверждения: если две системы находятся в тепловом контакте, то в случае неравенства их температур они будут обмениваться теплотой друг с другом, если же их температуры равны, то теплообмена не будет.
Температура есть мера интенсивности теплового движения молекул (молекулярно-кинетическая теория). Ее численное значение связано с величиной средней кинетической энергии молекул вещества:
 (1.2)
(1.2)
где k — постоянна Больцмана, равная 1,380662·10-23 Дж/К. Температура Т. определенная таким образом, называется абсолютной.
В системе СИ единицей температуры является кельвин (К), на практике широко применяется градус Цельсия (°С). Соотношение между абсолютной температурой Т и стоградусной t температурой имеет вид:
Т = t +273,15 ≈ t +273.
В промышленных и лабораторных условиях температуру измеряют с помощью жидкостных термометров, пирометров, термопар и других приборов.
Удельный объем v — это объем единицы массы вещества. Если однородное тело массой М занимает объем V. то по определению v = V/M.
В системе СИ единица удельного объема 1 м3/кг. Между удельным объемом v вещества и его плотностью ρ (ρ = М / V) существует очевидное соотношение:
v =1/ ρ или v · ρ = 1.
Нормальные физические условия. Для сравнения величин, характеризующих системы в одинаковых состояниях, вводится понятие нормальные физические условия:
Р = 760 мм рт. ст. = 101,325 кПа; Т = 273,15 К или t = 00С.
В разных отраслях техники и разных странах вводят свои, несколько отличные от приведенных «нормальных условий», например, «технические»: (р = 735,6 мм.рт.ст. = 98 кПа; t = 150С). Обычно, если это не оговорено особо, используют нормальные физические условия.
Если все термодинамические параметры постоянны во времени и одинаковы во всех точках системы, то такое состояние системы называется равновесным.
Если между различными точками в системе существуют разности (градиенты) температур, давлений и других параметров, то она является неравновесной. В такой системе под действием градиентов параметров возникают потоки теплоты, вещества и другие, стремящиеся вернуть ее в состояние равновесия. Опыт показывает, что изолированная система с течением времени всегда приходит в состояние равновесия и никогда самопроизвольно выйти из него не может. В классической термодинамике рассматриваются только равновесные системы.
УРАВНЕНИЕ СОСТОЯНИЯ
Для равновесной термодинамической системы существует функциональная связь между параметрами состояния, которая называется уравнением состояния. Опыт показывает, что удельный объем, температура и давление простейших систем, которыми являются газы, пары или жидкости, связаны термическим уравнением состояния вида: f (р, v,Т) = 0.
Уравнению состояний можно придать другую форму: р = f1 (v,Т); v = f2 (р,Т); Т = f3 (v, р). Эти уравнения показывают, что из трех основных параметров, определяющих состояние системы, независимыми являются два любых.
Для решения задач методами термодинамики совершенно необходимо звать уравнение состояния. Однако, оно не может быть получено в рамках термодинамики и должно быть найдено либо экспериментально, либо методами статистической физики. Конкретный вид уравнений состояния зависит от индивидуальных свойств вещества.
Уравнение состояния идеальных газов. Из уравнений (1.1) и (1.2) следует, что ρ = nkT. Рассмотрим 1 кг газа. Учитывая, что в нем содержится N молекул и, следовательно, n =N/v, получим: pv/T = Nk = const.
Постоянную величину Nk, отнесенную к 1 кг газа, обозначают буквой R (дж/кг·град) и называют газовой постоянной. Поэтому:
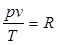 , или pv = RT. (1.3)
, или pv = RT. (1.3)
По определению - газовая постоянная есть работа, которую совершает 1 кг идеального газа в процессе р = const при изменении его температуры на 1 градус.Соотношение (1.3) представляет собой уравнение Клапейрона (1834 г.).
Умножив (1.3) на M, получим уравнение состояния для произвольной массы газа M:
pV = M RT (1.4)
Уравнению Клапейрона можно придать универсальную форму, если отнести газовую постоянную к 1 киломолю газа, т.е. к количеству газа, масса которого в килограммах численно равна молекулярной массе μ. Положив в (1.4) М = μ и V = Vμ получим для одного моля уравнение Клапейрона — Менделеева:
рVμ = μRT. (1.5)
Здесь Vμ — объем киломоля газа, а μR - универсальная газовая постоянная,
В соответствии с законом Авогадро (1811 г.) объем 1 киломоля, одинаковый в одних и тех же условиях для всех идеальных газов, при нормальных физических условиях равен 22.4 м3, поэтому:
μR = рVμ / Т = 101,325·22.4/273,15 = 8314 Дж/ (кмоль·К).
Газовая постоянная 1 кг газа составляет:
R = 8314/ μ (1.6)
Уравнение состояния реальных газов. В реальных газах в отличие от идеальных существенны силы межмолекулярных взаимодействий (силы притяжения, когда молекулы находятся на значительном расстоянии, и силы отталкивания при достаточном сближении их друг с другом), и поэтому нельзя пренебречь собственным объемом молекул.
Наличие межмолекулярных сил отталкивания приводят к тому, что молекулы могут сближаться между собой только до некоторого минимального расстояния. Поэтому можно считать, что свободный для движения молекул объем будет равен v - b, где b - тот наименьший объем, до которого можно сжать газ. В соответствии с этим длина свободного пробега молекул уменьшается и число ударов о стенку в единицу времени, а, следовательно, и давление увеличивается по сравнению с идеальным газом.
Силы притяжения действуют в том же направления, что и внешнее давление, и приводят к возникновению молекулярного (или внутреннего) давления. Сила молекулярного притяжения каких-либо двух малых частей газа пропорциональна произведению числа молекул в каждой из этих частей, т. е. квадрату плотности, поэтому молекулярное давление pмол обратно пропорционально квадрату удельного объема газа: pмол = a/v2, где а — коэффициент пропорциональности, зависящий от природы газа.
Отсюда получаем уравнение Ван-дер-Ваальса (1873 г.):
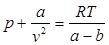 .
.
При больших удельных объемах и сравнительно невысоких давлениях реального газа уравнение Ван-дер-Ваальса практически вырождается в уравнение состояния идеального газа Клапейрона, ибо величина а/v2 (но сравнению с р) и b (no сравнению с v) становятся пренебрежимо малыми.
Уравнение Ван-дер-Ваальса с качественной стороны достаточно хорошо описывает свойства реального газа, но результаты численных расчетов не всегда согласуются с экспериментальными данными.
ОБРАТИМЫЕ И НЕОБРАИМЫЕ ПРОЦЕССЫ
Пусть в результате некоторого процесса в изолированной системе тело переходит из состояния А в состояние В и затем возвращается в начальное состояние А. Процесс называется обратимым, если возможно осуществить обратный переход из В в А через те же промежуточные состояния так, чтобы не осталось никаких изменений в окружающих телах. Если такой обратный переход осуществить нельзя, если по окончании процесса в окружающих телах или в самом теле остались какие-то изменения, то процесс является необратимым.
Любой процесс, сопровождаемый трением, является необратимым, ибо при трении часть работы всегда превращается в тепло.
Все процесс, сопровождающиеся теплопередачей от нагретого тела к менее нагретому, являются необратимыми.
Необратимыми являются процессы расширения газа, даже идеального, в пустоту.
Все реальные процессы являются необратимыми, хотя степень необратимости может быть весьма различной.
РАВНОВЕСНЫЕ И НЕРАВНОВЕСНЫЕ ПРОЦЕССЫ
Термодинамическое равновесие- это такое состояние изолированной системы, при котором все термодинамические параметры остаются неизменными в течение сколь угодно долгого времени.
Равновесным процессом называют процесс, состоящий из ряда следующих друг за другом равновесных состояний. Параметры двух таких состояний отличаются на бесконечно малую величину. Равновесный процесс может быть только бесконечно медленным процессом.
При равновесном процессе, который может протекать и в неизолированной системе, внешнее давление (или температура) взаимодействующего тела отличается от давления (или температуры) тела на бесконечно малую величину.
ПЕрвый закон термодинамики
Закон сохранения и превращения энергии является фундаментальным законом природы. Энергия не исчезает и не возникает вновь, она лишь переходит из одной формы в другую, причем убыль энергии одного вида дает эквивалентное количество энергии другого вида.
Пусть некоторому рабочему телу с объемом V и массой М, имеющему температуру Т и давление р, сообщается извне бесконечно малое количеств теплоты δQ. В результате подвода теплоты тело нагревается на dT и увеличивается в объеме на dV.
Повышение температуры тела свидетельствует об увеличении кинетической энергии его частиц. Увеличение объема тела приводит к изменению потенциальной энергии частиц. В результате внутренняя энергия тела увеличивается на dU. Поскольку рабочее тело окружено средой, которая оказывает на него давление, то при расширении оно производит механическую работу δL против сил внешнего давления. Так как никаких других изменений в системе не происходит, то по закону сохранения энергии:
δQ = dU + δА, (2.7)
т.е. теплота, сообщаемая системе, идет на приращение ее внутренней энергии U и на совершение внешней работы L.
Полученное уравнение является математическим выражением первого закона термодинамики. Каждый из трех членов этого соотношения может быть положительным, отрицательным или равным нулю. Рассмотрим некоторые частные случаи.
1) δQ = 0 — теплообмен системы с окружающей средой отсутствует, т.е. теплота к системе не подводится и от нее не отводится. Процесс без теплообмена называется адиабатным. Для него уравнение (2,7) принимает вид
δА = - dU. (2.8)
Следовательно, работа расширения, совершаемая системой в адиабатном процессе, равна уменьшению внутренней энергии данной системы, При адиабатном сжатии рабочего тела затрачиваемая извне работа целиком идет на увеличение внутренней энергии системы.
2) δА = 0 - при этом объем тела не изменяется, dV = 0. Такой процесс называется изохорным. Для этого процесса:
δQ = dU, (2.9)
т.е. количество теплоты, подведенной к системе при постоянном объеме, равно увеличению внутренней энергии данной системы.
3) dU = 0 – внутренняя энергия системы не изменяется:
δQ = δА, (2.10)
т.е. сообщаемая системе теплота превращается в эквивалентную ей внешнюю работу.
Для системы, содержащей 1 кг рабочего тела:
δq = du + δа. (2.11)
Проинтегрировав уравнение (2.7) и (2.11) для некоторого процесса, получим выражение первого закона термодинамики в интегральной форме:
Q = ΔU + А; q = Δu + а, (2.12)
где ΔU = U2 – U1; Δu = u2 – u1.
ВНУТРЕННЯЯ ЭНЕРГИЯ
Внутренняя энергия системы включает в себя:
· кинетическую энергию поступательного, вращательного и колебательного движения частиц;
· потенциальную энергию взаимодействия частиц;
· энергию электронных оболочек атомов;
· внутриядерную энергию.
В большинстве теплоэнергетических процессов две последние составляющие остаются неизменными, Поэтому обычно под внутренней энергией понимают энергию хаотического движения молекул и атомов, включающую энергию поступательного, вращательного и колебательного движений как молекулярного, так и внутримолекулярного, а также потенциальную энергию сил взаимодействия между молекулами.
Кинетическая энергия молекул является функцией температуры. Значение потенциальной энергии зависит от среднего расстояния между молекулами и, следовательно, от занимаемого газом объема V, т. е. является функцией V. Поэтому внутренняя анергия U есть функция состояния тела.
Для сложной системы она определяется суммой энергий отдельных частей, т.е. обладает свойством аддитивности. Величина u = U/M, называемая удельной внутренней энергией (Дж/кг), представляет собой внутреннюю энергию единицы массы вещества.
В дальнейшем для краткости будем называть величину u просто внутренней энергией. Поскольку внутренняя энергия есть функция состояния тела, то она может быть представлена в виде функции двух любых независимых параметров, определяющих это состояние:
u = ψ1 (p,V); u = ψ2 (p,Т); u = ψ3 (v,Т).
Ее изменение в термодинамическом процессе Δu не зависит от характера процесса и определяется только начальным и конечным состояниями тела:
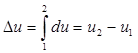 ,
,
где u1 - значение внутренней энергии в начальном состоянии, а u2 - в конечном.
Математически это означает, что бесконечно малое изменение внутренней энергии du есть полный дифференциал u.
Внутренняя энергия идеального газа, в котором отсутствуют силы взаимодействия между молекулами, не зависит от объема газа или давления, a определяется только его температурой, поэтому производная от внутренней энергии идеального газа по температуре есть полная производная:
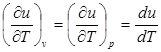 . (2.2)
. (2.2)
Для задач технической термодинамики важно не абсолютное значение внутренней энергии, а ее изменение в различных термодинамических процессах. Поэтому начало отсчета внутренней энергии может быть выбрано произвольно. В соответствии с международным соглашением для идеальных газов за нуль принимается значение внутренней энергии при температуре 00С вне зависимости от давления.
РАБОТА РАСШИРЕНИЯ
Работа в термодинамике, так же как и в механике, определяется произведением действующей на рабочее тело силы на путь ее действия.
Рассмотрим газ массой М и объемом V, заключенный в эластичную оболочку с поверхностью F (рис. 2.1).
Рис.2.1. К определению работы расширения.
Если газу сообщить некоторое количество теплоты, то он будет расширяться, совершая при этом работу против внешнего давления р, оказываемого на него средой. Газ действует на каждый элемент оболочки dF с силой, равной pdF и, перемещая ее по нормали к поверхности на расстояние dn, совершает элементарную работу pdFdn. Общую работу, совершенную в течение бесконечно малого процесса, получим, интегрируя данное выражение по всей поверхности F оболочки:
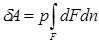 .
.
Из рис. 2.1 видно, что изменение объема dV выражается в виде интеграла по поверхности:
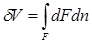 , следовательно:
, следовательно:
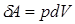 (2.3)
(2.3)
При конечном изменении объема работа против сил внешнего давления, называемая работой расширения, равна:
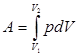 (2.4)
(2.4)
Из (2.3) следует, что при расширении работа тела положительна, при этом тело само совершает работу; при сжатии работа тела отрицательна; это означает, что не тело совершает работу, а на его сжатие затрачивается работа извне.
Единицей измерения работы в системе СИ является джоуль (Дж).
Отнеся работу расширения к 1 кг массы рабочего тела, получим:
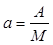 ;
; 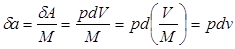 (2.5)
(2.5)
Величина l, представляющая собой удельную работу, совершаемую системой, содержащей 1 кг газа, равна:
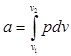 (2.6)
(2.6)
Поскольку в общем случае р — величина переменная, то интегрирование возможно лишь тогда, когда известен закон изменении давления р = р (v).
Формулы (2.3)…(2.6) справедливы только для равновесных процессов, при которых давление рабочего тела равно давлению окружающей среды.
В термодинамике для исследования равновесных процессов широко используют р - v диаграмму, в которой осью абсцисс служит удельный объем, а осью ординат - давление. Заметим, что в практике исследования поршневых двигателей используют так называемую индикаторную диаграмму рабочего (реального) цикла, которая получается с помощью специального устройства (системы), называемого индикатором (системой индицирования).
Поскольку состояние термодинамической системы определяется двумя параметрами, то на р - v -диаграмме оно изображается точкой. На рис. 2.2 точка 1 соответствует начальному состоянию системы, точка 2 — конечному, а линия 1-2 - процессу расширения рабочего тела от v1 до v2.
При бесконечно малом изменении объема dv площадь заштрихованной вертикальной полоски раина pdv = δа.
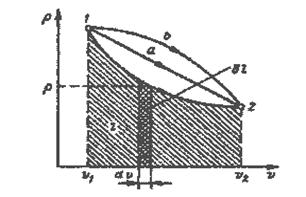
Рис.2.2. Графическое изображение работы в р- v - координатах.
Следовательно, работа процесса 1-2 изображается площадью, ограниченной кривой процесса, осью абсцисс и крайними ординатами. Таким образом, робота изменения объема эквивалентна площади под кривой процесса в диаграмме р- v.
Каждому пути перехода системы из состояния 1 в состояние 2 (например, 1-а-2 или 1-b-2) соответствует своя работа расширения:
аl1-b-2 > а1-а-2 .
Следовательно, работа зависит от характера термодинамического процесса, а не является функцией только исходного и конечного состояний системы. С другой стороны, ∫pdv зависит от пути интегрирования и, следовательно, элементарная работа δа не является полным дифференциалом.
Работа всегда связана с перемещением макроскопических тел в пространстве, например, перемещением поршня двигателя, поэтому она характеризует упорядоченную (макрофизическую) форму передачи энергии от одного тела к другому и является мерой переданной энергии.
Поскольку величина δа пропорциональна увеличению объема, то в качестве рабочих тел, предназначенных для преобразования тепловой энергии в механическую работу, целесообразно выбирать такие, которые обладают способностью значительно увеличивать свой объем. Этим качеством обладают газы и пары жидкостей. Поэтому, например, на тепловых электрических станциях рабочим телом служат пары воды, а в двигателях внутреннего сгорания — газообразные продукты сгорании топлива.
ТЕПЛОТА
Помимо макрофизической формы передачи энергии - работы существует также и микрофизическая форма, т.е. осуществляемая на молекулярном уровне форма обмена энергией между системой и окружающей средой. В этом случае энергия может быть передана системе без совершения работы. Мерой количества энергии, переданной микрофизическим путем, служит теплота.
Теплота может передаваться либо при непосредственном контакте между телами (теплопроводностью, конвекцией), либо на расстоянии (излучением), причем во всех случаях этот процесс возможен только при наличии разности (градиента) температур между телами.
Как будет показано ниже, элементарное количество теплоты δQ, так же как и δА, не является полным дифференциалом в отличие от дифференциала внутренней энергии dU. За этой математической символикой скрыт глубокий физический смысл различия понятий внутренней энергии, теплоты и работы.
Внутренняя энергия – это свойство самой системы, она характеризует состояние системы. Теплота и работа — это энергетические характеристики процессов механического и теплового взаимодействий системы с окружающей средой. Они характеризуют те количества энергии, которые переданы системе или отданы ею через ее границы в определенном процессе.
теплоемкость газов
Отношение количества теплоты δQ, полученного телом при бесконечно малом изменении его состояния, к изменению температуры тела dТ называется теплоемкостью тела в данном процессе:
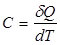 .
.
Обычно теплоемкость относят к единице количества вещества и в зависимости от выбранной единицы различают:
- удельную массовую теплоемкость c, отнесенную к 1 кг газа, Дж /(кг·К);
- удельную объемную теплоемкость c ׳, отнесенную к количеству газа, содержащегося в 1 м3 объема при нормальных физических условиях, Дж /(м3·К);
- удельную мольную теплоемкость μc, отнесенную к одному киломолю, Дж /(кмоль·К).
Взаимосвязь между удельными теплоемкостями устанавливается очевидным соотношениями:
с = μc / μ; c ׳ = сρн. (2.13)
Здесь ρн - плотность газа при нормальных условиях.
Изменение температуры газа при одном и том же количестве сообщаемой теплоты зависит от характера происходящего при этом процесса. Поэтому теплоемкость является функцией процесса. Это означает, что одно и то же рабочее тело в зависимости от процесса требует для своего нагревания на 1К различного количества теплоты.
В термодинамических расчетах большое значение имеют:
- теплоемкость при постоянном давлении (изобарная теплоемкость):
ср = δqр / dТ, (2.14)
равная отношению количества теплоты δqр, сообщенной телу в процессе при постоянном давлении, к изменению температуры тела dТ;
- т еплоемкость при постоянном объеме (изохорная теплоемкость):
сv = δqv / dТ, (2.15)
равная отношению количества теплоты δqv, подведенной к телу в процессе при постоянном объеме, к изменению температуры тела dТ. Теплоемкость тела при постоянном объеме равна производной от его внутренней энергии по температуре и характеризует темп роста внутренней энергии в изохорном процессе с увеличением температуры. То есть для идеального газа имеем: сv = du / dТ, (2.18)
Существует связь между теплоемкостями ср и сv. Для идеального газа она имеет вид:
ср = сv + R. (2.20)
Соотношение (2.20) называется уравнением Майера, которое является одним из основных в технической термодинамике идеальных газов.
В изохорном процессе (v =const) теплота сообщаемая газу, идет лишь на изменение его внутренней энергии, тогда как в изобарном процессе (р = const) теплота расходуется и на увеличение внутренней энергии и на совершение работы против внешних сил. Поэтому ср больше сv на величину этой работы.
Обычно теплоемкости определяются экспериментально, но для многих веществ их можно рассчитать методами статистической физики.
Молекула одноатомного газа имеет три степени свободы соответственно по трем составляющим в направлении координатных осей, на которые может быть разлажено поступательное движение. Молекула двухатомного газа имеет пять степеней свободы, так как помимо поступательного движения она может вращаться около двух осей, перпендикулярных линии, соединяющей атомы. Молекула трехатомного и вообще многоатомного газа имеет шесть степеней свободы, три поступательных и три вращательных.
С учетом классической теоремы о равномерном распределении энергии по степеням свободы, мольные теплоемкости μc одно-, двух- и многоатомных идеальных газов равны соответственно: 12,5; 20,8 и 24,9 кДж /(кмоль·К).
Результаты классической теории теплоемкости достаточно хорошо согласуются с экспериментальными данными в области комнатных температур, однако основной вывод о независимости от температуры экспериментом не подтверждается. Расхождения, особенно существенные в области низких и достаточно высоких температур, связаны с квантовым поведением молекул и находят объяснения в рамках квантовой теории теплоемкости.
Теплоемкость реального газа зависит от давления очень слабо.
Поскольку теплоемкость газа зависит от температуры, в термодинамике различают истинную и среднюю теплоемкости.
Средней теплоемкостью сср данного процесса в интервале температур от t1 до t2 называется отношение количества теплоты, сообщаемой газу, к разности конечной и начальной температур:
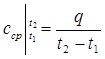 (2.21)
(2.21)
Выражение
 (2.22)
(2.22)
определяет теплоемкость при данной температуре или так называемую истинную теплоемкость.
Принцип определения средней теплоемкости с использованием зависимости истинной теплоемкости от температуры показан на рис.2.3.
Для практических расчетов теплоемкости всех веществ сводят в таблицы, причем с целью сокращения объема таблиц средние теплоемкости приводят в них для интервала температур от 0 до t.
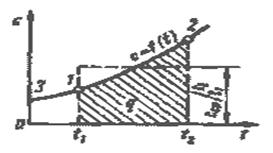
Рис.2.3. Зависимость истинной теплоемкости от температуры.
ЭНТАЛЬПИЯ
В термодинамике важную роль играет сумма внутренней анергии системы U и произведения давления системы р на ее объем V, называемая энтальпией и обозначаемая Н:
H = U + pV. (2.25)
Так как входящие неё величины являются функциями состояния, то и сама энтальпия является функцией (характеристикой) состояния рабочего тела. Так же как внутренняя энергия, работа и теплота, она измеряется в джоулях (Дж).
Энтальпия обладает свойством аддитивности. Величина
h = u + pv (2,26)
называемая удельной энтальпией (h = Н/М), представляет собой энтальпию системы, содержащей 1 кг вещества, и измеряется в Дж/кг.
Поскольку энтальпия есть функция состояния, то она может быть представлена в виде функции двух любых параметров состояния: р, v, Т. Величина dh является полным дифференциалом.
Изменение энтальпии в любом процессе определяется только начальным и конечным состояниями тела и не зависит or характера процесса. Понятие энтальпии введено в термодинамике на основе чисто формальных соображений, но можно установить и физический смысл этой величины.
Физический смысл энтальпии выясним на следующем примере. Рассмотрим расширенную систему, включающую газ в цилиндре и поршень с грузом общим весом G (рис 2.4). Энергия этой системы складывается из внутренней энергии газа и потенциальной энергии поршня с грузом в поле внешних сил: Е = U + pV. В условиях равновесия (G = р·F×y) эту функцию можно выразить через параметры газа:
Е = р·F×y = U + pV.
Получаем, что Е = Н, т.е. энтальпию можно трактовать как энергию расширенной системы.
В случае, когда единственным видом работы является работа расширения, с учетом очевидного соотношения pdv = d (pv) - v dp можно записать:
δq = d(u + pv) - vdp, или
δq = dh - v dp. (2.27)
Из этого соотношения следует, что если давление системы сохраняется неизменным, т.е. осуществляется изобарный процесс (dp = 0), то
δqр = dh. (2.28)

Рис.2.4. К определению физического смысла энтальпии.
Следовательно:
qр = h2 – h1. (2.29)
Таким образом, теплота, подведенная к системе при постоянном давлении, идет только на изменение энтальпии данной системы.
Это выражение очень часто используется в расчетах, так как огромное количество процессов подвода теплоты в теплоэнергетике (в тепловых двигателях, теплообменных аппаратах и др.) осуществляется при постоянном давлении. Кстати, по этой причине в таблицах термодинамических свойств обычно приводятся значения энтальпии, а не внутренней энергии.
Для идеального газа с учетом того, что d(pv)= R dТ, имеем:
dh = du + d(pv)= сv dТ + R dТ = (сv + R) dТ = ср dТ. (2.30)
Так как между энтальпией к внутренней энергией существует связь (2.26), выбор начала отсчета одной из них не произволен: в точке, принятой за начало отсчета внутренней энергии, h = pv. Например, для воды при t = 0,01 °С и р = 610,8 Па, u = 0. а h = рv = 610,8×0,001 = 0,611 Дж/кг.
При расчетах практический интерес представляет изменение энтальпии в конечном процессе:
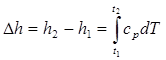 (2.31)
(2.31)
Функции состояния и функции процессов. Все наиболее важные термодинамические величины можно разделить на две группы.
К первой группе следует отнести:
1) давление р, н/м2 или Па;
2) удельный объем v (характеристика плотности рабочего тела), м3/кг;
3) температура Т или t, К или 0С;
4) внутренняя энергия u, Дж/кг;
5) энтальпия h, Дж/кг.
Ко второй группе:
1) теплота (удельная теплота) Q (q), Дж (Дж/кг);
2) работа газа (удельная работа газа), А (а), Дж (Дж/кг).
Для параметров первой группы общим свойством является то, что они определяются только состоянием рабочего тела и не зависят от того, каким образом (в результате какого процесса), тело пришло в данное состояние. На этом основании величины этой группы принято называть функциями состояния. На координатной плоскости (например, р-v) каждому состоянию соответствует некоторая вполне определенная точка.
Вторая группа величин не определяет состояние рабочего тела, а характеризует процесс. Так как работа и теплота представляют собой две возможные формы передачи энергии от одного тела к другому, и их значение зависит от характера процесса, происходящего с этим телом, то их называют функциями процесса.
Контрольные задачи.
1. 1 л воды нагревается с помощью электрического кипятильника мощностью 300 Вт. За какое время вода нагреется до температуры кипения, если теплообмен с окружающей средой отсутствует, а начальная температура воды равна 200С.
2. Найти среднюю удельную теплоемкость азота винтервале температур 1000…20000.
ВТОРОЙ ЗАКОН ТЕРМОДИНАМИКИ
ЭНТРОПИЯ
Как уже указывалось, величина δq = du+ pdv не является полным дифференциалом. Действительно, для того чтобы проинтегрировать правую часть этого выражения, нужно знать зависимость р от v, т.е. процесс, который совершает газ.
В математике доказывается, что дифференциальный двучлен всегда можно превратить в полный дифференциал путем умножения (или деления) на интегрирующий множитель (или делитель), Таким интегрирующим делителем для элементарного количества теплоты δq является абсолютная температура Т.
Покажем это на примере изменения параметров идеального газа в равновесных процессах:
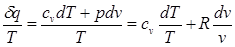 (3.1)
(3.1)
Выражение δq/Т при равновесном изменении состояния газа есть полный дифференциал некоторой функции состояния. Она называется энтропией, обозначается для 1 кг газа через s и измеряется в Дж /(кг·К) Для произвольного количества газа энтропия, обозначаемая через S, равна S = Ms и измеряется в Дж/К. Таким образом, аналитически энтропия определяется следующим образом;
ds = δq/Т, (3.2)
Формула (3,2) справедлива как для идеальных газов, так и для реальных тел.
Подобно любой другой функции состояния энтропия может быть представлена в виде функции любых двух параметров состояния:
s = f1 (р, v); s = f2 (р, Т); s = f3 (v,Т).
Значение энтропии для заданного состояния определяется интегрированием уравнения (3.2):

где s0 — константа интегрирования.
При температурах, близких к абсолютному нулю, все известные вещества находятся в конденсированном состоянии. В. Нернст (1906 г.) экспериментально установил, а М Планк (1912 г.) окончательно сформулировал следующий принцип: при температуре, стремящейся к абсолютному нулю, энтропия вещества, находящегося в конденсированном состоянии с упорядоченной кристаллической структурой, стремится к нулю, т.е s0 = 0 при Т =0 К. Этот закон называют третьим законом термодинамики или тепловой теоремой Нернста. Он позволяет рассчитать абсолютное значение энтропии в отличие от внутренней энергии и энтальпии, которые всегда отсчитываются от произвольного уровня.
Однако в технической термодинамике обычно используется не абсолютное значение энтропии, а ее изменение в каком-либо процессе:
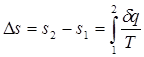 (3.3)
(3.3)
Поэтому энтропию тоже часто отсчитывают от произвольно выбранного уровня. Получим формулы, позволяющие вычислить изменение энтропия идеального газа, Для этого проинтегрируем уравнение (3.1), положив для простоты cv = const:
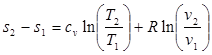 (3.4)
(3.4)
Из уравнения Клапейрона, записанного дли состояний 1 н 2, следует:
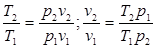 .
.
После подстановки отношений Т2/Т1 и v2/v1 в выражение (3.4) получим следующие формулы для изменения энтропии идеального газа:
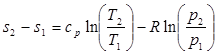 (3.5)
(3.5)
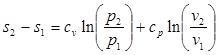 (3.6)
(3.6)
Поскольку энтропия есть функция состояния рабочего тела, уравнениями (3.4)…(3.6) можно пользоваться вне зависимости от пути перехода рабочего тела между состояниями 1 и 2 и, в частности, от того, равновесный этот переход или нет.
Понятие энтропии позволяет ввести чрезвычайно удобную для термодинамических расчетов Т-s - диаграмму, на которой (как и на р-v - диаграмме) состояние термодинамической системы изображается точкой, а равновесный термодинамический процесс линией (рис.3.1).
Из уравнении (3.2) следует, что в равновесном процессе:
δq = Тds (3.7)
 (3.8)
(3.8)
Очевидно, что в Т-s - диаграмме элементарная теплота процесса δq изображается элементарной площадкой с высотой Т и основанием ds, а площадь, ограниченная линией процесса, крайними ординатами и осью абсцисс, эквивалентна теплоте процесса.
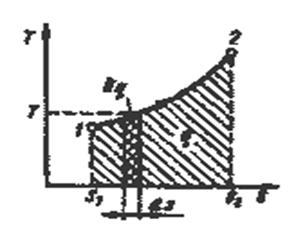
Рис.3.1. Графическое изображение теплоты в Т-s – координатах.
Формула (3.7) показывает, что ds и δq имеют одинаковые знаки, следовательно, по характеру изменения энтропии в равновесном процессе можно судить о том, в каком направлении происходит теплообмен. При подводе теплоты к телу (δq > 0) его энтропия возрастает (ds> 0), а при отводе теплоты (δq <0) - убывает (ds <0).
ОБЩАЯ ФОРМУЛИРОВКА ВТОРОГО ЗАКОНА
Из первого закона термодинамики следует, что взаимное превращение тепловой и механической энергии в двигателе должно осуществляться в строго эквивалентных количествах. Двигатель, который позволял бы получать работу без энергетических затрат, называется вечным двигателем первого рода. Ясно, что такой двигатель невозможен, ибо он противоречит первому закону термодинамики. Поэтому первый закон можно сформулировать в виде следующего утверждения: вечный двигатель первого рода невозможен. В 1755 г. французская Академия наук «раз и навсегда» объявила, что не будет больше принимать на рассмотрение какие-либо проекты вечных двигателей.
Несмотря на эквивалентность теплоты и работы, процессы их взаимного превращения неравнозначны. Опыт показывает, что механическая энергия может быть полностью превращена в теплоту, например, путем трения, однако теплоту полностью превратить в механическую энергию в периодически повторяющемся процессе нельзя. Многолетние попытки осуществить такой процесс не увенчались успехом, Это связано с существованием фундаментального закона природы, называемого вторым законом термодинамики. Чтобы выяснить его сущность, обратимся к принципиальной схеме теплового двигателя (ряс. 3.2).

Рис.3.2. Термодинамическая схема теплового двигателя.
Как показал опыт, все без исключения тепловые двигатели должны иметь горячий источник теплоты, рабочее тело, совершающее замкнутый процесс - цикл и холодный источник теплоты.
Практически в существующих тепловых двигателях горячими источниками служат химические реакции сжигания топлива, а в качестве холодного источника используется окружающая среда — атмосфера. В качестве рабочих тел, как отмечалось выше, применяются газы или пары.
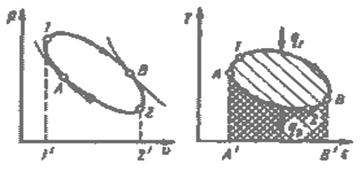
Рис.3.3. Круговой процесс (цикл) в р-v и Т-s – координатах.
Работа двигателя осуществляется следующим образом (рис. 3.3). Расширяясь по линии 1-В-2, рабочее тело совершает работу, равную площади 1- В-2-2´-1´. В непрерывно действующей тепловой машине этот процесс должен повторяться многократно. Для этого нужно уметь возвращать рабочее тело в исходное состояние. Такой переход можно осуществить в процессе 2-B-1, но при этом потребуется совершить над рабочим телом ту же самую работу. Ясно, что это не имеет смысла, так как суммарная работа - работа цикла - окажется равной нулю.
Для того чтобы двигатель непрерывно производил механическую энергию, работа расширения должна быть больше работы сжатия. Поэтому кривая сжатия 2-A-I должна лежать ниже кривой расширения. Затраченная в процессе 2-А-1 работа изображается площадью 2-А-1-1'-2'. В результате каждый килограмм рабочего тела совершает за цикл полезную работу lц, эквивалентную площади 1-В-2-А-1, ограниченной контуром цикла. Цикл можно разбить на два участка: А-1-В, на котором происходит подвод теплоты q1, и В-2-А, на котором происходит отвод теплоты q2. В точках А и В нет ни подвода, ни отвода теплоты, и в этих точках поток теплоты меняет знак. Таким образом, для непрерывной работы двигателя необходим циклический процесс, в котором к рабочему телу от горячего источника подводится теплота q1 и отводится от него к холодному источнику теплота q2. В Т-s - диаграмме теплота q1 эквивалентна площади А´-А-1-В-В´, а q2 — площади А´-А-2-В-В´.
Применим первый закон термодинамики к циклу, который совершает 1 кг рабочего тела: 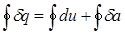
Здесь 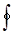 означает интегрирование по замкнутому контуру 1-B-2-A-1.
означает интегрирование по замкнутому контуру 1-B-2-A-1.
Внутренняя энергия системы является функцией состояния. При возвращении рабочего тела в исходное состояние она также приобретает исходное значение.
Поэтому  , и предыдущее выражение превращается в равенство:
, и предыдущее выражение превращается в равенство:
qц = ац (3.9)
где 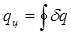 представляет собой ту часть теплоты горячего источника, которая превращена в работу. Это — теплота, полезно использованная в цикле, она равна разности теплот q1 - q2 и эквивалентна площади, ограниченной контуром цикл в Т-s - диаграмме,
представляет собой ту часть теплоты горячего источника, которая превращена в работу. Это — теплота, полезно использованная в цикле, она равна разности теплот q1 - q2 и эквивалентна площади, ограниченной контуром цикл в Т-s - диаграмме,
Отношены работы, производимой двигателем за цикл, к количеству теплоты, подведенной за этот цикл от горячего источника, называется термическим коэффициентом полезного действия (КПД) цикла:
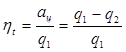 (3.10)
(3.10)
Коэффициент полезного действия оценивает степень совершенства цикла теплового двигателя. Чем больше КПД, тем большая часть подведенной теплоты превращается в работу.
Соотношение (3.9) является математическим выражением принципа эквивалентности тепловой и механической энергии,
Отметим, что если исключить из схемы теплового двигателя холодный источник, то формально принцип эквивалентности не будет нарушен. Однако, как показывает опыт и как следует из проведенного выше анализа работы двигателя, такой двигатель работать не будет.
Тепловой двигатель без холодного источника теплоты, т, е. двигатель, полностью превращающий в работу всю полученную от горячего источнике теплоту, называется вечным двигателем второго рода.
Таким образом, второй закон термодинамики можно сформулировать в виде следующего утверждения: «Вечный двигатель второго рода невозможен». В более расшифрованном виде эту формулировку в 1851 г. дал В. Томсон: «Невозможна периодически действующая тепловая машина, единственным результатом действия которой было бы получение работы за счет отнятия теплоты от некоторого источника»,
Проблема создания вечного двигателя привлекала исследователей на протяжении длительного времени. Человечество овладело бы неисчерпаемыми запасами внутренней энергии, если бы был построен вечный двигатель второго рода. Действительно, количество теплоты, выделяющейся при охлаждении, например, земного шара всего на 1К [масса земного шара: 6·1024 кг, удельная теплоемкость: 840 Дж /(кг·К)] равно 5-1027 Дж. Для сравнения следует указать. что а 2000 г, мировое потребление всех энергоресурсов не превышало 5·1020 Дж, т. е. в 10 миллионов раз меньше этой величины.
ЦИКЛ КАРНО
Среди множества исследованных циклов тепловых двигателей именно цикл Карно занимает особое место, выполняя важную научно-методическую роль в общей теории термодинамики. Он служит своеобразным эталоном для оценки совершенства других теплосиловых циклов, преобразующих теплоту в работу. С его помощью определяют максимально возможный КПД этого преобразования в заданном интервале температур.
Рабочий цикл этой идеальной тепловой машины состоит из двух равновесных изотермических и двух равновесных адиабатных процессов. В машине отсутствуют всякие потери на теплопроводность, лучеиспускание, трение и т. д. С машиной связаны два резервуара теплоты. Один, имеющий температуру Т1, называемы нагревателем, теплоотдатчиком, горячим источником теплоты, другой, имеющий более низкую температуру Т2- холодильник, теплоприемник, холодный источник теплоты.
В качестве рабочего вещества может быть взято любое упругое тело, хотя обычно рассматривается машина с идеальным газом.
Машина состоит из цилиндра, заполненного рабочим веществом. Поршень цилиндра может перемещаться вертикально, на нем укреплен столик С с песком, который можно сбрасывать на полочки П, мимо которых проходит столик при перемещении поршня.
В цилиндре находится идеальный газ, стенки цилиндра не проводят теплоту, но дно является идеальным проводником теплоты.
Поставим цилиндр на резервуар тепла- теплоотдатчик, имеющий температуру Т1; начальная температура рабочего вещества в цилиндре также должна равняться Т1.
Заставим теперь рабочее вещество в цилиндре расширятся изотермически. Для этого будем сбрасывать песок бесконечно малыми порциями на полки, мимо которых перемещается поршень со столиком. При сбрасывании песка такими порциями внешнее давление на поршень уменьшается бесконечно медленно, и процесс расширения будет равновесным. Приток теплоты от теплоотдатчика при таком расширении идет изотермически.
Если на диаграмме состояния начальное состояние газа изображено точкой 1, то процесс изотермического расширения изобразится изотермой 1-2. Когда объем достигает величины V2 цилиндр снимаем с теплового резервуара и поставим на изолирующую подставку В, не проводящую теплоту. Дальнейшее расширение газа производим адиабатно, продолжая сбрасывать песок на полки. Работа подъема груза теперь совершается за счет внутренней энергии газа, его температура понижается. Когда температура рабочего вещества станет равной температуре Т2 второго резервуара теплоты- теплоприемника (точка 3 на диаграмме состояния), снимем цилиндр с изолирующей подставки, поместим его на теплоприемник и начнем изотермически сжимать рабочее тело, сбрасывая бесконечно малыми порциями песок с полочек на столик, когда он перемещается мимо них. При этих условиях процесс идет изотермически- теплота, в которую превращается работа сжатия газа, передается теплоприемнику. Когда будет достигнута точка 4, лежащая на одной адиабате с точкой 1, изображающей начальное состояние газа, снимем цилиндр с теплообменника и вновь перенесем его на теплоизолирующую подставку и дальнейшее сжатие производим адиабатно, продолжая сбрасывать песок с полочек на столик. Температура рабочего тела повышается. Процесс прекращаем, когда тело вернется в исходное состояние 1.
Таким образом, осуществлен цикл, состоящий из двух изотермических процессов (расширения и сжатия) и двух адиабатных процессов (тоже расширения и сжатия).
Во время осуществления этого цикла рабочее тело получает от теплоотдатчика количество теплоты Q1 и отдает теплоприемнику количество теплоты Q2. За счет разности этих количеств теплоты совершается работа поднятия некоторого количества песка на большую высоту, чем та, на которой он находился в начале цикла. Действительно, при изотермическом расширении давление газа падает медленно, поэтому со столика на полки приходится сбрасывать немного песка. При адиабатном расширении давление падает быстро, поэтому количество сбрасываемого на полки песка должно быть значительно больше. При изотермическом сжатии давление растет медленно, поэтому с верхних полок на столик приходится сбрасывать мало песка; когда же происходит адиабатное сжатие, давление растет быстро, поэтому количество сбрасываемого с нижних полок песка будет значительно больше.
На столике после окончания цикла, очевидно, должно быть столько же песка, сколько его было вначале. Таким образом, работа цикла сводится к тому, что песок перемещается с нижних полок на верхние, т. к. со столика на нижние полки сбрасывается немного песка, а с полок на столик- много. На верхних полках, наоборот, со столика при адиабатном расширении сбрасывается много песка, а при изотермическом сжатии с полок на столик очень много. Для этого на нижних полках должен быть достаточно большой запас песка.
Рассчитаем коэффициент полезного действии идеальной тепловой машины, работающей по циклу Карно:
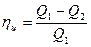 .
.
Полезная работа Ац=Q1-Q2 равна сумме всех работ, выполненных при осуществлении отдельных частей цикла.
q1=T1(s2-s1).
q2=T2(s2-s1).
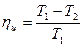 .
.
Рис.3.4. Цикл Карно.
Таким образом, в результате цикла каждый килограмм газа получает от горячего источника теплоту q1, отдает холодному теплоту q2 и совершает работу ац.
Подставив в формулу (3.10), справедливую дли любого цикла, выражения для q1 и q2, подучим, что термический КПД цикла Карно определяется формулой:
ηц = 1 – Т1/Т2 (3.11)
Из нее видно, что термический КПД цикла Карно зависит только от абсолютных температур горячего и холодного источников. Увеличить КПД цикла можно либо за счет увеличения температуры горячего источника, либо за счет уменьшения температуры холодного, причем влияние температур Т1 и Т2 на значение ηц различно. Увеличение температуры горячего источника в меньшей степени повышает КПД цикла Карно, чем такое же (в Кельвинах) уменьшение температуры холодного.
Являясь следствием второго закона термодинамики, формула для КПД цикла Карно, естественно, отражает его содержание. Из нее видно, что теплоту горячего источника можно было бы полностью превратить в работу, т.е. получить КПД цикла, равный единице, лишь в случае, когда Т1 → ∞, либо Т2 → 0. Оба значения температур недостижимы. (Недостижимость абсолютного нуля температур следует из третьего начала термодинамики)
При Т1 = Т2, термический КПД цикла равен нулю. На это указывает и КПД идеального цикла: невозможность превращения теплоты в работу, если все тела системы имеют одинаковую температуру, т.е. находятся между собой в тепловом равновесии.
Следует иметь в виду, что коэффициент полезного действия теоретического цикла Карно всегда выше любого произвольного цикла, имеющего одинаковые максимальную и минимальную температуры рабочего тела.
Контрольные вопросы и задачи.
1. Возможен ли процесс, в котором теплота, подведенная от горячего источника, полностью превращается в работу?
2. Какой максимальный КПД теплового двигателя, работающего между температурами 400 и 180С
3. Показать, что две адиабата не могут пересекаться друг с другом,
4.основные термодинамические процессы в газах
4.1. ТЕРМОДИНАМИЧЕСКИЕ ПРОЦЕССЫ ИДЕАЛЬНЫХ ГАЗОВ В ЗАКРЫТЫХ СИСТЕМАХ
Основными процессами, весьма важными и в теоретическом, и в прикладном отношениях, являются: изохорный, протекающий при постоянном объеме (v = const); изобарный, протекающий при постоянном давлении (р = const); изотермический, происходящий при постоянной температуре (Т = const); адиабатный — процесс, при котором отсутствует теплообмен с окружающей средой, и политропный, удовлетворяющий уравнению рvn = const.
Метод исследования процессов, не зависящий от их особенностей и являющийся общим, состоит в следующем:
· выводится уравнение процесса, устанавливающее связь между начальными и конечными параметрами рабочего тела в данном процессе;
· вычисляется работа изменения объема газа;
· определяется количество теплоты, подведенной (или отведенной) к газу в процессе;
· определяется изменение внутренней энергии системы в процессе;
· определяется изменение энтропии системы в процессе.
Изохорный процесс. При изохорном процессе выполняется условие dv=0 или v = const. Из уравнения состояния идеального газа (1.3) следует, что р/Т= R/v = const, т. е. давление газа прямо пропорционально его абсолютной температуре:
 (4.1)
(4.1)
На рис. 4.1 представлен график изохорного процесса. Работа расширения в этом процессе равна нулю, так как dv=0.

Рис.4.1. Изображение изохорного процесса в р-v и Т-s - координатах.
Количество теплоты, подведенной к рабочему телу в процессе 1-2 при v = const, определяется из соотношений (2.23):
 (4.2)
(4.2)
Так как а = 0, то в соответствии с первым законом термодинамики Δu = q:
Δu =cv (Т2 – Т1). (4.4)
Изменение энтропии в изохорном процессе определяется с учетом (3.6):
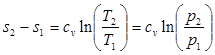 (4.5)
(4.5)
Из (4.5) следует, что зависимость энтропии от температуры в изохорном процессе имеет логарифмический характер (рис.4.1).
Изобарный процесс. Из уравнения состояния идеального газа (1.3) при р = const находим, что v/T=R/p = const, или:
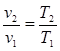 . (4.6)
. (4.6)
То есть, в изобарном процессе объем газа пропорционален его абсолютной температуре (закон Гей-Люссака, 1802 г.). На рис. 4.2 изображен график процесса.
Из выражения (2.6) следует, что:
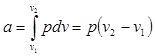 (4.7)
(4.7)
Так как pv1 = RT1 и pv 2= RT2. то одновременно:
а = R (Т2 – Т1) (4.8)
Количество теплоты, сообщаемое газу при нагревании (или отдаваемое им при охлаждении), находим из уравнения (2.23):
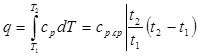 (4.9)
(4.9)
где ср ср. —средняя массовая изобарная теплоемкость в интервале температур от t1 до t2.
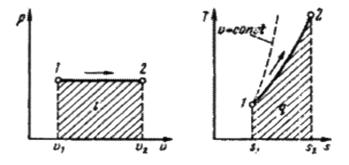
Рис.4.2. Изображение изобарного процесса в р-v и Т-s – диаграммах.
При ср =const:
q = ср (t2- t1) (4.10)
Изменение энтропии при ср =const, согласно (3.5) равно:
 , (4.11)
, (4.11)
т. е. температурная зависимость энтропии при изобарном процессе тоже имеет логарифмический характер, но поскольку ср > сv, то изобара в Т-s -диаграмме идет более полого, чем изохора (правый график на рис.4.2).
Изотермический процесс. При изотермическом процессе температура постоянна, следо
Date: 2015-05-09; view: 1783; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |